长期施肥对水田和旱地土壤微生物群落结构、活性碳氮及酶活性的影响
2018-05-21王桂跃韩海亮谭禾平赵福成
王桂跃,苏 婷,韩海亮,谭禾平,包 斐,赵福成
(浙江省农业科学院 东阳玉米研究所,浙江 东阳 322100)
土壤微生物是土壤生态系统的重要组成部分,参与土壤中几乎一切生物化学反应,对维持土壤生态平衡具有重要作用[1]。微生物群落对环境条件的变化反应敏捷,因而常被作为生态风险评估的敏感性生物指标之一[2]。土壤微生物生物量既是土壤有机质和土壤养分转化与循环的动力,又可作为土壤中植物有效养分的储备库,对土壤环境因子的变化极为敏感,土壤的微小变动均会引起其活性变化[3]。土壤微生物生物量的主要组成包括微生物量碳(microbial biomass carbon,MBC)和微生物量氮(microbial biomass nitrogen,MBN)。溶解性有机碳(dissolved organic carbon,DOC)和溶解性有机氮(dissolved organic nitrogen,DON)是土壤溶解性有机质的2个重要组成部分。MBC、MBN、DOC和DON是对土壤质量变化响应最明显和最迅速的土壤活性组成部分[4]。土壤酶是土壤物质循环和能量流动的重要参与者,是土壤有机体的代谢动力,在土壤生态系统中发挥着重要作用[5]。因此,土壤微生物群落、活性碳氮含量,以及土壤酶活性常被用来评价土壤的生物学性状。
施肥是影响土壤质量演化及其可持续利用最为深刻的农业措施之一[3],它通过改变土壤微生物活性、数量和群落结构,从而改变土壤C、N养分转化速率和途径,影响土壤供氮能力和碳储备能力,进而影响土壤质量。有关施肥对土壤物理、化学性质及环境的影响,已有大量研究[6],但涉及土壤生物学特性的研究较少。近20年来,土壤生物学特性在土壤肥力研究中的地位显著加强。前人研究认为,施用有机肥料可以显著提高土壤微生物量碳、氮的含量,以及土壤酶活性,并且随着用量的增大,效果也随之增强[7-8]。另有研究表明,施用化学肥料也能提高土壤微生物量碳的含量[9]。但是,王继红等[10]研究表明,过量施用化肥会使土壤微生物量碳的含量降低,而适量施用氮肥或磷肥均能够使土壤中微生物生物量碳、氮含量增加[11]。路磊等[12]研究也表明,单施化肥使土壤中的微生物生物量氮的含量降低,王俊华等[13]和卜洪震等[14]长期施肥研究结果表明,与单施化肥相比,有机肥与化肥配合施用条件下土壤中微生物生物量碳的含量提高更显著。然而,迄今在该领域的研究大多集中在单一施用化肥或有机肥对少数土壤微生物学指标的影响上,关于长期测土配方施肥下土壤微生物群落、微生物量,以及土壤酶活性等多种土壤生物学指标的变化,尚缺少相关研究。
本研究在浙江省东阳玉米研究所定位监测基地通过6 a的测土配方试验,旨在了解长期施肥对水田和旱地土壤微生物群落结构、活性碳氮含量及酶活性的影响,以期为科学施肥、保护和合理利用现有耕地资源提供重要依据。
1 材料与方法
1.1 供试土壤与试验设计
定位试验于2009年开始,在浙江省东阳玉米研究所基地内进行,土壤为黄红壤,0~20 cm土层土壤基本理化性状:有机质13.8 g·kg-1,全氮 0.50 g·kg-1,全磷0.42 g·kg-1,全钾1.54 g·kg-1,速效氮 21.6 mg·kg-1,有效磷 3.25 mg·kg-1,速效钾 20.3 mg·kg-1,pH值5.42。试验共设6个处理:①PCK,水田无肥区,不施用任何肥料;②PCF,水田常规施肥区,按当地主要施肥量(N,210 kg·hm-2;P2O5,60 kg·hm-2;K2O,70 kg·hm-2)及化学肥料品种(尿素、过磷酸钙、氯化钾)施肥;③PSTF,水田测土配方施肥纯化肥区,根据土壤养分情况和作物确定最佳施肥量(N,225 kg·hm-2;P2O5,85 kg·hm-2;K2O,120 kg·hm-2),肥料品种同PCF;④PSTF+OF,水田测土配方施肥化肥+有机肥区,在PSTF的基础上增施商品精致有机肥(有机质含量45%,N 1.8%+P2O51.6%+K2O 2.2%)22 500 kg·hm-2;⑤DCF,旱地常规施肥区,N、P2O5、K2O投入量分别为275、60、175 kg·hm-2,肥料分别选用尿素、钙镁磷肥和氯化钾;⑥DSTF+OF,旱地测土配方施肥化肥+有机肥区,N、P2O5、K2O投入量分别为240、72、140 kg·hm-2,肥料品种同DCF,此外再施用商品精致有机肥(有机质含量45%,N 1.8%+P2O51.6%+K2O 2.2%)22 500 kg·hm-2。各处理除施肥不同外,其他土壤与作物管理措施均保持一致。
各处理小区面积33.3 m2,水田小区间用水泥板隔开,防止肥、水互相渗透。水泥板高60 cm、厚5 cm,埋深30 cm,露出田面30 cm。每小区各有一进水口和一出水口,进水口位置高于出水口,安装阀门。旱地小区以排水沟和水泥板相隔,水泥板厚度5 cm,埋深40 cm,高出畦面20 cm。水田种植一年一季晚稻甬优9号,旱地常年种植春夏两季玉米,品种均为渝糯7号。
1.2 土壤样品采集
土壤样品采集于2015年3月底。每小区按S形取样法5点取样,取0~20 cm层土壤,均匀混合。土样带回室内拣去石砾和植物残体等,过2 mm土筛,分成3份:一份风干后,用于测定土壤理化性状和土壤酶活性;第二份立即保存于4 ℃冰箱中,用于土壤微生物量碳、氮的测定;第三份土样保存于-70 ℃冰箱,用于土壤磷脂脂肪酸(PLFA)的测定。
1.3 样品分析方法
土壤化学性质测定参照文献[15]:土壤有机质采用重铬酸钾氧化法;土壤全氮采用半微量开氏法;全碳采用重铬酸钾容量法;土壤有效磷采用碳酸氢钠(Olsen)法;土壤速效钾采用乙酸铵提取火焰分光光度法;土壤pH采用1∶2.5土水质量体积比浸提,用pH计测定。
土壤可培养细菌、真菌和放线菌种群数量的测定分别采用牛肉膏蛋白胨、孟加拉红和改良高氏一号培养基平板稀释法[16],平板计数;PLFA的提取与纯化参考Eli等[17]和吴愉萍[18]的方法进行,不同磷脂脂肪酸的种类和含量表示不同微生物的种类和生物量,以12∶0、14∶0、15∶0、16∶0、17∶0、18∶0、20∶0、i15∶0、i17∶0、a15∶0、a17∶0、cy17∶0、cy19∶0表示细菌生物量[14-16],以18∶2ω6、18∶3ω6、18∶1ω9表示真菌生物量[19-22],以16∶0 10Me、17∶0 10Me、18∶0 10Me表示放线菌生物量[23];土壤MBC、MBN采用氯仿熏蒸浸提方法测定(转换系数分别取0.38和0.54)[24];使用流动注射分析仪测定铵态氮和硝态氮含量;DOC、DON含量采用KCl溶液浸提,然后使用Multi N/C 3100测定DOC、溶解性总氮(TDN)含量,TDN减去铵态氮和硝态氮的剩余部分即为DON含量;土壤纤维素酶、脲酶、脱氢酶和过氧化氢酶分别采用3,5-二硝基水杨酸法、靛酚蓝比色法、TTC还原法和高锰酸钾滴定法测定[25]。
1.4 统计分析
数据经Excel 2007整理后,利用SPSS 21.0 for Windows进行统计分析,用ANOVA进行方差分析、LSD法进行差异显著性检验(P<0.05)。
2 结果与分析
2.1 对土壤化学性状的影响
从表1可以看出,与长期不施肥(PCK)相比,水田施肥可显著(P<0.05)提高土壤有效磷和速效钾的含量,同时能显著(P<0.05)降低土壤pH值,但在试验期间对土壤有机质、全碳和全氮含量无显著影响。水田中,与常规施肥(PCF)相比,PSTF处理的土壤化学性状无显著差异,而PSTF+OF处理的土壤全碳和有效磷含量显著(P<0.05)增加。与水田相比,在相同母质的旱地上,DSTF+OF处理的旱地土壤有机质、全碳、全氮、有效磷和速效钾含量比水田相应处理(PSTF+OF)下分别增加31.18%、16.32%、83.64%、9.76%和2.23%,pH值下降15.15%。
2.2 对土壤可培养微生物的影响
由图1可知,整体上各处理的可培养微生物数量差异不大,仅DSTF+OF处理的真菌含量显著(P<0.05)高于其他处理。
2.3 对土壤微生物量的影响
由图2可知,不同施肥处理对土壤细菌和真菌群落结构有显著(P<0.05)影响,但对放线菌无显著影响。水田中,与长期不施肥(PCK)相比,PSTF+OF处理显著(P<0.05)提高了土壤细菌的磷脂脂肪酸含量,但对真菌无显著影响。与水田上的DSTF+OF处理相比,旱地上相应的DSTF+OF处理下细菌和真菌的磷脂脂肪酸含量均显著(P<0.05)增加。
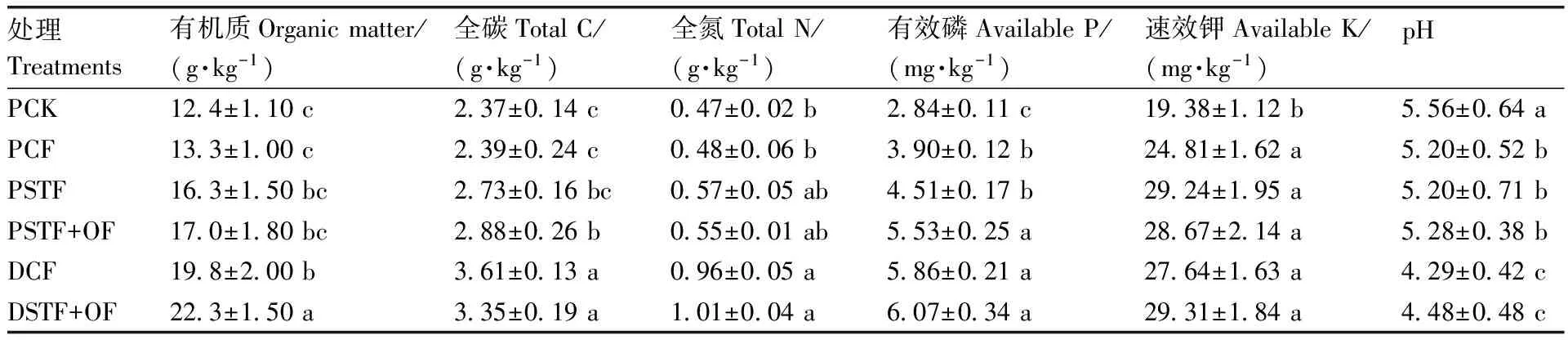
表1 长期施肥各处理对土壤化学性状的影响Table 1 Effects of long-term fertilization systems on soil chemical properties
同列数据后无相同小写字母的表示差异显著(P<0.05)。下同。
Data followed by no same letters within the same column indicated significant difference atP<0.05. The same as below.
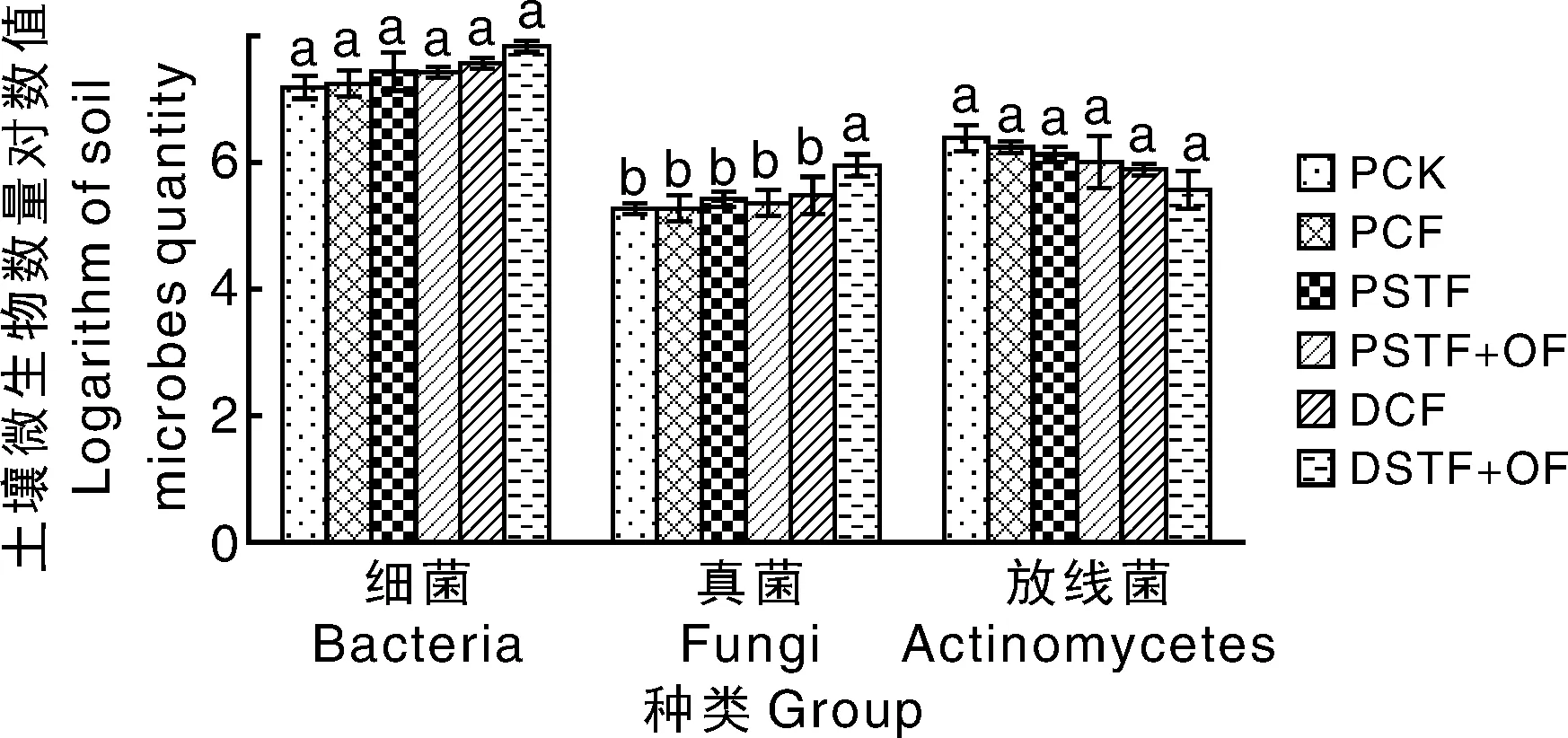
同一类微生物上各处理间无相同小写字母的表示差异显著(P<0.05)。下同。Treatments marked by no same letters indicated significant difference at P<0.05 within the same microbe group. The same as below.图1 长期施肥各处理对土壤可培养微生物数量的影响Fig.1 Effects of long-term fertilization systems on culturable microorganisms

图2 长期施肥各处理对土壤微生物PLFA含量的影响Fig.2 Effects of long-term fertilization systems on PLFAs
2.4 对土壤活性碳氮的影响
从表2可以看出,水田中,相较PCF,PCK处理的土壤活性碳氮、铵态氮和硝态氮含量差异不显著,但PSTF处理显著(P<0.05)提高了土壤微生物量碳的含量,PSTF+OF处理能同时显著(P<0.05)增加土壤微生物碳、氮的含量。旱地中,与旱地常规施肥处理(DCF)相比,DSTF+OF处理能显著(P<0.05)提高土壤微生物量碳、微生物量氮和硝态氮的含量,但可溶性有机碳、可溶性有机氮和铵态氮含量均无显著差异。
2.5 对土壤酶活性的影响
由表3可知,各处理对纤维素酶活性均无显著影响。水田中各处理间脲酶活性无显著差异,与之相比,旱地处理(DCF与DSTF+OF)的脲酶活性显著(P<0.05)提高。与不施肥处理(PCK)相比,水田中PCF处理的脱氢酶活性无显著变化,但其他处理的脱氢酶活性均显著(P<0.05)升高。与不施肥或不施有机肥的处理相比,无论是在水田还是旱地中施入有机肥的处理(PSTF+OF和DSTF+OF)的过氧化氢酶活性均显著(P<0.05)升高。
2.6 各因素的相关性分析
相关分析显示(表4),微生物群落间,细菌和真菌含量呈极显著(P<0.01)正相关,而放线菌与细菌含量呈显著(P<0.05)负相关;土壤活性碳、氮因素间,微生物量氮与可溶性有机碳、可溶性有机氮、硝态氮存在显著(P<0.05)或极显著(P<0.01)相关性,硝态氮与可溶性有机碳、可溶性有机氮分别呈显著(P<0.05)或极显著(P<0.01)正相关,铵态氮与可溶性有机碳呈极显著(P<0.01)负相关;各土壤酶活性间无显著相关性。此外,硝态氮与微生物群落结构存在显著(P<0.05)或极显著(P<0.05)相关性,微生物量碳与土壤脱氢酶和过氧化氢酶呈显著(P<0.05)正相关。

表2 长期施肥各处理对土壤活性碳氮含量的影响Table 2 Effects of long-term fertilization systems on labile organic carbon and nitrogen mg·kg-1
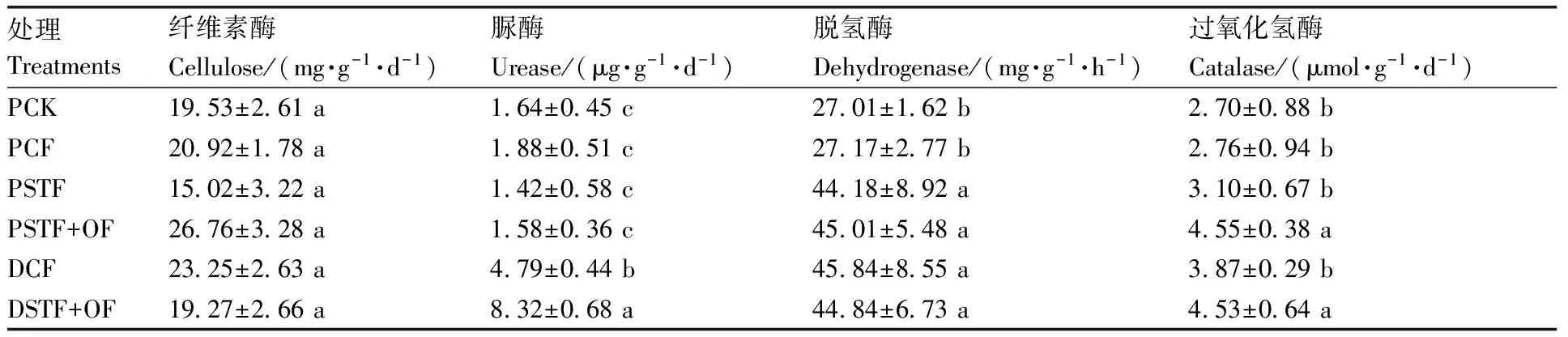
表3 长期施肥各处理对土壤酶活性的影响Table 3 Effects of long-term fertilization systems on enzyme activities
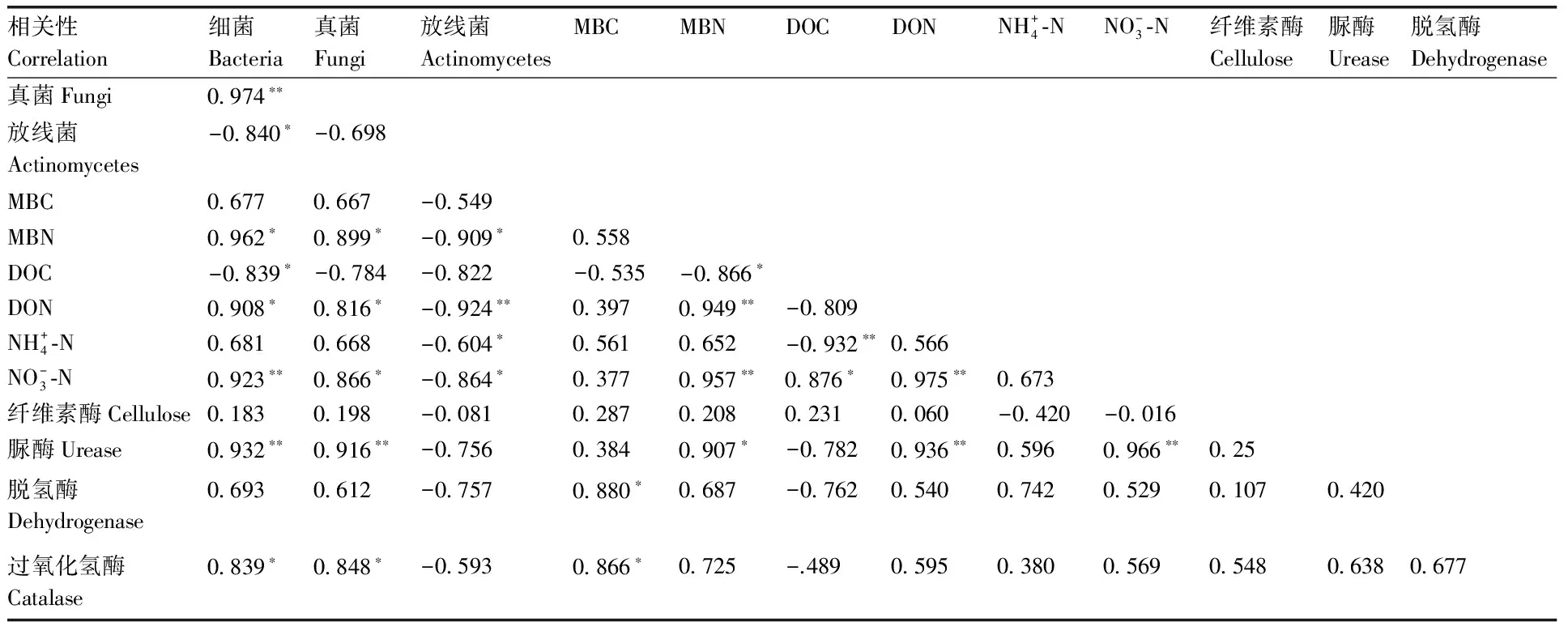
表4 土壤微生物菌落结构、活性碳氮和土壤酶活性的相关分析Table 4 Correlation coefficients within microbial community structure,labile organic carbon and nitrogen and enzyme activities
*,P<0.05; **,P<0.01.
3 讨论
3.1 长期施肥对土壤化学性状的影响
长期施用有机肥或有机肥与N、P、K配合施用可提高土壤有机质和氮磷钾养分含量,改善土壤物理性状,调节土壤C/N,促进作物和土壤微生物的生长[23]。土壤有机碳含量变化主要受到施肥的影响,同时也受到环境因素,尤其是土壤水分、气候变化、大气沉降等的影响[13],本研究中仅考虑了N、P、K和有机肥对土壤化学性状的影响。在水田中,与PSTF处理相比,PSTF+OF处理的土壤有效磷含量显著增加,这可能是因为有机肥的施用更有利于土壤理化特性的改善和养分的持续供应,促进土壤大团聚体内微团聚体的形成,而仅施用化肥氮磷钾对土壤大团聚体内微团聚体形成的促进作用缓慢,且易致土壤板结。与水田相比,在相同母质的旱地上,施肥处理提高土壤养分的效应更明显,可能与旱地化肥用量比水田高有关。
3.2 长期施肥对土壤微生物群落结构的影响
土壤微生物易受土壤营养状况、pH值、质地、温度、水分和通气性等条件的影响,因此,土壤的利用方式和管理措施会使土壤微生物发生变化[26]。由于土壤生态系统的复杂性,关于施肥究竟如何影响土壤微生物的变化问题尚缺乏共识[27]。本研究中,不同施肥条件下,水田与旱地两种利用方式土壤可培养微生物数量差异不大,仅DSTF+OF处理的真菌含量显著高于其他处理,这可能与培养方法有关。前人研究表明,运用传统的选择性培养基方法鉴定的微生物仅占环境总微生物的0.1%~10%,这不能完全反映土壤中微生物真实的分布情况[28]。Bardgett等[29]认为,土壤中磷脂脂肪酸的组成可以表示土壤微生物群落的生物量和结构,一些研究发现,直接从土壤中提取的磷脂脂肪酸含量可以准确地反映出土壤微生物的生物量[29-32]。本研究测定了不同施肥处理下的土壤微生物PLFA含量,结果显示,在水田中PCK、PCF与PSTF之间细菌PLFA含量的差异不显著,只有PSTF+OF细菌PLFA含量显著高于PCK;而旱地的DSTF+OF处理下细菌PLFA含量显著高于水田各处理。陈晓娟等[33]研究发现,细菌和真菌PLFA水稻田高于旱地,而本研究结果恰好相反,而放线菌PLFA两者无显著差异。以上结果的不一致可能一方面是因为旱地的施肥量比水田高,另一方面也与取样时间有关,本试验在初春取样,经过较长时间的冬期后,两类土壤的温度、水分和通气性均趋于相近。Schloter等[34]研究显示,精准施肥与传统施肥相比,对表层土壤的细菌和真菌群落结构并无明显影响,本研究亦得到类似的结果,即水田测土配方施肥(PSTF)和常规施肥处理间细菌、真菌、放线菌含量均无显著差异。
3.3 长期施肥对土壤活性碳氮的影响
土壤微生物量碳能反映土壤有效养分状况和生物活性[35],微生物量氮是土壤氮素的一个重要储备库,了解土壤微生物量氮的消长有助于揭示进入土壤肥料氮素的生物固定和释放的本质[36-37]。对于农田土壤,不同施肥管理对土壤微生物生物量有明显的影响,与不施肥处理土壤相比,施肥可显著提高土壤的微生物量碳氮的含量,其中化肥与有机肥长期配施的效果最为明显[3]。本研究结果也证明,与不施肥处理土壤相比,PSTF+OF处理能同时增加微生物量碳和微生物量氮的含量。
3.4 多年不同施肥处理对土壤酶活性的影响
土壤酶主要来自于土壤微生物代谢过程,此外也源于土壤动物和植物的分解。土壤中一切生化反应都是在土壤酶的参与下完成的,土壤酶活性的高低能反映土壤生物活性和土壤生化反应强度[38]。纤维素酶是可以表征土壤碳素循环速度的重要指标,本研究发现,各种施肥处理对纤维素酶活性无显著影响,这意味着不同施肥处理对土壤碳素循环速度的影响不显著。脲酶能分解有机物,促其水解成氨和二氧化碳。本研究结果显示,与水田相比,旱地中施肥处理使脲酶活性显著提高,而在水田中各处理对脲酶活性的影响均不显著。脱氢酶常被认为是土壤微生物活性的一个有效指标,其活性可以表征土壤腐殖质化强度和有机质积累的程度[39]。本研究结果显示,PSTF+OF处理能显著提高脱氢酶和过氧化氢酶活性。由此可见,长期施肥对土壤酶活性有很大的影响,其原因可能是长期施肥改变了土壤微生物量、区系组成,以及代谢过程,从而影响土壤酶的数量和活性[3]。
致谢:承蒙浙江大学农业与生物技术学院张国平教授审阅并提出宝贵意见,在此深表谢意!
参考文献(References):
[1] WANG M C,LIU Y H,WANG Q,et al. Impacts of methamidophos on the biochemical,catabolic,and genetic characteristics of soil microbial communities[J].SoilBiologyandBiochemistry,2008,40(3): 778-788.
[2] MANICKAM N,PATHAK A,SAINI H S,et al. Metabolic profiles and phylogenetic diversity of microbial communities from chlorinated pesticides contaminated sites of different geographical habitats of India[J].JournalofAppliedMicrobiology,2010,109(4):1458-1468.
[3] 刘恩科,赵秉强,李秀英,等. 长期施肥对土壤微生物量及土壤酶活性的影响[J]. 植物生态学报,2008,32(1): 176-182.
LIU E K,ZHAO B Q,LI X Y,et al. Biological properties and enzymatic activity of arable soils affected by long term different fertilization systems[J].JournalofPlantEcology,2008,32(1): 176-182. (in Chinese with English abstract)
[4] 葛萍,王伟波,朱晓林,等. 鹞落坪4种典型植被类型土壤活性碳、氮特征比较[J]. 中国农学通报,2014,30(4): 23-28.
GE P,WANG W B,ZHU X L, et al. The characteristics comparison of soil active organic carbon and nitrogen of 4 kinds of vegetation types in Yaoluoping[J].ChineseAgriculturalScienceBulletin,2014,30(4): 23-28. (in Chinese with English abstract)
[5] ISLAM M R,CHAUHAN P S,KIM Y,et al. Community level functional diversity and enzyme activities in paddy soils under different long-term fertilizer management practices[J].Biology&FertilityofSoils,2011,47(5):599-604.
[6] BELAY A,CLAASSENS A,WEHNER F. Effect of direct nitrogen and potassium and residual phosphorus fertilizers on soil chemical properties,microbial components and maize yield under long-term crop rotation[J].Biology&FertilityofSoils,2002,35(6):420-427.
[8] KAUTZ T,WIRTH S,ELLMER F. Microbial activity in a sandy arable soil is governed by the fertilization regime[J].EuropeanJournalofSoilBiology,2004,40(2):87-94.
[9] MASTO R E,CHHONKAR P K,SINGH D,et al. Changes in soil biological and biochemical characteristics in a long-term field trial on a sub-tropical inceptisol[J].SoilBiology&Biochemistry,2006,38(7):1577-1582.
[10] 王继红,刘景双,于君宝,等. 氮磷肥对黑土玉米农田生态系统土壤微生物量碳、氮的影响[J]. 水土保持学报,2004,18(1): 35-38.
WANG J H,LIU J S,YU J B,et al. Effect of fertilizing N and P on soil microbial biomass carbon and nitrogen of black soil corn agroecosystem[J].JournalofSoilandWaterConservation,2004,18(1): 35-38. (in Chinese with English Abstract)
[11] 贾伟,周怀平,解文艳,等. 长期有机无机肥配施对褐土微生物生物量碳、氮及酶活性的影响[J]. 植物营养与肥料学报,2008,14(4): 700-705.
JIA W,ZHOU H P,XIE W Y,et al. Effects of long-term inorganic fertilizer combined with organic manure on microbial biomass C,N and enzyme activity in cinnamon soil[J].PlantNutritionandFertilizerScience,2008,14(4): 700-705. (in Chinese with English abstract)
[12] 路磊,李忠佩,车玉萍. 不同施肥处理对黄泥土微生物生物量碳氮和酶活性的影响[J]. 土壤,2006,38(3): 309-314.
LU L,LI Z P,CHE Y P. Effects of different fertilization treatments on soil microbial biomass and enzyme activities in Hapli-stagnic anthrosols[J].Soils,2006,38(3): 309-314. (in Chinese with English abstract)
[13] 王俊华,尹睿,张华勇,等. 长期定位施肥对农田土壤酶活性及其相关因素的影响[J],生态环境,2007,16(1): 191-196.
WANG J H,YI R,ZHANG H Y,et al. Changes in soil enzyme activities,microbial biomass,and soil nutrition status in response to fertilization regimes in a long-term field experiment[J].EcologyandEnvironment,2007,16(1): 191-196. (in Chinese with English abstract)
[14] 卜洪震,王丽宏,尤金成,等. 长期施肥管理对红壤稻田土壤微生物量碳和微生物多样性的影响[J].中国农业科学,2010,43(16): 3340-3347.
BU H Z,WANG L H,YOU J C,et al. Impact of long-term fertilization on the microbial biomass carbon and soil microbial communities in paddy red soil[J].ScientiaAgriculturaSinica,2010,43(16): 3340-3347. (in Chinese with English abstract)
[15] 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社,2000.
[16] 娜日苏,红雨,杨殿林,等. 黄河流域棉区转Bt基因棉种植对根际土壤微生物数量及细菌多样性的影响[J]. 应用生态学报,2011,22 (1): 114-120.
NA R S,HONG Y,YANG D L,et al. Effect of plantation of transgenic Bt cotton on the amount of rhizospheric soil microorganism and bacterial diversity in the cotton region of Yellow River basin[J].ChineseJournalofAppliedEcology,2011,22(1): 114-120. (in Chinese with English abstract)
[17] ELI Z,ERICA B D,YONI S,et al. Inferring biological soil crust successional stage using combined PLFA,DGGE,physical and biophysiological analyses[J].SoilBiology&Biochemistry,2010,42(5): 842-849.
[18] 吴愉萍. 基于磷脂脂肪酸(PLFA)分析技术的土壤微生物群落结构多样性的研究[D]. 杭州: 浙江大学,2009.
WU Y P. Studies on soil microbial community structure based on phospholipid fatty acid (PLFA) analysis[D]. Hangzhou: Zhejiang University,2009. (in Chinese with English abstract)
[19] FROSTEGARD A,BAATH E,TUNLIO A. Shifts in the structure of soil microbial communities in limed forests as revealed by phospholipid fatty acid analysis[J].SoilBiologyandBiochemistry,1993,25(6): 723-730.
[20] TUNLID A,HOITINK H A J,LOW C,et al. Characterization of bacteria that suppress rhizoctonia damping-off in bark compost media by analysis of fatty acid biomarkers[J].AppliedandEnvironmentalMicrobiology,1991,55(6): 1368-1374.
[21] 张妤,郭爱玲,崔烨,等. 培养条件下二氯喹啉酸对土壤微生物群落结构的影响[J]. 生态学报,2015,35(3): 849-857.
ZHANG Y,GUO A L,CUI Y,et al. Effect of quinclorac on soil microbial community structure under culture conditions[J].ActaEcologicaSinica,2015,35(3): 849-857. (in Chinese with English abstract)
[23] 李明,李忠佩,刘明,等. 不同秸秆生物碳对红壤性水稻土养分及微生物群落结构的影响[J]. 中国农业科学,2015,48(7): 1361-1369.
LI M,LI Z P,LIU M,et al. Effects of different straw biochar on nutrient and microbial community structure of a red paddy soil[J].ScientiaAgriculturaSinica,2015,48(7): 1361-1369. (in Chinese with English abstract)
[24] JOERGENSEN R G,MICROBIAL B,NANNIPIERI P. Methods in applied soil microbiology and biochemistry[M]. New York: Academic Press,1995: 375-417.
[25] 关松荫. 土壤酶及其研究法[M]. 北京: 农业出版社,1986: 274-328.
[26] 黄进勇,李春霞. 土壤微生物多样性的主要影响因子及其效应[J]. 河南科技大学学报(农学版),2004,24(4): 10-13.
HUANG J Y,LI C X. Main factors of soil microbial diversity and their effect on cropland[J].JournalofHenanUniversityofScienceandTechnology(AgriculturalScience),2004,24(4): 10-13. (in Chinese with English abstract)
[27] DENEF K,ROOBROECK D,WADU M C W M,et al. Microbial community composition and rhizodeposit carbon assimilation in differently managed temperate grassland soils[J].SoilBiologyBiochemistry,2009,41(1): 144-153.
[28] 喻曼,肖华,张棋,等. PLFA法和DGGE法分析堆肥细菌群落变化[J]. 农业环境科学学报,2011,30(6):1242-1247.
YU M,XIAO H,ZHANG Q,et al. Changes of bacterial communities in composting by PLFA and DGGE methods[J].JournalofAgro-EnvironmentScience,2011,30(6): 1242-1247. (in Chinese with English abstract)
[29] BARDGETT R D,HOBBS P J,FROSTEGARD A. Changes in soil fungal: bacterial biomass ratios following reductions in the intensity of management of an upland grassland[J].BiologyandFertilityofSoils,1996,22(3): 261-264.
[30] WU Y P,YU X S,WANG H Z. Does history matter? Temperature effects on soil microbial biomass and community structure based on the phospholipid fatty acid (PLFA) analysis[J].JournalofSoilsandSediments,2010,10(2):223-230.
[31] RINKLEBE J,LANGER U. Relationship between soil microbial biomass determined by SIR and PLFA analysis in floodplain soils[J].JournalofSoilsandSediments,2010,10(1):4-8.
[32] MURASE J,HORDIJK K,TAYASU I,et al. Strain-specific incorporation of methanotrophic biomass into eukaryotic grazers in a rice field soil revealed by PLFA-SIP[J].FEMSMicrobiologyEcology,2011,75(2):284-290.
[33] 陈晓娟,吴小红,刘守龙,等. 不同耕地利用方式下土壤微生物活性及群落结构特性分析: 基于PLFA和MicroRespTM方法[J]. 环境科学,2013,34(6): 2375-2382.
CHEN X J,WU X H,LIU S L,et al. Microbial activity and community structure analysis under the different land use patterns in farmland soils: based on the methods PLFA and MicroRespTM[J].EnvironmentalScience,2013,34(6):2375-2382. (in Chinese with English abstract)
[34] SCHLOTER M,BACH H J,METZ S. Influence of precision farming on the microbial community structure and functions in nitrogen turnover[J].AgricultureEcosystems&Environment,2003,98(1): 295-304.
[35] NSABIMANA D,HAYNES R J,WALLIS F M. Size activity and catabolic diversity of the soil microbial biomass as affected by land use[J].AppliedSoilEcology,2004,26(2): 81-92.
[36] JUMA N G,PAUL E A. Mineralizable soil nitrogen: amounts and extractability ratios[J].SoilScienceSocietyofAmericaJournal,1984,48(1):76-80.
[37] JENKINSON D S,PARRY L C. The nitrogen cycle in the broadbalk wheat experiment: a model for the turnover of nitrogen through the soil microbial biomass[J].SoilBiology&Biochemistry,1989,21(4): 535-541.
[38] VON MERSI W,SCHINNER F. An improved and accurate method for determining the dehydrogenase activity of soils with iodonitrotetrazolium chloride[J].BiologyandFertilityofSoils,1991,11(3): 216-220.
[39] VISSER S,PARKINSON D. Soil biological criteria as indicators of soil quality: soil microorganisms[J].AmericanJournalofAlternativeAgriculture,1992,7(1): 33-37.
