灰茶尺蛾和小茶尺蠖两近缘种的生物学特性差异
2018-05-21白家赫唐美君殷坤山王志博
白家赫,唐美君,殷坤山,王志博,肖 强,*
(1.中国农业科学院 茶叶研究所,浙江 杭州 310008; 2.中国农业科学院 研究生院,北京 100081)
灰茶尺蛾(EctropisgrisescensWarren,1894)和小茶尺蠖(EctropisobliquaProut,1915)外部形态极其相似,为近缘种,均隶属于鳞翅目(Lepidoptera)尺蛾科(Geometridae)灰尺蛾亚科(Ennominae)埃尺蛾属(Ectropis)[1-2],是茶园中主要的食叶性害虫,为害严重时可将茶树叶片全部食尽,严重影响茶叶的产量和质量,给茶叶生产造成较大的经济损失[1,3-4]。
由于两近缘种的外部形态相近、难以区分,一直以来生产中将两者统称为茶尺蠖。近年来,研究人员从不同地理种群茶尺蠖对茶尺蠖核型多角体病毒(EoNPV)敏感性的差异着手[5],采用形态学、遗传学及分子生物学的方法,明确了我国茶园常见的茶尺蠖可分为灰茶尺蛾和小茶尺蠖两近缘种[1,4]。在此基础上,葛超美等[2]对灰茶尺蛾的生物学特性作了详细描述;Ma等[6]研究明确了灰茶尺蛾的性信息素组分,但有关两近缘种在生物学特性、性信息素组分、病毒种类及田间防治等方面的差异尚未研究明确,现有的多数有关茶尺蠖的研究结果是源于两近缘种尚未明确前获得的,与实际情况可能存在差异[7-9]。尽管葛超美等[2]对灰茶尺蛾的生物学特性作了详细描述,但两近缘种茶尺蠖生物学特性的比较未见研究报道。
本文采用室内饲养观察的方法,比较了茶尺蠖两近缘种的体长、体质量、发育历期及种群增长指数等生物学特性,以明确茶尺蠖两近缘种间的差异,为进一步开展茶尺蠖两近缘种的种群动态变化规律和指导制定综合防控策略等后续研究提供基础。
1 材料与方法
1.1 供试虫源及饲养条件
灰茶尺蛾幼虫和小茶尺蠖幼虫分别于2015年秋季采自浙江省绍兴市新昌县(120.99°E,29.50°N)和浙江省杭州市余杭区(119.90°E,30.39°N)的茶园中,并在养虫室内人工扩繁了3~4代后作为试验用种群。
饲养条件:温度为(25±1)℃;光周期为13 h/11 h(L/D);相对湿度为75%~80%。幼虫期,饲喂新鲜的茶树嫩梢或成叶,每日添加或更换1次,直至化蛹。蛹羽化为成虫后,成对置于500 mL玻璃罐头瓶内,放入白色产卵纸条,用软纸套上橡皮筋封口,任其交配产卵。卵孵化后在玻璃瓶中饲养。
1.2 试验方法
1.2.1 体长和体质量测定
试验用两种群茶尺蠖幼虫分别饲养至成虫后,人工配对产卵,并测量卵的长径。幼虫孵化后,分别将50头灰茶尺蛾和小茶尺蠖初孵幼虫接在一次性塑料培养皿(直径×高=90 mm×15 mm)中单头饲养,每日添加或更换新鲜茶树嫩叶,逐日观察幼虫的发育情况并测定初孵幼虫及1~5龄幼虫末的体长和体质量。幼虫化蛹后,分辨蛹的性别,测量雌雄蛹的体长和体质量。羽化为成虫后,测量成虫体长和体质量。
1.2.2 发育历期观测
茶尺蠖两近缘种幼虫分别饲养至成虫后,进行人工配对,记录配对日期及产卵日期。幼虫孵化后,记录孵化日期。分别选取灰茶尺蛾和小茶尺蠖初孵幼虫50头、单头饲养于一次性塑料培养皿中,每天添加或更换新鲜茶树嫩叶并定时观察每头幼虫的蜕皮时间及发育情况,直至化蛹,分辨蛹的性别并记录化蛹日期。待成虫羽化,记录成虫的羽化日期和死亡日期。统计卵、幼虫、蛹和成虫的历期。
1.2.3 种群生命表制作
把当天孵化的茶尺蠖两近缘种试验种群幼虫(n=100)分别置于500 mL玻璃罐头瓶(直径×高=8.0 cm×11.5 cm)中饲养至成虫,20头·瓶-1,共5瓶,每日添加或更换新鲜茶叶。记录每瓶初始虫数,同时观察死虫数,至幼虫化蛹时,统计幼虫总数及幼虫存活率;同样,记录预蛹和蛹的死亡数并统计预蛹和蛹的存活率。成虫羽化后,统计性比,并将当天羽化的成虫单对配对,产卵后统计单雌产卵量。幼虫孵化后,统计卵孵化率。最后,根据张孝羲[10]的方法计算种群增长指数,绘制种群生命表。
1.3 数据处理
实验数据均使用统计分析软件SPSS 19.0进行处理,并用独立样本t-检验进行两近缘种生物学特性的差异显著性检验。
2 结果与分析
2.1 茶尺蠖两近缘种体长与体质量的差异
测定比较茶尺蠖两近缘种的体长与体质量,结果表明,灰茶尺蛾和小茶尺蠖在3龄后至成虫期各发育阶段的体长、体质量存在差异(表1)。灰茶尺蛾4龄幼虫体长、雌雄蛹长及雌成虫体长(图1)分别为26.87、11.44、14.18和12.63 mm,与小茶尺蠖的25.36、10.46、12.69和10.68 mm存在极显著差异(P<0.01),其他各发育阶段二者体长与体质量的差异不显著。进一步称量比较了灰茶尺蛾和小茶尺蠖的幼虫、蛹及成虫(图1)的体质量,发现灰茶尺蛾和小茶尺蠖3-5龄幼虫的体质量分别在23.33~80.36 mg和14.56~65.92 mg,两者存在极显著差异(P<0.01),而1—2龄幼虫体质量无明显差异;灰茶尺蛾的雄蛹平均蛹质量为94.75 mg、雌蛹为176.07 mg,而小茶尺蠖雄蛹平均蛹质量仅有69.21 mg、雌蛹为127.70 mg,两者差异极显著(P<0.01);成虫的体质量也以灰茶尺蛾为重,极显著高于小茶尺蠖。
2.2 茶尺蠖两近缘种发育历期的差异
观察比较灰茶尺蛾与小茶尺蠖各虫态的发育历期,结果显示,小茶尺蠖的全世代发育历期比灰茶尺蛾长,两者呈极显著差异(P<0.01)。灰茶尺蛾经36.64 d可完成一代,小茶尺蠖则需39.73 d,其中,整个幼虫期的发育历期以小茶尺蠖较长,蛹的发育历期以灰茶尺蛾较长,两者均存在极显著差异(P<0.01),而产卵前期、卵期、预蛹及成虫的发育历期无明显差异(图2-a)。两近缘种相同龄期幼虫之间,1龄和3龄幼虫的发育历期呈极显著差异(P<0.01),4龄幼虫发育历期呈显著差异(P<0.05),均以小茶尺蠖较长,2龄和5龄幼虫的发育历期无明显差异(图2-b)。

表1 灰茶尺蛾和小茶尺蠖各发育阶段的体长和体质量Table 1 Body length and body weight of each developmental stage of E. grisescens and E. obliqua
表中数值为平均值±标准误,同一行中**表示差异极显著(P<0.01)。
The values in the table are averages ± standard error,and ** in the same row denotes significant difference atP<0.01.

图1 灰茶尺蛾与小茶尺蠖高龄幼虫、蛹及成虫形态特征Fig.1 Morphological characteristics of the old larvae,pupae and moths of E. grisescens and E. obliqua
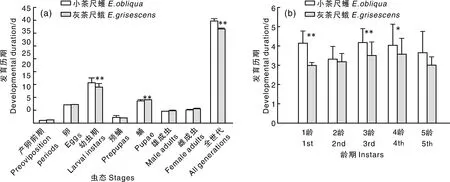
a,不同虫态的发育历期;b,幼虫不同龄期的发育历期。柱状图上*表示差异显著(P<0.05);**表示差异极显著(P<0.01)。a,Developmental duration of each stage; b,Developmental duration of each larval instar. * on the bar denotes a significant difference at P<0.05; ** denotes an extremely significant difference at P<0.01.图2 灰茶尺蛾和小茶尺蠖各虫态和各龄期幼虫的发育历期Fig.2 The developmental duration of each developmental stage and each instar larva of E. grisescens and E. obliqua
2.3 茶尺蠖两近缘种种群生命表的比较
观察比较茶尺蠖两近缘种各虫态的存活率与繁殖力,绘制出种群生命表,可以看出灰茶尺蛾的世代存活率、各虫态的存活率、单雌平均产卵量及种群增长指数均高于小茶尺蠖(表2)。灰茶尺蛾的世代存活率和种群增长指数分别为0.600和58.14,与小茶尺蠖的0.28和24.89间存在极显著差异(P<0.01);灰茶尺蛾1-3龄幼虫存活率与小茶尺蠖的差异显著(P<0.05),而卵、4-5龄幼虫、蛹的存活率及单雌平均产卵量等无明显差异。
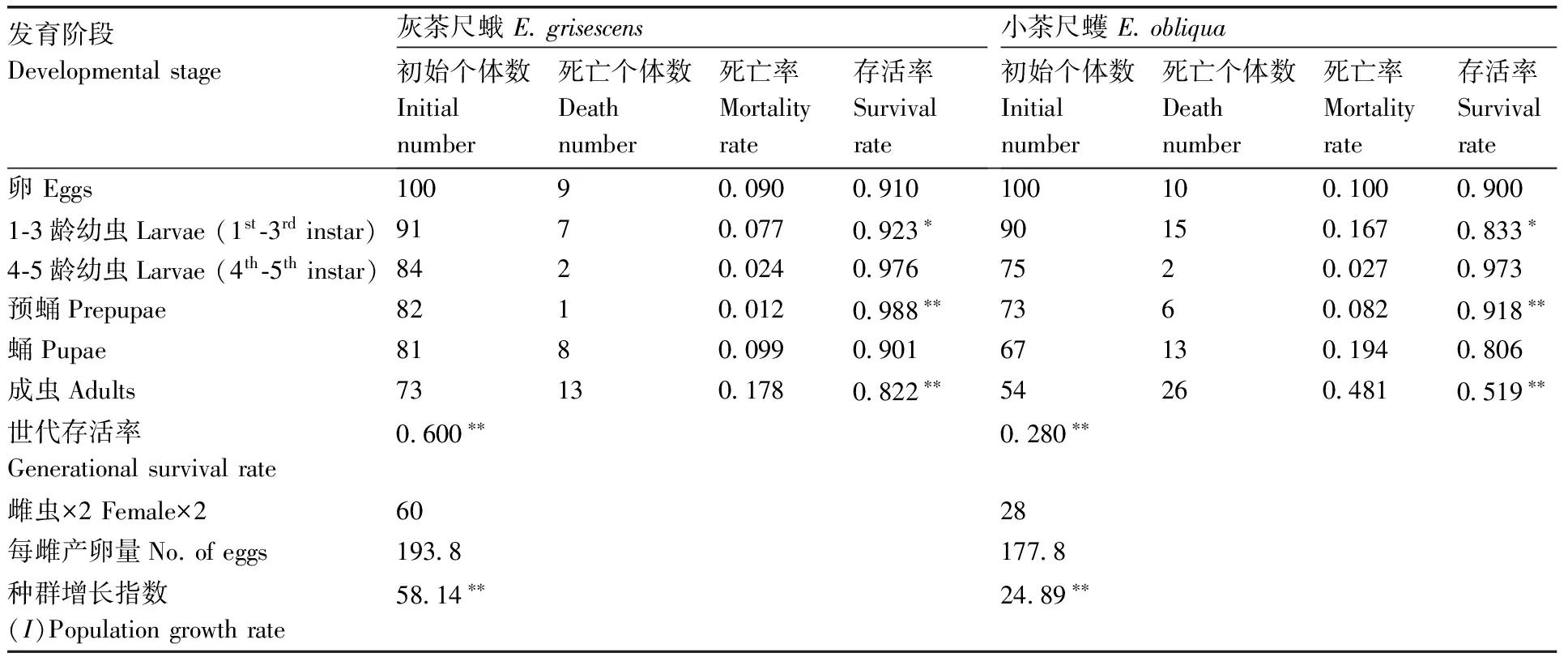
表2 灰茶尺蛾和小茶尺蠖的种群生命表Table 2 Population life tables of E. grisescens and E. obliqua
表中数值为平均值±标准误,同一行中*表示两近缘种相同发育阶段的存活率差异显著(P<0.05),**表示两近缘种相同发育阶段的存活率差异极显著(P<0.01)。
The value in the table is the average ± standard error and * indicates a significant difference atP<0.05,** indicates extremely significant difference atP<0.01.
3 讨论
昆虫近缘种常具有十分相近的外部形态[11],难以区分,给识别和防治带来很大困难。近年来,昆虫近缘种成为国内外的研究热点。棉铃虫Helicoverpaarmigera(Hubner)和烟青虫HelicoverpaassultaGuenee在形态学、生物学及生态学上非常相近[12-13]。王念慈等[14]与Wang等[15]分别对棉铃虫和烟青虫进行生物学比较及种间杂交,证实了棉铃虫与烟青虫是属于亲缘关系很近的近缘种,但两昆虫在寄主偏好性方面存在很大差异[16-17]。Dinsdale等[18]和De Barro等[19]分别对烟粉虱的种系发生和世界各地烟粉虱不同种群的杂交试验数据进行研究归纳,推论烟粉虱是一个物种复合体。该复合体包含多个形态上难以区分的隐种,其中B隐种和Q隐种是最重要的2个入侵种,而2个隐种对不同寄主的适应能力[20]及抗药性[21]等方面存在差异。同样,作为两近缘种的灰茶尺蛾和小茶尺蠖,两者外部形态极其相似,但与其他昆虫近缘种有所不同的是,灰茶尺蛾与小茶尺蠖食性更为相近、寄主单一、均以取食茶树叶片为主,难以通过食性的差异发现存在近缘种,因此导致生产上长期作为一个种来认识。
发育历期是判断多数昆虫近缘种存在差异的一个指标,也是了解昆虫的行为节律和田间种群动态的先决条件。研究发现,棉铃虫完成一代所需时间较烟青虫短[14],Q隐种烟粉虱无论在杂草上还是甜椒上的历期均比B隐种的要短[22]。本研究结果显示,灰茶尺蛾的全世代发育历期为36.64 d,小茶尺蠖则为39.73 d,即灰茶尺蛾完成一代所需时间短于小茶尺蠖。两近缘种的全世代历期存在差异是否会导致它们的年发生代数、发生时间及对茶园的危害程度存在差异需作进一步的研究。
本研究结果还显示,灰茶尺蛾各虫态的存活率及世代存活率均比小茶尺蠖高,同时灰茶尺蛾成虫的体型较大、具有较长的寿命、较长的产卵前期及较高的种群增长指数。体型大的雌性个体通常具有较强的活动能力和繁殖力,以及较长的寿命[23];体型较大的雄性个体其竞争优势主要体现在获得交配的能力[24]以及授精数量方面[25]。Zhang等[26]研究认为,灰茶尺蛾雄虫对小茶尺蠖的雌虫具有强烈的干扰现象,两者存在非对称交配行为,这是否与灰茶尺蛾的成虫体型大、寿命长、交配竞争力和种群扩繁能力较强有关,有待作进一步的验证。根据现有的研究分析推测,灰茶尺蛾广泛分布于我国各茶区,而小茶尺蠖仅分布于浙、苏、皖三省交界区域[4]。灰茶尺蛾分布范围广,而小茶尺蠖的分布范围窄,两近缘种的地理分布存在差异的内在原因和未来发展的趋势,同样也是值得进一步研究的内容。
茶尺蠖两近缘种的确定源于它们对病毒敏感性的差异,进一步的研究发现,灰茶尺蛾和小茶尺蠖在生物学特性、生殖竞争[26]、体内共生菌[27]和区域分布[4]等方面存在差异。一方面这些差异的内在机制尚不清楚,需作进一步研究;另一方面这些差异也为研究近缘种间是否存在基因交流、物种的形成及性信息素的生物合成提供了参考。植物次生物质在植食性昆虫寄主植物演变过程中起重要作用。已有的研究发现,寄主范围不同的棉铃虫和烟青虫存在着不同的生化适应策略[28],而寄主单一的茶尺蠖两近缘种对茶树的适应性机制是否相同则有待进一步研究。因此,深入研究茶尺蠖两近缘种间的关系,对于揭示昆虫近缘种的进化与演化乃至物种的形成均具有十分重要的价值。
参考文献(References):
[1] 姜楠, 刘淑仙, 薛大勇,等. 我国华东地区两种茶尺蛾的形态和分子鉴定[J]. 应用昆虫学报, 2014(4):987-1002.
JIANG N, LIU S X, XUE D Y, et al. External morphology and molecular identification of two tea Geometrid moth from southern China[J].ChineseJournalofAppliedEntomology, 2014(4):987-1002.(in Chinese with English abstract)
[2] 葛超美, 殷坤山, 唐美君,等. 灰茶尺蠖的生物学特性[J]. 浙江农业学报, 2016, 28(3):464-468.
GE C M, YIN K S, TANG M J, et al. Biological characteristics ofEctropisgrisescensWarren[J].ActaAgriculturaeZhejiangensis, 2016, 28(3):464-468.(in Chinese with English abstract)
[3] SUN L, MAO T F, ZHANG Y X, et al. Characterization of candidate odorant-binding proteins and chemosensory proteins in the tea geometridEctropisobliquaProut (Lepidoptera: Geometridae)[J].ArchivesofInsectBiochemistry&Physiology, 2017, 94: e21383.
[4] ZHANG G H, YUAN Z J, ZHANG C X, et al. Detecting deep divergence in seventeen populations of tea geometrid (EctropisobliquaProut) in China by COI mtDNA and cross-breeding[J].PlosOne, 1994, 9(6):e99373.
[5] 席羽, 殷坤山, 肖强. 不同地理种群茶尺蠖对EoNPV的敏感性差异研究[J]. 茶叶科学, 2011, 31(2):100-104.
XI Y, YIN K S, XIAO Q. The susceptibility difference againstEoNPV in different geographic populations of tea geometrid (EctropisobliquaProut)[J].JournalofTeaScience, 2011, 31(2):100-104.(in Chinese with English abstract)
[6] MA T, XIAO Q, YU Y G, et al. Analysis of tea geometrid (Ectropisgrisescens) pheromone gland extracts using GC-EAD and GC×GC/TOFMS[J].JournalofAgricultural&FoodChemistry, 2016, 64(16):3161-3166.
[7] 夏英三, 万连步. 茶尺蠖生物学特性初步研究[J]. 安徽农业科学, 2014,42(29):10175-10176.
XIA Y S, WAN L B. Preliminary study on the biological characteristics ofEctropisobliquaProut[J].JournalofAnhuiAgriculturalSciences, 2014,42(29):10175-10176.(in Chinese with English abstract)
[8] YANG Y, ZHANG L, FENG G, et al. Reidentification of sex pheromones of tea geometridEctropisobliquaProut (Lepidoptera: Geometridae)[J].JournalofEconomicEntomology, 2015, 109:167-175.
[9] 毛迎新, 刘明炎, 王友平,等. 灰茶尺蠖核型多角体病毒对灰茶尺蠖的致病性研究[J]. 华东昆虫学报, 2007, 16(3):216-219.
MAO Y X, LIU M Y, WANG Y P, et al. The pathogenicity of Ectropis grisecens nucleopolyhedrovirus on the larvae ofEctropisgrisecens[J].EntomologicalJournalofEastChina, 2007, 16(3):216-219.(in Chinese with English abstract)
[10] 张孝羲. 昆虫生态及预测预报[M]. 北京: 中国农业出版社,2002:77-83.
[11] 高爱明. 昆虫近缘种鉴别特征概述[J]. 昆虫知识, 1993(4):245-247.
GAO A M. Summarization of identification characteristics of insect sibling species[J].EntomologicalKnowledge, 1993(4):245-247.(in Chinese)
[12] 张亚南, 樊建庭, 杨林,等. 35℃下烟青虫夏滞育率、蛹重及代谢速率的变化[J]. 应用昆虫学报, 2014, 51(5):1274-1279.
ZHANG Y N, FAN J T, YANG L, et al. The summer diapause rate, pupal weight, and metabolic rate ofHelicoverpaassultaat 35℃[J].ChineseJournalofAppliedEntomology, 2014, 51(5):1274-1279.(in Chinese with English abstract)
[13] WANG C Z, DONG J F. Interspecific hybridization ofHelicoverpaarmigera, andH.assulta, (Lepidoptera: Noctuidae)[J].ChineseScienceBulletin, 2001, 46(6):489-491.
[14] 王念慈, 李照会. 棉铃虫与烟青虫生物学研究[J]. 山东农业大学学报, 1984(1/2):13-24.
WANG N C, LI Z H. Studies on the biology of cotton bollworm (HeliothisarmigeraHubner) and tobacco budworm (HeliothisassultaQuenee)[J].JournalofShandongAgriculturalUniversity, 1984(1/2):13-24.(in Chinese with English abstract)
[15] WANG C Z. Interpretation of the biological species concept from interspecific hybridization of two Helicoverpa, species[J].ChineseScienceBulletin, 2007, 52(2):284-286.
[16] WANG C Z, DOND J F, TANG D L, et al. Host selection ofHelicoverpaarmigeraandH.assultaand its inheritance[J].ProgressinNaturalScience, 2004, 14(10):880-884.
[17] TANG Q B, JIANG J W, YAN Y H, et al. Genetic analysis of larval host-plant preference in two sibling species of Helicoverpa[J].EntomologiaExperimentalisEtApplicata, 2010, 118(3):221-228.
[18] DINSDALE A, COOK L, RIGIONS C, et al. Refined global analysis ofBemisiatabaci(Hemiptera: Sternorrhyncha: Aleyrodoidea: Aleyrodidae) mitochondrial cytochrome oxidase 1 to identify species level genetic boundaries[J].AnnalsoftheEntomologicalSocietyofAmerica, 2010, 103(2):196-208.
[19] DE BARRO P J, LIU S S, BOYKIN L M, et al.Bemisiatabaci: A statement of species status[J].AnnualReviewofEntomology, 2011, 56:1-19.
[20] 卢少华, 李静静, 刘明杨,等. 烟粉虱B型和Q型竞争能力的室内比较分析[J]. 中国农业科学, 2015, 48(7):1339-1347.
LU S H, LI J J, LIU M Y, et al. Comparative analysis of the competitiveness between B and Q biotypes ofBemisiatabaciunder laboratory conditions[J].ScientiaAgriculturaSinica, 2015, 48(7):1339-1347.(in Chinese with English abstract)
[21] LUO C, JONES C M, DEVINE G, et al. Insecticide resistance inBemisiatabacibiotype Q (Hemiptera: Aleyrodidae) from China[J].CropProtection, 2010, 29(5):429-434.
[22] 褚栋, 毕玉平, 张友军,等. 烟粉虱生物型研究进展[J]. 生态学报, 2005, 25(12):3398-3405.
CHU D, BI Y P, ZHANG Y J, et al. Research progress onBemisiatabaci(Gennadius) biotypes[J].ActaEcologicaSinica, 2005, 25(12):3398-3405.(in Chinese with English abstract)
[23] PAVLIK J. The size of the female and quality assessment of mass-rearedTrichogrammaspp[J].EntomologiaExperimentalisEtApplicata, 1993, 66(2):171-177.
[24] MORRIS R J, FELLOWES M D E. Learning and natal host influence host preference, handling time and sex allocation behaviour in a pupal parasitoid[J].BehavioralEcology&Sociobiology, 2002, 51(4):386-393.
[25] KING B H. Sex-ratio manipulation in response to host size by the parasitoid waspSpalangiacameroni: A laboratory study[J].Evolution, 1988, 42(6):1190-1198.
[26] ZHANG G H, YUAN Z J, YIN K S, et al. Asymmetrical reproductive interference between two sibling species of tea looper:EctropisgrisescensandEctropisobliqua[J].BulletinofEntomologicalResearch, 2016:1-8.
[27] 周孝贵, 付建玉, 刘守安,等. 茶尺蠖和灰茶尺蠖内共生菌Wolbachia的分子检测及序列分析[J]. 应用昆虫学报, 2016, 53(4):782-792.
ZHOU X G, FU J Y, LIU S A, et al. Molecular detection and sequence analysis ofWolbachiastrains inEctropisobliquaandEctropisgrisescens(Lepidoptera: Geometridae)[J].ChineseJournalofAppliedEntomology, 2016, 53(4):782-792.(in Chinese with English abstract)
[28] 董钧锋, 张继红, 王琛柱. 植物次生物质对烟青虫和棉铃虫食物利用及中肠解毒酶活性的影响[J]. 昆虫学报, 2002, 45(3):296-300.
DONG J F, ZHANG J H, WANG C Z. Effects of plant allelochemicals on nutritional utilization and detoxication enzyme activities in twoHelicoverpaspecies[J].ActaEntomologicaSinica, 2002, 45(3):296-300.(in Chinese with English abstract)
