泥鳅致病性维氏气单胞菌的分离与鉴定
2018-05-21袁雪梅姚嘉赟蔺凌云潘晓艺尹文林沈锦玉
袁雪梅,姚嘉赟,蔺凌云,潘晓艺,徐 洋,尹文林,沈锦玉
(农业部淡水渔业健康养殖重点实验室,浙江省鱼类健康与营养重点实验室,浙江省淡水水产研究所,浙江 湖州 313001)
泥鳅(Misgurnusanguillicaudatus)属鲤形目,鳅科,是一种杂食性鱼类,生长快,分布广,其味道鲜美,肉质细嫩,营养丰富,被誉为“水中人参”,同时还具有药用价值,是我国主要淡水经济鱼类之一,在国内和国际市场上的需求都很大。为了满足日益增长的市场需求,泥鳅的人工养殖在全国各地悄然兴起,其中江苏省养殖规模最大[1]。然而随着泥鳅养殖业的发展,病害问题日渐突出。在这些病害中,以由温和气单胞菌(Aeromonassobria)[2]、创伤弧菌(vibriovulnificus)[3]、泥鳅气单胞菌(Aeromonasmisgurnus)[4]、凡隆气单胞菌(Aeromonasveronii)[5]等感染引起的细菌性疾病最为严重,给养殖生产带来巨大的经济损失。
2015年7月,在浙江省新昌县一养殖池塘出现了泥鳅批量死亡事件,其症状主要表现为下颌、腹部等部位发红或可见溃疡病灶,剖检可见腹腔内含腹水,呈红色,肠内无食物,肝、脾肿胀或有不同程度的出血。为查明病原,本研究以典型症状的病鱼作为材料,对其进行病原菌分离鉴定和药敏试验,以期为该病的临床防治和诊断提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验鱼
患病泥鳅采集自浙江省绍兴市新昌县一个泥鳅养殖场;健康泥鳅购自浙江省湖州市水产品市场,平均体长(10 ± 0.6)cm。
1.1.2 主要试剂
大豆酪蛋白琼脂培养基(TSA)和药物敏感试纸购自杭州天和微生物试剂有限公司;细菌16S rDNA基因扩增通用引物合成和基因测序由南京金斯瑞生物科技有限公司完成;PCR扩增试剂为Promega公司的AmpliTaq Gold®360 Master Mix,DNA Marker为天根生化科技(北京)有限公司产品。
1.2 实验方法
1.2.1 病鱼检查
随机取得10尾患病泥鳅。肉眼观察病鱼外表、鳃丝以及内脏器官等的宏观病理变化,然后取病鱼的鳃丝、肝脏和肾脏等器官组织,显微镜检查,排除寄生虫和霉菌感染的可能性。
1.2.2 病原菌的分离培养
在无菌条件下解剖病鱼,接种环取肝、脾、肾及病灶等不同组织于TSB平板划线接种培养,28 ℃恒温培养24 h,从形态一致的优势菌落中选取单个菌落,再次进行平板划线,直至获得纯培养。
1.2.3 人工感染试验
将纯化菌株接种到TSB培养基中,28 ℃恒温培养24 h,用无菌生理盐水稀释至9×108、9×107、9×106、9×105cfu·mL-1菌液备用。将暂养1周的健康泥鳅随机分组,每组10尾,采用腹腔注射法进行人工感染试验。注射0.1 mL菌悬液,每个实验组设1个重复,同时设立对照组直接注射无菌生理盐水,控制水温为(20 ± 1)℃,饲养观察14 d,每天记录发病症状和死亡情况,并对死亡鱼进行细菌分离鉴定。
1.2.4 病原菌的鉴定
形态特征:将病原菌接种于TSA平板,28 ℃恒温培养48 h,观察菌落的形态;挑取单菌落进行革兰氏染色,油镜下观察菌体颜色与形态。
生理生化鉴定:将纯化后的病原菌利用梅里埃公司的VITEK-2全自动鉴定仪进行测试与分析。
16S rRNA与gyrB基因序列测定及系统发育树的构建:① 细菌DNA的制备:挑取28 ℃培养24 h的细菌的单一菌落于50 μL无菌去离子水中,100 ℃水浴10 min后,4 ℃ 10 800g离心5 min,上清即为PCR扩增的模板DNA。② 16S rRNA基因序列的PCR扩增与测序:以提取的基因组为模板进行16S rRNA基因PCR扩增,2个引物分别为27F (5’-AGAGTTTGATC(C/A)TGGCTCAG-3’)和1492R(5’-GGTTACCTTGTTACGACTT-3’)[6],扩增序列预期长度为1 500 bp。扩增条件为:94 ℃预变性3 min;94 ℃ 30 s,54 ℃ 30 s,72 ℃ 90 s,35个循环;最后72 ℃延伸10 min。扩增产物交由南京金斯瑞生物科技有限公司测序。③gyrB基因序列的PCR扩增与测序:以提取的基因组为模板进行gyrB基因PCR扩增的2个引物分别为gyrB3F(5’-TCCGGCGGTCTGCACGGCGT-3’)和gyrB14R(5’-TTGTCCGGGTTGTACTCGTC-3’)[7],序列预期长度为1 100 bp。扩增条件为:94 ℃预变性3 min;94 ℃ 30 s,54 ℃ 30 s,72 ℃ 70 s,35个循环;最后72 ℃延伸10 min。扩增产物交由南京金斯瑞生物科技有限公司测序。④ 16S rRNA和gyrB基因序列系统发育树构建:对分离菌的16S rRNA基因和gyrB基因序列通过NCBI的Blast检索系统(http://www.ncbi.nlm.nih.gov/Blast/)进行序列同源性分析,使用ClustalX软件与从GenBank数据库中获得的序列相似性较高的菌株的序列进行多序列匹配排列(multiple alignments),通过MEGA 4.0(molecular evolutionary genetics analysis,MEGA)构建系统发育树。
菌种分类位置确定:根据细菌形态、培养及理化特性测定的结果,主要依据参考伯杰氏鉴定细菌学手册等[8-9],并结合细菌16S rRNA和gyrB基因系统发育学分析的结果,进行分离菌的种属分类位置判定。
药物敏感性测定:经鉴定后的菌株,用常规琼脂扩散(K-B)法对49种抗菌类药物的敏感性进行测定,以是否出现抑菌圈及抑菌圈直径大小作为敏感与耐药的判定指标[10]。
2 结果与分析
2.1 自然发病情况
患病泥鳅口、鳃盖、下颌、躯干部、腹部的皮肤、胸鳍及腹鳍发红,随着病情的发展,体表出现红斑,部分病鳅出现全身皮下组织出血,严重者出现溃疡,剖检可见腹腔内有大量红色的腹水,肠内无食物,肝、脾肿胀或有不同程度的出血。该病的死亡率可高达60%。
2.2 优势菌的分离
从病鱼的病灶中分离获得1株优势菌株,暂命名为NQ150728。
2.3 人工感染试验
人工感染试验结果见表1,由表可知对照组泥鳅在14 d观察期内均正常。9×108cfu·mL-1试验组鱼于48 h内全部死亡;9×107cfu·mL-1试验组鱼于72 h内全部死亡;9×106cfu·mL-1试验组鱼于5 d内全部死亡;9×105cfu·mL-1试验组鱼在14 d观察期内有6 尾鱼未死亡。感染死亡鱼出现明显的头部、体表、鳍及鳍基出血,注射部位肿胀出血的现象。取感染死亡鱼进行细菌学检验,结果均分离到大量纯一的与供试菌株(NQ150728)在形态及菌落特征上相似的菌落。试验证明,分离菌为本次引起泥鳅大量死亡的病原菌,且对泥鳅具强致病性。
2.4 分离菌株的鉴定
2.4.1 形态学鉴定
菌株NQ150728在TSA培养基上的菌落中心略凸起,灰白色不透明,圆形光滑,边缘整齐;经革兰氏染色镜检,该菌为革兰阴性菌,菌体短杆状、两端钝圆、无芽孢。
2.4.2 生理生化鉴定
生理生化鉴定结果见表 2,初步确定病原菌NQ150728为维氏气单胞菌Aeromonasveronii。
2.4.3 病原菌16S rRNA与gyrB序列比较及系统进化分析
利用细菌16S rRNA通用引物对NQ150728进行PCR扩增,测序得到1 403 bp的序列,将此序列在美国国家生物技术信息中心上进行Blast同源性分析,GenBank中维氏气单胞菌相似性均达100%。在GenBank中检索获得气单胞菌属中标准菌株的16S rRNA序列,运用MEGA6.0软件的邻接法构建系统发育树(图1)。由图1可见,菌株NQ150728与维氏气单胞菌标准菌株ATCC 35624(系统自带)等聚为一支。
利用引物gyrB3F,gyrB14R对管家基因gyrB进行扩增,可得到1 036 bp的特异性条带,在GenBank中检索获得气单胞菌属中部分标准菌株的gyrB序列,运用软件构建系统发育树(图2),菌株NQ150728与维氏气单胞菌聚为一个分支。16S rRNA与gyrB序列分析结果基本可确定NQ150728为维氏气单胞菌。

表1 人工感染试验结果Table 1 Results of artificial infection test
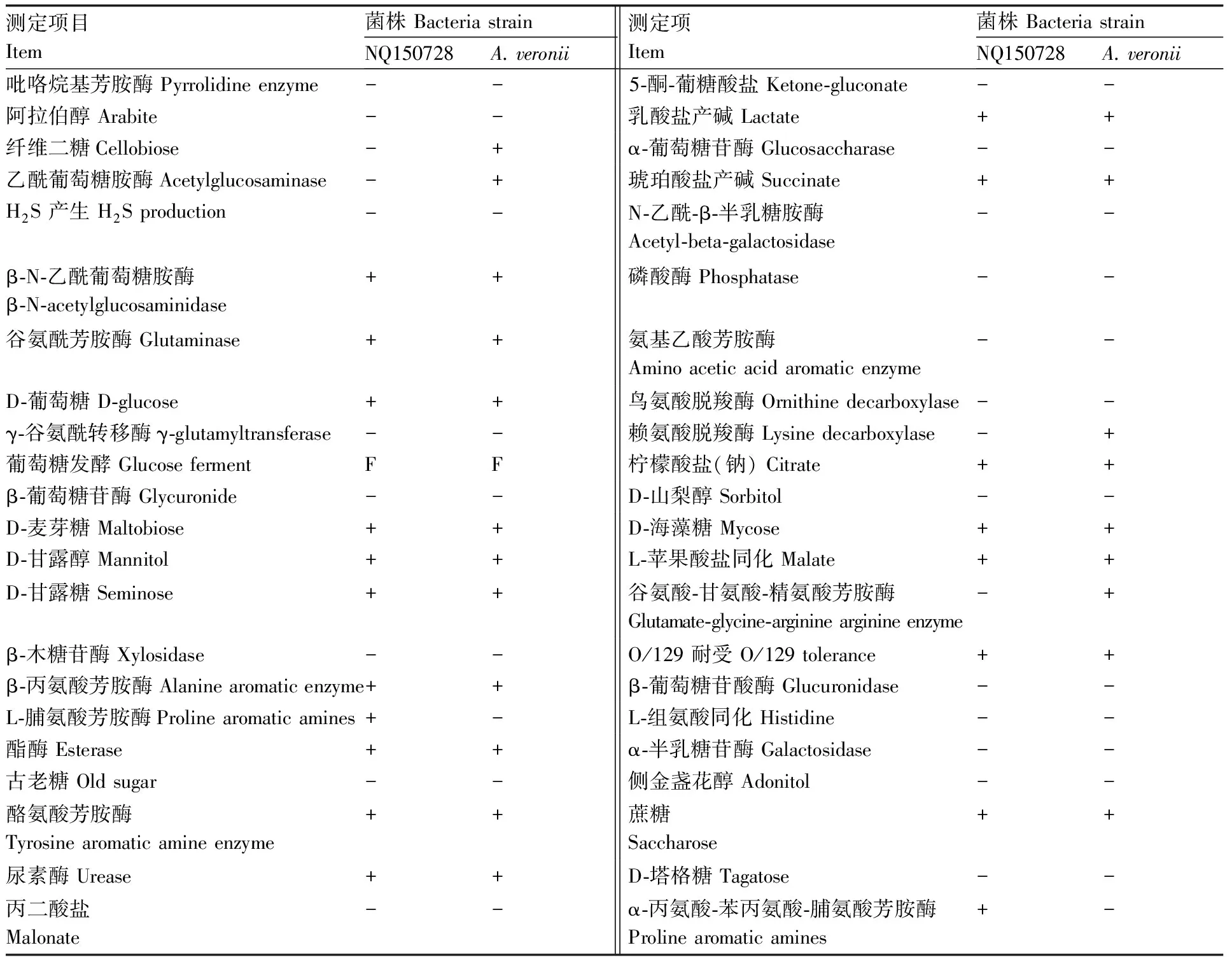
表2 NQ150728菌株的生化鉴定结果Table 2 The biochemical reaction results of strain NQ150728
+,阳性;-,阴性;F,发酵型。
+,Positive; -,Negative; F,Fermentation.
2.5 药物敏感性试验
菌株NQ150728对49种抗菌类药物的药敏结果见表3。结果表明,该菌对头孢曲松、利福平、恩诺沙星、四环素、氯霉素、头孢哌酮、氧氟沙星、洛美沙星、克拉霉素、头孢噻吩、多西环素、新霉素、头孢他啶、大观霉素、环丙沙星、呋喃妥因、头孢拉定、氟罗沙星、甲氧嘧啶、米诺环素、头孢氨苄、氨曲南、左氟沙星、甲氧胺嘧啶等24种药物高度敏感,对链霉素、卡那霉素、红霉素、妥布霉素等10种药物中度敏感,对青霉素G、多粘菌素B、氨苄西林、克林霉素等15种药物耐药。与已报道的其他水产动物维氏气单胞菌的药敏试验[11-14]进行了对比,不同生物来源的维氏气单胞菌对药物的敏感性不尽相同,但是不同来源的菌株均对环丙沙星、诺氟沙星和氧氟沙星敏感,对青霉素G和氨苄西林耐药(表4)。
3 讨论
维氏气单胞菌分布广泛、致病性较强,是一种常见的人-畜-鱼共患致病菌[11],对水产养殖业的发展和人类的健康构成了严重的威胁。该菌可感染并引起水产动物的大量死亡;人食用了污染的水产品、蔬菜和畜禽肉类时,可引发腹泻、脑膜炎和败血症等,免疫力低下的患者甚至可能死于该菌的感染[15]。在国内,该菌可感染大鲵、华鲮、黄颡鱼、框镜鲤等水产动物,给养殖者带来很大的经济损失[11]。目前,有关泥鳅维氏气单胞菌感染的报道已有2例,分别发生在连云港的东海[5]和墩尚镇[16],报道中泥鳅症状以出血溃疡为主,且死亡率高达60%,与本研究中情况相似。

图1 NQ150728菌株16S rRNA基因序列发育进化树Fig.1 16S rRNA gene sequence of strain NQ150728
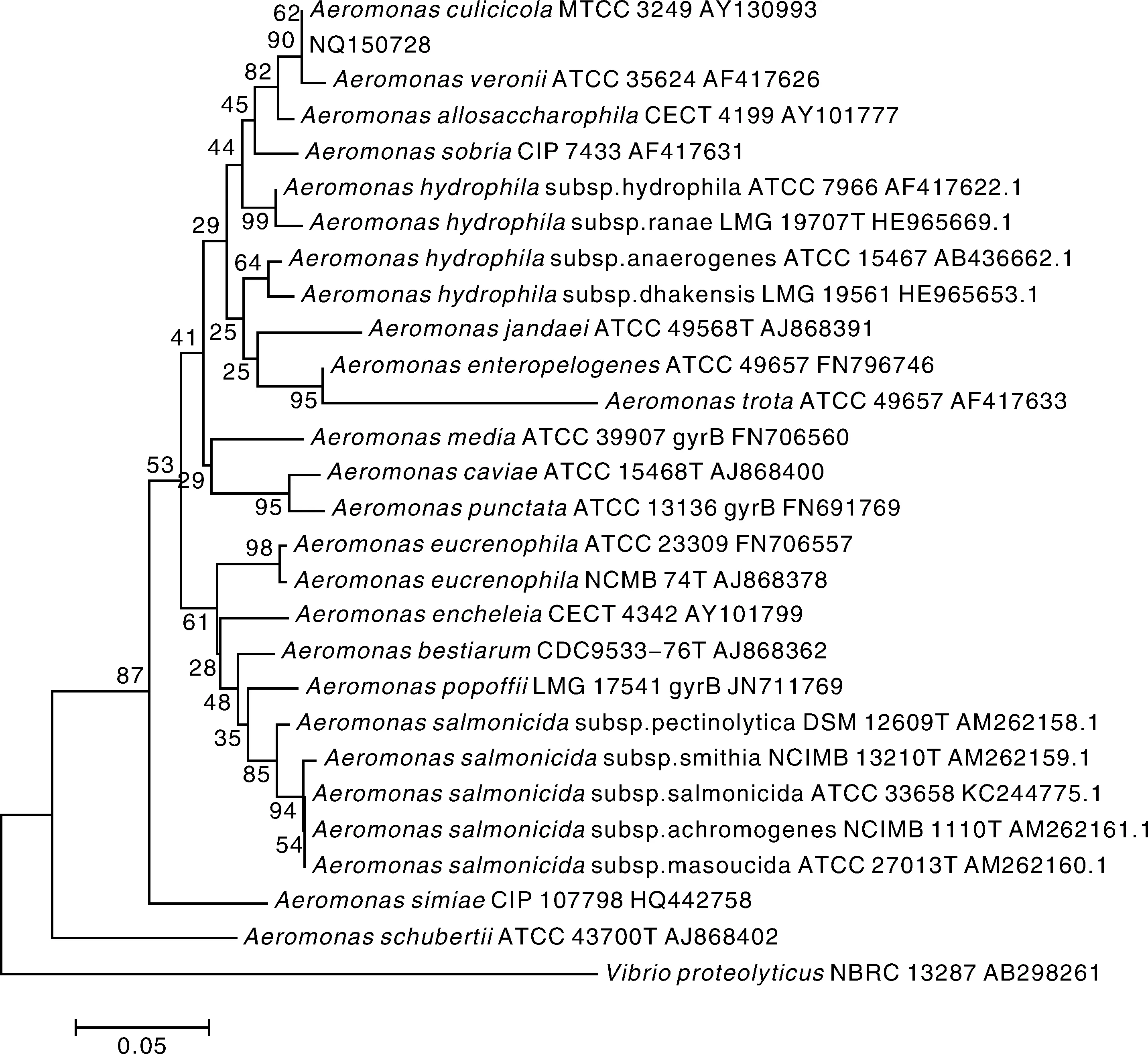
图2 NQ150728菌株gyrB基因序列发育进化树Fig.2 Gene sequence of gyrB of strain NQ150728
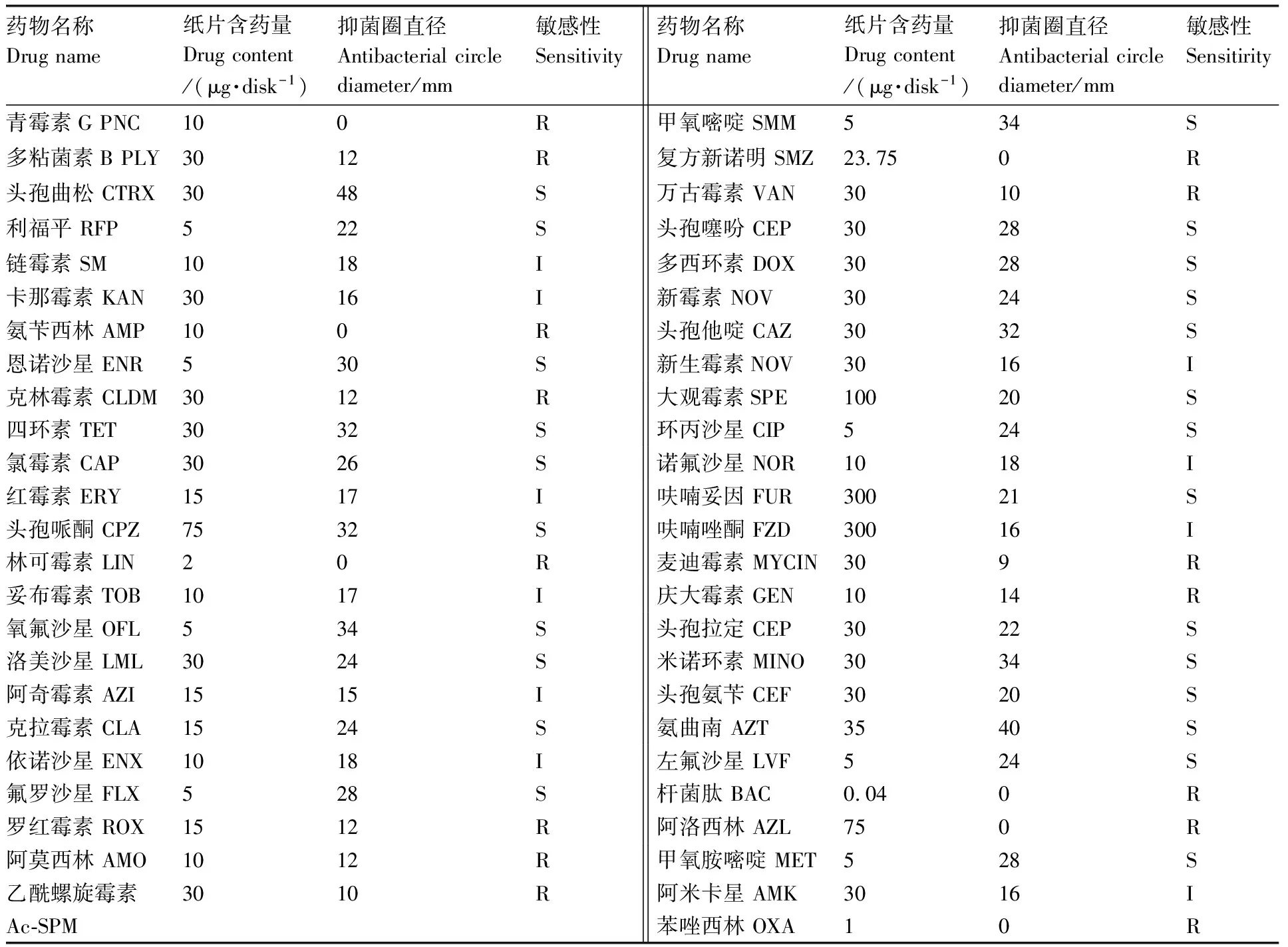
表3 NQ150728菌株的药物敏感性试验结果Table 3 Antibiotic sensitivity test of strain NQ150728
抑菌圈直径包括药敏纸片直径 7 mm。R(耐药),7 mm≤抑菌圈直径≤14 mm;S(敏感),抑菌圈直径≥20 mm;I(中介),15 mm≤抑菌圈直径≤19 mm。
Antibacterial circle diameter includes 7 mm of the drug sensitive disk diameter. R (resistant) represents 7 mm≤antibacterial circle diameter ≤14 mm; S (sensitive) represents antibacterial circle diameter ≥20 mm; I (intermediary) represents 15 mm≤antibacterial circle≤19 mm. PLY,Polymyxin; SM,Streptomycin; AMP,Ampicillin; ENR,Enrofloxacin; TET,Tetracycline; TOB,Tobramycin; SMZ,Sulfamethoxazole; CIP,Ciprofloxacin; NOR,Norfloxacin; FZD,Furazolidone; GEN,Gentamicin; KAN,Kanamycin; OFL,Ofloxacin; DOX,Doxycycline; CAZ,Ceftazidime; PNC,Penicillin; PLY,Polymyxin; CTRX,Ceftriaxone; CLDM,Clindamycin; RFP,Rifampicin; CAP,Chloramphenicol; ERY,Erythromycin; LML,Lomefloxacin; CPZ,Cefoperazone; AZI,Azithromycin; CLA,Clarithromycin; ENX,Enoxacin; LIN,Lincomycin; FLX,Fleroxacin; ROX,Roxithromycin; AMO,Amoxicillin; Ac-SPM,Acetyl spiramycin; SMM,Sulfamethoxydiazine; OXA,Oxacillin; AMK,Amikacin; MET,methoxypyrimidine; VAN,Vancomycin; CEP,Cephalothin; AZL,Azlocillin; BAC,Bacitracin; LVF,Levofloxacin; AZT,Aztreonam; CEF,Cephalexin; MINO,Minocycline; CEP,Cephradine; MYCIN,Midecamycin; SPE,Spectinomycin; FUR,furadantin; NOV,Novobiocin.
药物敏感试验结果可为维氏气单胞菌感染防治提供一些科学依据,本次以49种常用抗菌类药物对分离鉴定的维氏气单胞菌进行了药物敏感性测定,结果表明,分离菌对头孢曲松、利福平、恩诺沙星、四环素等24种药物高度敏感;对青霉素G、对黏菌素B、氨苄西林、克林霉素等15种药物耐药;对链霉素、卡那霉素、红霉素、妥布霉素素等10种药物中度敏感。而综合已有对维氏气单胞菌的药物敏感性方面的研究[11-14],显示该菌不同菌株存在较大的耐药差异性,需在选择用药治疗相应疾病时加以注意,考虑到维氏气单胞菌的耐药差异性及细菌对抗菌类药物耐药变异频繁的特征,应针对不同生物来源的菌株进行针对性的药物筛选试验,选择最有效的药物进行治疗或预防,可防止细菌抗药性的产生。本次实验选用抗生素的种类较多,有一些为禁用药物,如红霉素、氯霉素、环丙沙星等,目的为研究NQ150728菌株的药物敏感性,其中可用药物可供临床参考。目前在养殖过程中误用、滥用抗生素和消毒剂等,加剧了水体中微生态的失衡,导致耐药性菌株的出现。但是合理选择和使用有效的抗生素仍是目前和近期内控制疾病的主要方法,不能一概否定。
S为敏感;I为中度敏感;R为耐药;“—”表示本实验使用的抗生素他人未使用。
S represents sensitive; I represents intermediary; R represents resistant; “—” represents the antibiotics used in this study but were not used in the references.
微生物自动鉴定和基因型同源性分析方法具有简捷、高效、特异等优点,已广泛应用于现代细菌诊断领域[17-19]。VITEK-2全自动微生物鉴定仪是梅里埃公司的产品,是目前世界上影响力较大的细菌鉴定和药敏系统之一[20],其数据库中微量的生化反应包括了传统的生理生化测定分析,简化了传统实验摸索过程,避免人工操作造成的误差,已被多个国家的官方检疫机构认可[19]。本实验应用VITEK-2全自动微生物鉴定仪对泥鳅病原菌进行生化鉴定,耗时6.25 h,检测效率得以显著提高,且鉴定结果评价为极好的鉴定,证实鉴定结果准确。同时构建的细菌16S rRNA 及gyrB基因序列系统发育树显示,该菌与维氏气单胞菌自然聚合为一支,可信度100%。对菌株NQ150725的分子生物学的鉴定也进一步证实了VITEK-2全自动微生物鉴定仪的准确性,适于在渔业生产中推广应用。
参考文献(References):
[1] 农业部渔业局.2015中国渔业统计年鉴[M].北京:中国农业出版社,2015.
[2] 肖克宇,蒋武成,李年文,等. 泥鳅腐皮病的病原与防治的研究[J]. 湖南农学院学报,1992,18(增刊l):20-25.
XIAO K Y,JIANG W C,LI N W,et al. Stigmatosis of Misgurnus anguillicaudatus and its pathogenic bacteria[J].JournalofHunanAgriculturalcollege,1992,18(Sl):20-25.(in Chinese with English abstract)
[3] 杨鸢劼,陈辉,金日奉,等. 泥鳅溃疡病的病原菌分离和组织病理学观察[J]. 集美大学学报(自然科学版),2004,9(1):22-25.
YANG Y J,CHEN H,JIN R F,et al. Isolation of the pathogens and histopathological study on ulcer disease of loach[J].JournalofJimeiUniversity(NaturalScience),2004,9(1):22-25. (in Chinese with English abstract)
[4] 房海,陈翠珍,张晓君,等. 泥鳅气单胞菌感染的检验与分析[J]. 中国人兽共患病杂志,2006,22(11):1065-1069.
FANG H,CHEN C Z,ZHANG X J,et al. Examination and analysis on an infection due toAeromonasmisgurnus[J].ChineseJournalofZoonoses,2006,22(11):1065-1069. (in Chinese with English abstract)
[5] 秦蕾,徐静,张晓君,等. 泥鳅的凡隆气单胞菌感染[J]. 中国人兽共患病杂志,2008,24 (12):1100-1102.
QIN L,XU J,ZHANG X J,et al. Infection withAeromonasveroniibiovar. inMisgurnusanguillicaudatus[J].ChineseJournalofZoonoses,2008,24 (12):1100-1102. (in Chinese with English abstract)
[6] POLZ M F,CAVANAUGH C M. Bias in template to product ratios in multitemplate PCR[J].Applied&EnvironmentalMicrobiology,1998,64(10):3724-3730.
[8] HOLT J G,KRIEG N R,SNEATH P H A,et al. Bergey’s manual of determinative bacteriology[M]. 9th Ed. London: Williams and Wilkins,Baltimore,1994:190-191,253.
[9] KRIEG N R,HOLT J G. Bergey’s manual of systematic bacteriology[M]. London: Williams and Wilkins,Baltimore,1984:545-548.
[10] 叶应妩,王毓三. 全国临床检验操作规程[M]. 2版. 南京:东南大学出版社,1997:553-562.
[11] 徐洋,蔺凌云,姚嘉赟,等. 黄颡鱼“溃疡综合征”病原的分离鉴定及药敏试验[J]. 淡水渔业,2015,45(5):100-104.
XU Y,LING L Y,YAO J Y,et al. Pathogen isolation,identification and susceptibility test of ulcerative disease syndrome onPelteobagrusfulvidraco[J].FreshwaterFisheries,2015,45(5):100-104. (in Chinese with English abstract)
[12] 房海,陈翠珍,张晓君,等. 中华绒螯蟹病原维氏气单胞菌的检验[J]. 中国人兽共患病学报,2008,24 (1):45-49.
FANG H,CHEN C Z,ZHANG X J,et al. Examination of the pathogenicAeromonasveroniiisolated from crabEriocheirsinensis[J].ChineseJournalofZoonoses,2008,24 (1):45-49. (in Chinese with English abstract)
YANG Z X,ZHOU Y,REN R Y,et al. Isolation,identification and drug susceptibility test ofAeromonasveroniifromLiobagrusmarginatusGiinther[J].ChineseJournalofVeterinaryMedicine,2012,39(2):92-96. (in Chinese with English abstract)
[14] 李聪,蔡岩,周永灿,等. 海南罗非鱼致病性维氏气单胞菌分离鉴定及药敏特性研究[J]. 水产科学,2015,34(10):640-646.
LI C,CAI Y,ZHOU Y C,et al. Isolation,identification and antibiotic sensitivity ofAeromonasveroniifrom Tilapia cultured in Hainan Province[J].FisheriesScience,2015,34(10):640-646. (in Chinese with English abstract)
[15] 吴同垒,单晓枫,孟庆峰,等. 维氏气单胞菌研究进展[J]. 中国兽药杂志,2011,45(7):41-44.
WU T L,SHAN X F,MENG Q F,et al. Advances inAeromonasveronii[J].ChineseJournalofVeterinaryMedicine,2011,45(7):41-44.(in Chinese with English abstract)
[16] ZHU M,WANG X R,LI J,et al. Identification and virulence properties ofAeromonasveroniibv.sobriaisolates causing an ulcerative syndrome of loachMisgurnusanguillicaudatus[J].JournalofFishDiseases, 2016,39(6):777-781.
[17] 高正勇,曾令兵,孟彦,等. 患病大鲵中弗氏柠檬酸杆菌的分离与鉴定[J]. 微生物学报,2012,52(2):169-176.
GAO Z Y,ZENG L B,MENG Y,et al. Isolation and identification ofCitrobacterfreundiifrom diseased giant salamander,Andriasdavidianus[J].ActaMicrobiologicaSinica,2012,52(2):169-176. (in Chinese with English abstract)
[18] 周勇,曾令兵,李瑞伟,等. 患病黄额闭壳龟中产酸克雷伯菌的分离与鉴定[J]. 淡水渔业,2012,42(3):38-43.
ZHOU Y,ZENG L B,LI R W,et al. Isolation and identification ofKlebsiellaoxytocafrom diseasedCuoragalbinifrons[J].FreshwaterFisheries,2012,42(3):38-43. (in Chinese with English abstract)
[19] 安伟,肖雨,高晓华,等. 鳜源致病性荧光假单胞菌的分离与鉴定[J]. 动物学杂志,2014,49(5):760-765.
AN W,XIAO Y,GAO X H,et al. Isolation and identification of pathogenicPseudomonasfluorescensfromSinipercachuatsi[J].ChineseJournalofZoology,2014,49(5):760-765. (in Chinese with English abstract)
[20] 吴会桃,蔡芷荷,吴清平,等. 细菌鉴定系统的应用研究进展[J]. 中国卫生检验杂志,2010,20(9):2381-2384.
WU H T,CAI Z H,WU Q P,et al. Advances in the application of bacterial identification system[J].ChineseJournalofHealthLaboratoryTechnology,2010,20(9):2381-2384. (in Chinese)
