烟蚜虫霉菌的筛选、鉴定及培养条件初筛
2018-05-14莫飞旭喻会平龙友华吴小毛黎晓茜李磊
莫飞旭 喻会平 龙友华 吴小毛 黎晓茜 李磊
摘 要:为获得对烟蚜具有感染作用的虫霉菌,从贵州不同烟区采集受霉菌感染的烟蚜虫尸标本进行菌株分离,在室内进行感染率测定筛选获得优势菌株并通过rDNA-ITS序列测定,用菌丝生长速度法探索适宜虫霉菌生长的培养基、温度、光照和pH条件。结果表明,采集分离获得16株真菌,其中,感染作用较强的CM-4、CM-11和CM-15,在室内施用15 d后,对烟蚜的感染率分别达68.07%、69.80%和72.05%;通过BLAST在线比对CM-4、CM-11和CM-15 3株虫霉菌分别与金色毛壳菌(Chaetomium aureum)、渐狭蜡蚧菌(Lecdanicillium attenuatum)和少根根霉菌(Rhizopus arrhizus)同源性最高;CM-11和CM-15适宜在培养基E,CM-4适宜在培养基A条件下培养;CM-4和CM-15适宜温度为25~30 ℃,适宜CM-4和CM-11的光照为半光照半黑暗,pH为6~7。研究表明,金色毛壳菌、渐狭蜡蚧菌和少根根霉菌对烟蚜具有较强的感染作用,可用于烟蚜的生物防治。
关键词:烟蚜;虫霉菌;培养条件;生物防治;鉴定
中图分类号:S435.72 文章编号:1007-5119(2018)06-0043-08 DOI:10.13496/j.issn.1007-5119.2018.06.007
烟蚜[Myzus persicae (sulzer)],又名桃蚜,是烟草重要的害虫之一,在世界范围内均有分布。烟蚜通过刺吸式口器吸取烟叶汁液,影响烟草正常的生理功能和生长,同时烟蚜还可排泄蜜露,引起霉菌滋生,污染叶片[1],此外,烟蚜是病毒的重要传播媒介,可传播CMV、PVY等病毒病,烟蚜为害可降低烟叶烟碱含量,减小烟叶面积,严重降低烟叶品质,给烟草生产带来巨大的经济损失[2]。目前烟蚜的防治主要依赖于化学药剂,使用不当易引起污染等问题,且长期使用可造成烟蚜生理发生变异,产生可遗传的抗药性[3-4]。生物防治是一种清洁、绿色的防控技术,烟蚜的生物防治主要通过使用生物农药、释放天敌昆虫等手段[5-6],如利用瓢虫[7]和蚜茧蜂[8]。
虫霉菌是一类能寄生于害虫虫体,导致虫体感染、发病、死亡的真菌。利用虫霉菌防治害虫是一种绿色、安全的生物防治手段。目前该技术在多种害虫的防治上已得到广泛使用,如白僵菌(Beauveria bassiana)防治甘薯象甲、玉米螟和马尾松毛虫,绿僵菌(Metarhizium)防治金龟子等[9]。而在煙蚜方面,目前有报道的烟蚜生防虫霉菌包括白僵菌、绿僵菌[10-14]、球毛壳菌(Chaetomium globosum)[15-17]、蜡蚧轮枝菌(Lecanicillium lecanii)[18]、Lecanicillium longisporum[19-20]、弗氏新接霉蚜霉菌[Neozygites fresenii (Nowakowski)][21]、耳霉菌(Conidiobolus major)[22]和青霉菌(Paecilomyces sp.)[23-26]。但目前尚无一种被广泛应用于烟蚜防控的虫霉菌,限制这一技术发展的主要因素包括烟蚜虫霉菌菌种资源较少、致病力弱且培养难度大,此外虫霉菌对田间环境条件的适应性较差。基于此种情况,本试验从贵州不同烟区采集、分离和筛选对烟蚜具有较强致病力的生防优势虫霉菌,以丰富烟蚜虫霉菌菌种资源,并通过室内培养条件的初筛,为田间适用条件研究奠定基础。以期为烟蚜虫霉菌的研究与开发利用提供科学依据和技术参考。
1 材料与方法
1.1 试验地点与材料
1.1.1 试验地点 贵州大学农产品质量安全实验室,贵州大学作物保护研究所。
1.1.2 供试材料 供试烟草:毕纳1号,2015—2016年栽培于贵州大学作物保护研究所试验温棚内;供试烟蚜:当年培育于毕纳1号烟叶上的健康烟蚜。
1.2 试验设计
1.2.1 虫霉菌采集与分离 虫霉菌采集:分别从贵州省毕节、遵义、六盘水、安顺和黔西南烟区采集受虫霉菌感染的烟蚜,其特征为已死烟蚜的虫尸上长有菌丝,颜色一般为白色、灰色、黑色和黄色。虫霉菌分离:将受感染的烟蚜粘在含有PDA的培养皿盖内中央,将培养皿置于28 ℃恒温箱内培养7 d,待PDA上长出菌落后,根据颜色和长势不同,将菌株进行纯化培养。
1.2.2 菌悬液制作 将纯化后的菌株挑到PDA平板上置于25 ℃恒温箱内培养7 d,用打孔器取0.5 cm菌饼至含有150 mL不加琼脂的PD液体培养基的三角瓶内,将三角瓶置于25 ℃恒温震荡箱内培养5 d备用。
1.2.3 优势虫霉菌的筛选 挑30头大小相似的健康无翅烟蚜置于15 cm×15 cm的烟叶背面,将烟叶置于培养皿内保湿培养。将菌悬液用纱布过滤掉菌丝后,喷施于烟叶和蚜虫体上,喷至烟叶滴水。每个处理3次重复,并设置CK对照(喷施无菌水)。观察3 d和7 d后烟蚜虫尸是否长出霉菌来判断是否被感染(正常死亡的烟蚜,后期虫尸变黑色干扁,无霉菌)。从感染的虫尸中按照步骤1.2.1进行霉菌分离,确认感染前施用的菌株与感染后分离所得的菌株是否一致。
对具有感染作用的菌株进行感染力测定:在室内盆栽烟苗,待5叶时将30头大小相似的健康无翅烟蚜接到烟叶背部,室温下培育15 d。在将具有感染作用菌株菌悬液用纱布过滤掉菌丝后,喷施于烟叶和蚜虫体上,喷至烟叶滴水。每个处理3次重复,并设置CK对照(喷施无菌水)。调查7 d、11 d和15 d后烟蚜的感染率。
感染率=感染虫口数/虫口总数×100%
1.2.4 虫霉菌的鉴定 采用Biomiga公司的Fungle gDNA Kit提取试剂盒提取DNA,选用ITS4/ITS5引物进行ITS基因片段扩增,PCR扩增产物送至生工生物工程(上海)股份有限公司进行序列测定,并将获得的序列在NCBI中BLAST软件进行同源性比对。
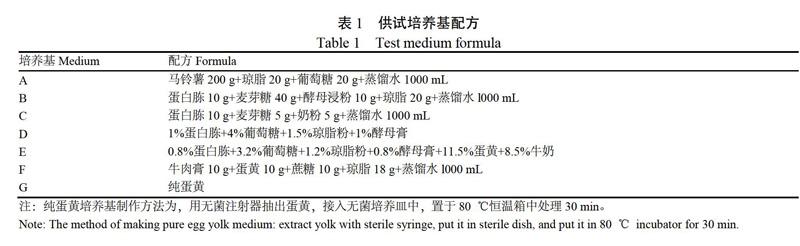
1.2.5 虫霉菌适宜培养基的筛选 用表1中的培养基在28 ℃下对筛选得出的优势虫霉菌进行培养,每种培养基设3次重复,用“十字交叉法”每隔24 h测量虫霉菌菌落直径,并计算菌丝生长速度。
生长速度(cm/h)=菌落直径(cm)/培养时间(h)
1.2.6 虫霉菌适宜温度条件的筛选 用PDA培养基在10、15、20、25、30、35 ℃的恒温培养箱中对虫霉菌进行培养。每种温度条件设3次重复,并每隔24 h测量虫霉菌菌落直径,计算菌丝生长速度。
1.2.7 虫霉菌适宜光照条件的筛选 设置全光照、全黑暗、12 h光照12 h黑暗的光照条件且温度为28 ℃恒温的培养条件,用PDA培养基对虫霉菌进行培养。每种光照条件设3次重复,每隔24 h测量虫霉菌菌落直径,计算菌丝生长速度。
1.2.8 虫霉菌适宜pH条件的筛选 将虫霉菌置于PDA平板上培养7 d,配制pH值分别3、4、5、6、7、8、9、10的PDA液体培养基各150 mL于三角瓶内,将平板上的虫霉菌用打孔器取直径0.5 cm的菌饼(CK为无菌PDA小块),将菌饼分别放入不同pH值的液体培养基中,每个pH处理设3次重复,三角瓶封口后,置于28 ℃恒温和150 r/min的震荡箱中培养5 d。5 d后,将三角瓶内的菌液用纱布进行过滤,后将装有滤渣的纱布置于80 ℃的烘箱内烘干8 h,取出烘干后带有滤渣的纱布进行称量,计算出平均菌株干物质重量。
1.3 数据分析
采用Microsoft Excel 2007和Dps 7.05數据统计软件对试验数据进行单因素方差分析,采用Duncans新复极差法进行差异显著性分析。
2 结 果
2.1 虫霉菌的采集、分离与筛选
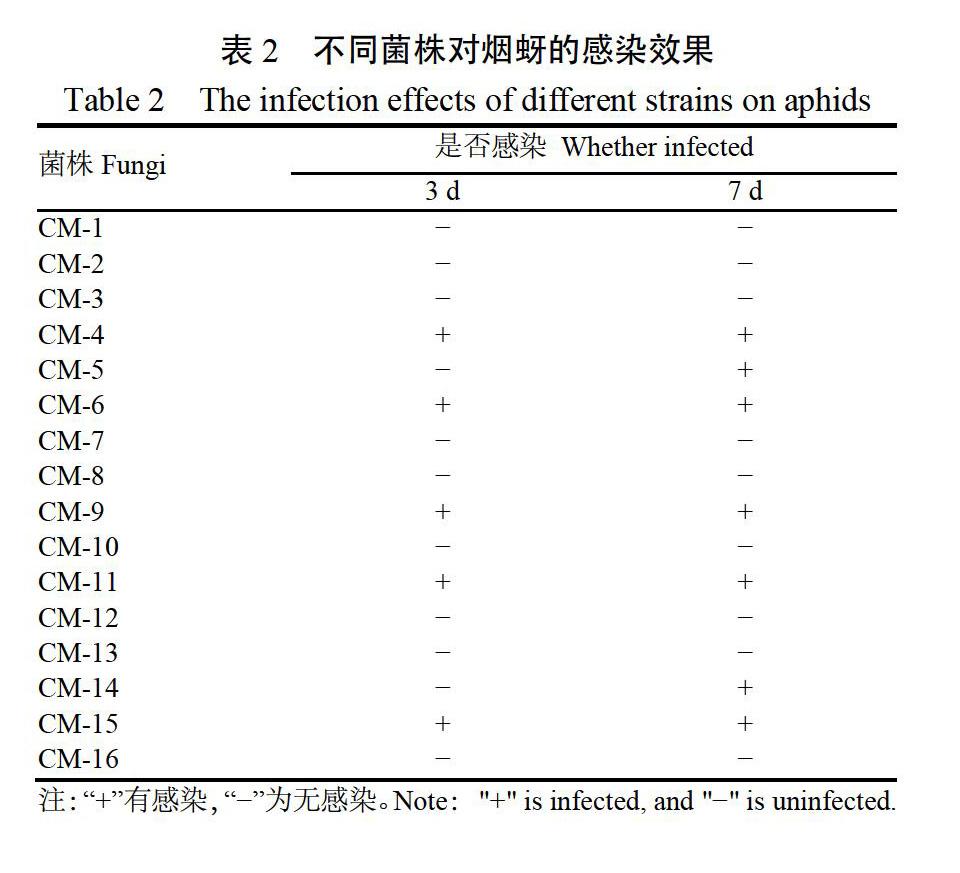
2015—2016年间从贵州省毕节市、遵义市、六盘水市、安顺市和黔西南州烟区共采集得感染烟蚜标本11个,分离获得真菌菌株16株,按照采集顺序标记为CM-1、CM-2、CM-3…CM-16。通过感染作用测定发现(表2),施用菌悬液3 d后仅有CM-4、CM-6、CM-9、CM-11和CM-15具有感染作用,7 d后CM-4、CM-5、CM-6、CM-9、CM-11、CM-14和CM-15等7株菌株对烟蚜具有感染作用,其他菌株均无感染作用。
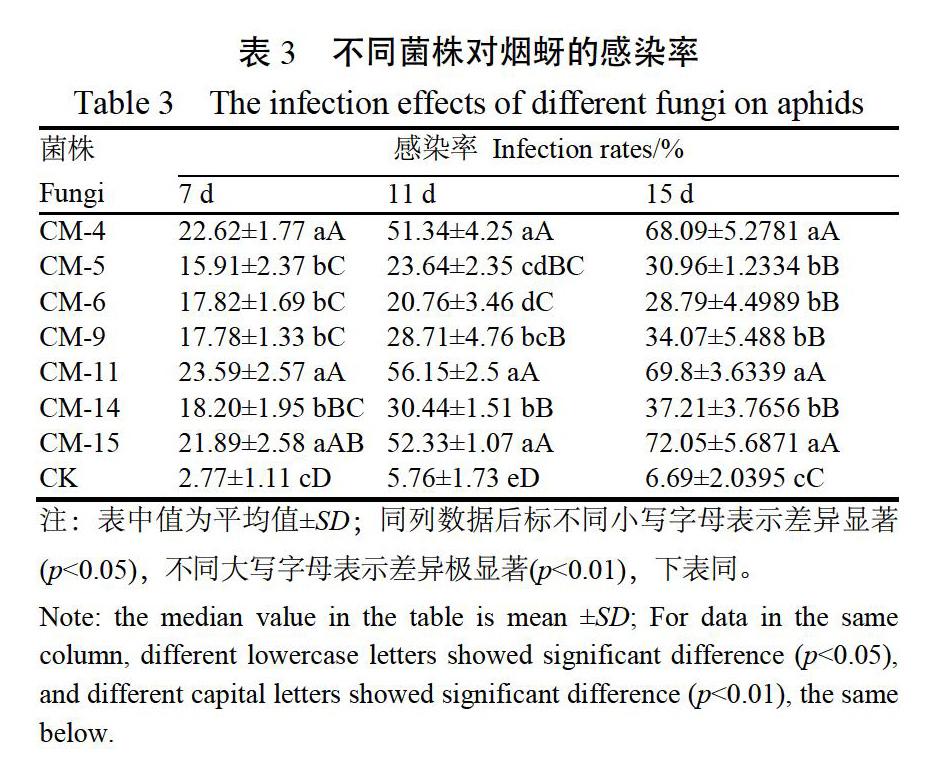
将具有感染作用的7株菌株进行感染力测定。
结果如表3所示,随施用时间的延长,各菌株处理对烟蚜的感染率不断增大。施用菌悬液7 d后,所 有菌株对烟蚜的感染率均大于15%,其中菌株 CM-11的感染率达到22.62%。11 d后菌株CM-11 的感染率达到56.15%,高于其他菌株处理,菌株 CM-15次之,达52.33%,其次为CM-4为51.34%, 该3株菌株感染率显著高于其他处理。15 d菌株 CM-15、CM-11和CM-4对烟蚜的感染率分别达到 了72.05%、69.80%和68.07%,均显著高于其他菌 株,且同CK相比差异极显著。试验结果表明,菌株CM-4、CM-11和CM-15为感染力较强,是具有较高生防潜力的优势虫霉菌。
2.2 优势虫霉菌的鉴定
虫霉菌CM-4、CM-11和CM-15在PDA平板上的菌落形态分别如图1A、图1B和图1C所示。CM-4
菌丝体呈金黄色,培养基因菌体产生渗出物而变为紫红色,菌落背面呈暗紫色,如图1D所示,其孢子呈舟形、纺锤形或卵形,灰褐色,大小为9~12 μm×
5~6.5 μm;CM-11菌丝紧密,呈乳白色,背面呈米黄色(图1E),经过多种不同条件培养,均未发现该菌株产孢;CM-15菌丝棉絮状,褐色,孢子球形、近球形或卵形(图1F),直径3.5~6 μm,为无色或浅灰色。
将序列测定所获得的序列与GenBank中已有序列进行同源性比较,结果发现,CM-4与金色毛壳菌(Chaetomium aureum)的同源性为100%,CM-11与渐狭蜡蚧菌(Lecdanicillium attenuatum)同源性为99%,CM-15与少根根霉( Rhizopus arrhizus)同源性为100%。根据病菌形态学鉴定以及该 DNA序列在NCBI进行同源性对比双重结果,最终确认优势虫霉菌菌株CM-4为金色毛壳菌,CM-11为渐狭蜡蚧菌,CM-15为少根根霉菌或称米根霉菌。
2.3 不同培养基对虫霉菌生长的影响
由图2可以看出,菌株CM-15在各个培养基中的生长速度明显高于菌株CM-4和CM-11。不同虫霉菌在不同培养基中的生长速度均不相同,其中菌株CM-4在培养基A中的生长速度显著高于其他培养基,达到0.032 9 cm/h;菌株CM-11在培养基E中的生长速度0.018 1 cm/h,高于其他培养基处理;菌株CM-15适应力较强,在所有供试培养基中均保持高速生长,其中在培养基E中的生长速度最大,达0.354 2 cm/h。试验表明,在供试的7种培养基中,菌株CM-15的生长力较强,而菌株CM-11较弱。适宜CM-4生长的培养基为培养基A,而适宜CM-11和CM-15生长培养基为培养基E。
2.4 不同温度对虫霉菌生长的影响
不同温度条件下虫霉菌的生长速度如图3所示,菌株CM-4在10 ℃时生长停止,当温度为25 ℃时
生长速度达到最大,达0.018 2 cm/h;菌株CM-11在10~35 ℃条件下均能生长,在温度为25 ℃时生长速度达0.010 6 cm/h,在20 ℃时达0.009 6 cm/h,两者均显著高于其他温度处理;菌株CM-15在10~35 ℃条件下生长速度出现2次峰,第1次出现在15 ℃时,第2次在30 ℃,该菌株在30 ℃条件下生长速度达到最大的0.391 5 cm/h,其次为25 ℃时的0.298 3 cm/h。结果表明,虫霉菌菌株CM-4、CM-11和CM-15适宜培养的温度条件分别为25~30 ℃、20~25 ℃和25~30 ℃。
2.5 不同光照条件对虫霉菌生长的影响
如表4所示,不同光照条件下虫霉菌的生长具有差异。其中,菌株CM-4和CM-11在12 h光照12 h黑暗下生长速度达到最大分别为0.020 7 cm/h 和0.009 0 cm/h,但菌株CM-4和CM-11在不同光照条件下的生长速度差异不显著,表明CM-4和CM-11的光照条件适应能力较强;菌株CM-15在不同光照条件下的生长速度差异显著,其在全黑暗条件下生长速度最大,达0.281 2 cm/h。由此可见,菌株CM-4和CM-11可适应不同光照条件下培养,而菌株CM-15适宜在全黑暗条件下培养。
2.6 不同pH对虫霉菌生长的影响
如图4所示,菌株CM-4和CM-11在pH值为7时,产生干物质分别达到最大,其次为pH 6时,且二者均显著高于其他pH处理,其中CM-11在pH为3时停止生长。表明pH 6~7是菌株CM-4和CM-11的适宜培养酸碱条件。CM-15在pH 5时干物质达到最大,达0.39 g,其次为6时的0.37 g,均显著高于其他pH条件。综上表明菌株CM-4和CM-11喜好酸碱度为中偏酸的环境条件;CM-15适宜在偏酸条件下培养。
3 讨 论
毛壳菌属(Chaetomium sp.)真菌中,球毛壳菌(Chaetomium globosum)对蚜虫等多种害虫具有防控作用[27],而金色毛壳菌(Chaetomium aureum)此前多報道用于病害防控,其与辣椒疫霉病、灰霉病和黄瓜灰霉病有拮抗作用[28-30],而用于烟蚜防治尚无相关报道;KIM等[31]曾从蚜虫虫体中分离获得渐狭蜡蚧菌(Lecdanicillium attenuatum),并发现其对烟蚜、棉蚜等具有寄生致死作用,本试验结果进一步验证该菌株的致病力,此外,渐狭蜡蚧菌还可用于防控柑橘粉虱[32]、茶小绿叶蝉[33]和南方根结线虫[34];少根根霉菌(Rhizopus arrhizus)作为医学病原菌,可引起人体多种皮肤病[35],因此其安全性尚需进一步探究。
关于虫霉菌对蚜虫的致死机理,臧建成[36]认为暗孢耳霉(C.obscurus)通过菌丝侵入蚜虫体内,利用寄主体内营养进行生长繁殖所致;李武高[21]等报道弗氏新接霉通过体壁穿透和机械压力的方式杀死蚜虫;GURULINGAPPA等[37]发现蜡蚧轮枝菌(Lecanicillium lecanii)菌丝体能产生对棉蚜具有毒力作用的乙酸乙酯和甲醇等毒素。GLISZCZYNSK等[38]认为将生防菌基因进行转化可增强其致病力。本试验尚未对筛选出的3株致病霉菌进行相关致病因子探索。
生防虫霉菌使用技术的另一难点在于菌株的田间条件适应性能,一般自然条件适应力较强的菌株更具有开发利用前景[39-40]。除菌株天然的适应力外,还可通过人工驯化、基因转化[38]或定殖于植物中[41]等措施来提高菌株适应力,本试验对所获得的3株虫霉菌进行培养条件初筛,可为菌株适应力及田间施用条件研究奠定基础,但要确定培养基、温度、光照、pH等条件的互作关系,明确适宜的培养条件,仍需要做进一步的互作试验探究。
4 结 论
试验筛选获得了金色毛壳菌(Chaetomium aureum)、渐狭蜡蚧菌(Lecdanicillium attenuatum)和少根根霉菌 (Rhizopus arrhizus) 3株对烟蚜具有较强致病力的生防虫霉菌株,其中金色毛壳菌和少根根霉对烟蚜的感染作用属首次报道,丰富了烟蚜生防菌资源。
通过初步筛选分别获得了适宜3株菌株生长的温度、pH和光照条件,为该菌株培养保存和田间施用技术研究奠定基础。
参考文献
[1] 蔺忠龙,郭怡卿,浦勇,等. 病虫害生物防治技术最新研究进展[J]. 中国烟草学报,2011,17(2):90-94.
LIN Z L, GUO Y Q, PU Y, et al. Recent advances in research in biological control of tobacco diseases and
pests[J]. Acta Tabacaria Sinica, 2011, 17(2): 90-94.
[2] 陈杰,付继刚,杨天沛,等. 我国烟蚜防治研究进展[J].
作物杂志,2015(6):21-26.
CHEN J, FU J G, YANG T P, et al. The research progress of Myzus Persicae control in China[J]. Crops, 2015(6): 21-26.
[3] 李勇,何林. 烟蚜抗药性机制的研究进展[J]. 贵州农业科学,2016(7):44-48.
LI Y, HE L. Advances in insecticide resistance mechanism of Myzus persicae[J]. Guizhou Agricultural Sciences, 2016(7): 44-48.
[4] 吴兴富,邓建华,王德俊,等. 农药连用对烟蚜抗药性发展的影响[J]. 中国烟草学报,2004(5):42-46.
WU X F, DENG J H, WANG D J, et al. The effct of continually spraying pesticides on the development of resistance in Myzus nicotianae (Blackman)[J]. Acta Tabacaria Sinica, 2004(5): 42-46.
[5] 張玉玲,朱艰,杨程,等. 生物防治在烟草病虫害防治中的应用进展[J]. 中国烟草科学,2009,30(4):81-85.
ZHANG Y L, ZHU J, YANG C, et al. Advance in Biological Control to Tobacco Diseases and Pests[J]. Chinese Tobacco Science, 2009, 30(4): 81-85.
[6] 董志坚,程道全,董顺德,等. 植物源农药在烟草病虫害防治上的研究与应用[J]. 中国烟草学报,2004(4):45-50.
DONG Z J, CHENG D Q, DONG S D, et al. Research and application of plant-based pesticides to control tobacco diseases and pests[J]. Acta Tabacaria Sinica, 2004(4): 45-50.
[7] FAGAN L L, MCLACHLAN A, TILL C M, et al. Synergy between chemical and biological control in the IPM of currant-lettuce aphid (Nasonovia ribisnigri) in Canterbury, New Zealand[J]. Bulletin of Entomological Research, 2009(2): 21-23.
[8] WEI J N, LI T F, KUANG R P, et al. Mass rearing of Aphidius gifuensis (Hymenoptera: Aphididae) for biological control of Myzus persicae (Homoptera: Aphididae)[J]. Biocontrol Science and Technology, 2003(1): 87-97.
[9] 李增智. 我国利用真菌防治害虫的历史、进展及现状[J]. 中国生物防治学报,2015,31(5):699-711.
LI Z Z. History, progress and current status of the application of fungi against pest insects in China[J]. Chinese Journal of Biological Control, 2015, 31(5): 699-711.
[10] AKMAL M, FREED S, MALIK M N, et al. Efficacy of Beauveria bassiana (Deuteromycotina: Hypomycetes) against different aphid species under laboratory conditions[J]. Pakistan Journal of Zoology, 2013, 45(1): 71-78.
[11] BAYISSA W, EKESI S, MOHAMED S A, et al. Selection of fungal isolates for virulence against three aphid pest species of crucifers and okra[J]. Journal of Pest Science, 2017, 90: 355-368.
[12] YUN H G, KIM D J, GWAK W S, et al. Entomopathogenic fungi as dual control agents against both the Pest Myzus persicae and phytopathogen Botrytis cinerea[J]. Mycobiology, 2017, 45(3): 192-198.
[13] SHAN L T, FENG M G. Evaluation of the biocontrol potential of various Metarhizium isolates against green peach aphid Myzus persicae (Homoptera: Aphididae)[J]. Pest Management Science, 2010, 66: 669-675.
[14] JANDRICIC S E, FILOTAS M, SANDERSON J P, et al. Pathogenicity of conidia-based preparations of entomopathogenic fungi against the greenhouse pest aphids Myzus persicae, Aphis gossypii, and Aulacorthum solani (Hemiptera: Aphididae)[J]. Journal of Invertebrate Pathology, 2014, 118(4): 34-36.
[15] HESKETH H, ALDERSON P G, PYE B J, et al. The development and multiple uses of a standardised bioassay method to select hypocrealean fungi for biological control of aphids[J]. Biological Control, 2008, 46: 242-255.
[16] ZHAO S S, LI Y Y, YAN W, et al. Chaetomium globosum CDW7, a potential biological control strain and its antifungal metabolites[J]. FEMS Microbiology Letters, 2017, 364(3): 287-292.
[17] QI G, LAN N, MA X, et al. Controlling Myzus persicae with recombinant endophytic fungi Chaetomium globosum expressing Pinellia ternate agglutinin using recombinant endophytic fungi to control aphids[J]. Journal of Applied Microbiology, 2011, 110(5): 1314-1322.
[18] DIAZ B Z, OGGERIN M, CLAUDIA C, et al. Characterization and virulence of Lecanicillium lecanii against different aphid species[J]. BioControl, 2009, 54: 825-835.
[19] DOWN R E, ANDREW G S, CUTHBERTSON, et al. Dissemination of the entomopathogenic fungi, Lecanicillium longisporum and L. muscarium, by the predatory bug, Orius laevigatus, to provide concurrent control of Myzus persicae, Frankliniella occidentalis and Bemisia tabaci[J]. Biological Control, 2009, 50: 172-178.
[20] RODITAKIS E, COUZIN I D, FRANKS N R, et al. Effects of Lecanicillium longisporum infection on the behaviour of the green peach aphid Myzus persicae[J]. Journal of Insect Physiology, 2008, 54: 128-136.
[21] 李武高,趙惠燕,李随院,等. 杀虫真菌——弗氏新接霉蚜霉菌研究进展[J]. 干旱地区农业研究,2003(3):141-144,151.
LI W G, ZHAO H Y, LI S Y, et al. Advance in the study on entomogenous fungi——Neozygites fresenii (Nowakowski)[J]. Agricultural Research in the Arid Areas, 2003(3): 141-144, 151.
[22] 刘明晖,陈家骅,张玉珍,等. 耳霉菌分生孢子对烟草蚜虫的毒力研究[J]. 福建农学院学报,1991(2):150-152.
LIU M H, CHEN J H, ZHANG Y Z, et al. The conditional toxicity to the tobacco aphid of the conidiobolus[J]. Journal of Fujian Agricultural College, 1991(2): 150-152.
[23] VU V H, HONG S I, KIM K. Selection of entomopathogenic fungi for aphid control[J]. Journal of Bioscience and Bioengineering, 2007, 104(6): 498-505.
[24] 邓建华,吴兴富,庄辉,等. 两种拟青霉对烟蚜感染作用试验[J]. 烟草科技,2005(3):46-48.
DENG J H, WU X F, ZHUANG H, et al. Infection Effect of Paecilomyces sp. on Myzus nicotianae (Blackman)[J]. Tobacco Science &Technology, 2005(3): 46-48.
[25] 杨斌,李桐森,王晓波,等. 2种拟青霉代谢产物对烟蚜乙酰胆碱酯酶和羧酸酯酶的影响[J]. 云南大学学报(自然科学版),2005(2):166-169,175.
YANG B, LI T S, WANG X B, et al. Impacts of metabolites from Paecilomyces farinosou and P. fumosoroseus on acetyicholinesterase and carboxylesterase of tobacco aphides[J]. Journal of Yunnan University (Natural Sciences Edition), 2005(2): 166-169, 175.
[26] 杨斌,王晓波,何美军. 玫烟色拟青霉代谢产物对烟蚜的毒杀活性[J]. 西南林学院学报,2004(4):38-41.
YANG B, WANG X B, HE M J. Insecticidal activity of metabolites produced by Paecilomyces fumosoroseus to tobacco aphides[J]. Journal of Southwest Forestry University, 2004(4): 38-41.
[27] ZHOU W Q, STARR J L, KRUMM J L, et al. The fungal endophyte Chaetomium globosum negatively affects both above- and belowground herbivores in cotton[J]. Fems Microbiology Ecology, 2016, 92(10): 158.
[28] 滕怀丽. 金色毛壳菌HTC生物学特性研究及其抑菌活性检测[D]. 泰安:山东农业大学,2014.
TENG H L. Research on the bionomics of Chaetomium aureum HTC and detection on its antibacterial activity[D]. Taian: Shandong Agricultural University, 2014.
[29] 焦晨潇. 金色毛壳菌HTC菌株及其发酵液理化性质、安全性和防病作用初探[D]. 泰安,山东农业大学,2015.
JIAO C X. Physic-chemical characteristic, safety and antifungal activity of fermentation liquid of Chaetomium aureum strain HTC[D]. Tai'an: Shandong Agricultural University, 2015.
[30] 刘永亮. 辣椒疫霉拮抗真菌毛壳菌和青霉菌的分离鉴定及其生防潜力的研究[D]. 泰安:山东农业大学,2013.
LIU Y L. Isolation and identification of fungal antagonist Cheatomium and Pemcillium against Phytophthora capsici and studies on their potential of biocontrol[D]. Tai'an: Shandong Agricultural University, 2013.
[31] KIM J J, GOETTEL M S, GILLESPIE D R. Potential of Lecanicillium species for dual microbial control of aphids and the cucumber powdery mildew fungus, Sphaerotheca fuliginea[J]. Biological Control, 2007, 40: 327-332.
[32] 丁莉莉,罗忍,潘琦,等. 柑桔粉虱寄生性真菌渐狭蜡蚧菌TN002菌株培养条件探究[J]. 中国南方果树,2017,46(2):58-62.
DING L L, LUO R, PAN Q, et al. Study on the culture conditions of Lecdanicillium attenuatum TN002, a parasitic fungus of Dialeurodes citri[J]. South China Fruits, 2017, 46(2): 58-62.
[33] 周叶鸣,邹晓,瞿娇娇,等. 一种寄生茶小绿叶蝉蜡蚧菌的鉴定及产孢条件优化[J]. 微生物学通报,2016,43(5):935-941.
ZHOU Y M, ZOU X, QU J J, et al. Identification of a parasitic Lecanicillium of tea lesser leafhopper and optimization of sporulation conditions[J]. Microbiology China, 2016, 43(2): 935-941.
[34] 赵洋,陈德鑫,黄化刚,等. 渐狭蜡蚧菌Lecanicillium attenuatum产几丁质酶的活性及对南方根结线虫卵孵化的抑制作用[J]. 植物保护学報,2014,41(5):547-554.
ZHAO Y, CHEN D X, HUANG H G, et al. Inhibition of chitinase-producing fungus Lecanicillium attenuatum on egg-hatching of root-knot nematode Meloidogyne incognita[J]. Journal of Plant Protection, 2014, 41(5): 547-554.
[35] 张思平,刘蔚,胡白. 少根根霉所致皮肤毛霉病3例[J]. 临床皮肤科杂志,2012,41(3):163-165.
ZHANG S P, LIU W, HU B. Cutaneous mucormycosis due to Rhizopus arrhizus: report 3 cases[J]. Journal of Clinical Dermatology, 2012, 41(3): 163-165.
[36] 臧建成. 暗孢耳霉菌生物学特性及对甘蓝蚜致病机理的研究[D]. 兰州,甘肃农业大学,2005.
ZANG J C. Studied on the biological character and the pathogenic mechanisms to Brevicorvne brassicae of Conidiobolus obscurus[D]. Lanzhou: Gansu Agricultural University, 2005.
[37] GURULINGAPPA P, MCGEE P A, SWORD G. Endophytic Lecanicillium lecanii and Beauveria bassiana reduce the survival and fecundity of Aphis gossypii following contact with conidia and secondary metabolites[J]. Crop Protection, 2011, 30: 349-353.
[38] GLISZCZYNSK A, GLADKOWSK W, DANCEWICZ K, et al. Transformation of β-damascone to (+)-(S)-4-hydroxy-β-damascone by fungal strains and its evaluation as a potential insecticide against aphids Myzus persicae and lesser mealworm Alphitobius diaperinus Panzer[J]. Catalysis Communications, 2016, 80: 39-43.
[39] 李凱,袁鹤. 植物病害生物防治概述[J]. 山西农业科学,2012(7):807-810.
LI K, YUAN H. Review on biological control of plant diseases[J]. Journal of Shanxi Agricultural Sciences, 2012(7): 807-810.
[40] 薛登民,刘安典,张琼瑶,等. 流行性蚜霉菌的安全性研究[J]. 西北农林科技大学学报(自然科学版),1989(1):81-87.
XUE D M, LIU A D, ZHANG Q Y, et al. Studies of safety of Entomophthora fresenii[J]. Journal of Northwest A&F University(Natural Science Edition), 1989(1): 81-87.
[41] GURULINGAPPA P, SWORD G A, MURDOCH G, et al. Colonization of crop plants by fungal entomopathogens and their effects on two insect pests when in planta[J]. Biological Control, 2010, 55: 34-41.
