乳头状甲状腺癌患者外周血TSHR mRNA表达水平及其与临床特征的关系分析
2018-05-03左秀玲王志宏陈海燕
左秀玲,王志宏,陈海燕
郑州市第一人民医院内分泌科,郑州 450004
甲状腺癌是最常见的内分泌恶性肿瘤,其中乳头状甲状腺癌(papillary thyroid cancer,PTC)是其最主要的病理类型,占甲状腺癌的80%[1]。PTC早期患者(Ⅰ~Ⅱ期)的5年生存率可达100%,Ⅲ期患者约为93%,而Ⅳ期患者仅为51%[2-4];因此,PTC患者的早期诊断对增加其生存率十分重要。甲状腺癌相关肿瘤分子标志物是早期诊断的重要指标。有研究证实,多种肿瘤标志物与甲状腺癌的发生发展密切相关[5-6],其中促甲状腺激素受体(thyroid stimulating hormone receptor,TSHR)是甲状腺组织的特异性标志物,在甲状腺功能和甲状腺细胞生长过程中具有重要的调节作用;然而,已有的研究多集中于TSHR蛋白在甲状腺癌组织中的作用,而其在PTC外周血中基因表达变化的研究相对较少,且多采用术后组织病理标本进行肿瘤标志物检测,达不到早期鉴别诊断的目的。本研究采用实时荧光定量聚合酶链反应(polymerase chain reaction,PCR)技术,体外检测PTC患者的外周血TSHR mRNA表达水平,探讨其在PTC鉴别诊断中的应用价值,并分析TSHR mRNA表达水平与临床特征的关系,为PTC的研究提供参考。
1 对象与方法
1.1 研究对象
选取2015年1月至2016年6月郑州市第一人民医院确诊的50例PTC患者作为观察组,同期40例于郑州市第一人民医院体检的健康体检者作为对照组。观察组患者的纳入标准:①所有患者均于术后经病理学检查确诊;②临床资料完整;③初次手术;④术前未经放化疗和生物治疗。排除标准:①合并心、肝、肾功能不全;②伴其他恶性肿瘤。观察组50例患者中,男18例,女32例;年龄为26~75岁,平均为(43.4±8.2)岁;TNM分期:Ⅰ期有9例,Ⅱ期有12例,Ⅲ期有16例,Ⅳ期有13例;淋巴结转移:有淋巴结转移者16例,无淋巴结转移者34例。对照组40例受试者中,男16例,女24例;年龄为25~76岁,平均为(44.1±8.1)岁。两组受试者的年龄和性别等一般资料比较,差异无统计学意义(P﹥0.05),具有可比性。本研究经郑州市第一人民医院伦理委员会批准同意,所有受试者均签署本研究的知情同意书。
1.2 方法
1.2.1 样品收集与总RNA提取 采集观察组患者术前和对照组受试者清晨空腹外周静脉血5 ml,立即应用Trizol试剂(购于美国Sigma Aldrich公司)从受试者全血中提取总RNA。将提取的总RNA加入 20 μl水中溶解,测光密度(optical density,OD)值。当OD260/OD280≥1.8时,可用于后续研究。
1.2.2 实时荧光定量PCR技术 根据反转录试剂盒(购于日本Takara公司)的说明书,将RNA逆转录为cDNA。应用SYBR Green(购于日本Takara公司)染色,进行实时PCR分析。利用ABI7500系统(购于美国Applied Biosystems公司),按照制造商提供的方案在含1 μg cDNA的25 μl反应系统中进行实时荧光定量PCR反应,所有反应均重复3次。以β-actin作为内参,目的基因TSHRmRNA和内参β-actin引物由上海生工生物工程股份有限公司合成,采用2-ΔΔCt法计算mRNA的相对表达水平,引物序列如下:TSHR,Forward 5'-GCTTTTCAGGGACTATGCAATGAA-3',Reverse 5'-AAGGGCAGTGACACTGGTTTGAGA-3';β -actin,Forward 5'-CCAGCACAATGAAGATCAAGATCAT-3',Reverse 5'-ATCTGCTGGAAGGTGGACAGCGA-3'。实时荧光定量PCR反应的条件:95℃下10 s,95℃下5 s,57.5℃下20 s,共40个循环。
1.2.3 统计学方法 采用SPSS 20.0统计软件分析数据,计数资料以率(%)表示,采用χ2检验;计量资料以均数±标准差(±s)表示,多组间比较采用方差分析,两两比较采用LSD-t检验,P﹤0.05为差异有统计学意义。
2 结果
2.1 TSHR mRNA的表达水平
观察组50例患者的外周血TSHR mRNA的平均表达水平为(1.82±0.28),明显高于对照组40例受试者的(1.01±0.03),差异有统计学意义(t=18.192,P﹤0.01)。
2.2 实时荧光定量PCR检测结果
TSHR和β-actin基因的熔解曲线均显示单峰,无引物二聚体形成,提示反应体系良好,无污染物干扰;扩增曲线显示引物质量良好,PCR产物未出现非特异性产物。(图1)
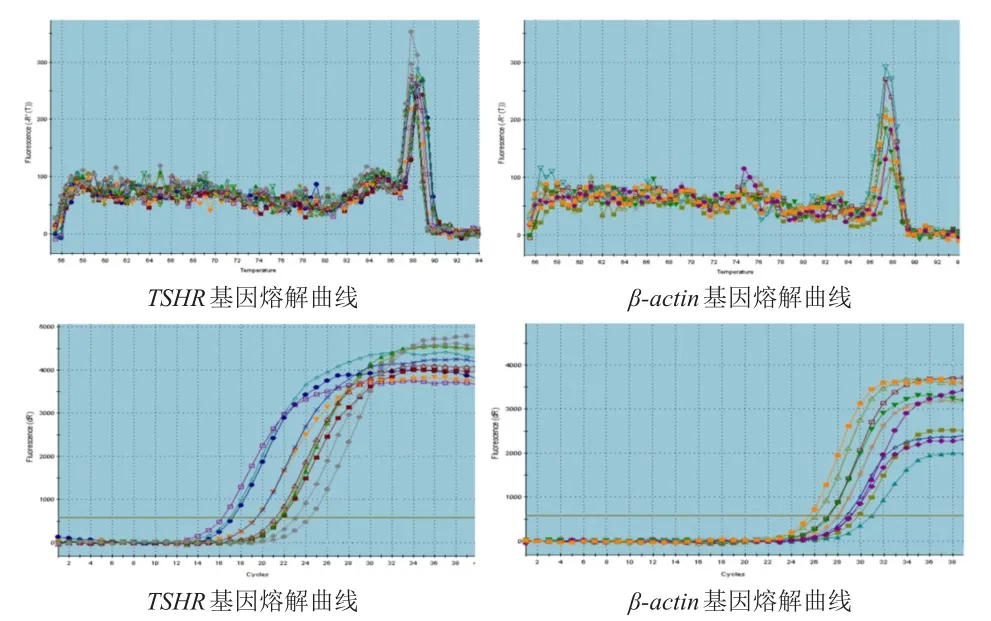
图1 实时荧光定量PCR检测结果
2.3 TSHR mRNA表达与临床特征的关系
PTC患者的外周血TSHR mRNA表达水平在性别、年龄、肿瘤直径方面比较,差异均无统计学意义(P﹥0.05);PTCⅢ~Ⅳ期患者的TSHR mRNA表达水平明显高于Ⅰ~Ⅱ期患者,差异有统计学意义(F=14.381,P﹤0.01);有淋巴结转移患者的TSHR mRNA表达水平明显高于无淋巴结转移的患者,差异有统计学意义(t=4.453,P﹤0.01)。(表1)
3 讨论
实时荧光定量PCR技术具有准确性高和重复性好的优点,广泛应用于基因表达研究,仅需少量的外周血即可进行研究,可消除其他基因的干扰。本研究采用实时荧光定量PCR技术检测PTC患者外周血样本中TSHR mRNA的表达水平,分析其与临床特征的关系,探讨TSHR mRNA在PTC诊断中的应用价值。当熔解曲线显示为单峰时,证明实时荧光定量PCR所用引物特异性高,无二聚体,且无其他非特异性扩增。本研究中TSHR mRNA的熔解曲线为单峰,且为避免基因组DNA对研究结果的干扰,本研究所有目的基因和内参基因引物扩增产物的长度均为90~150 bp,扩增效率相近,证明本研究的数据准确可靠。
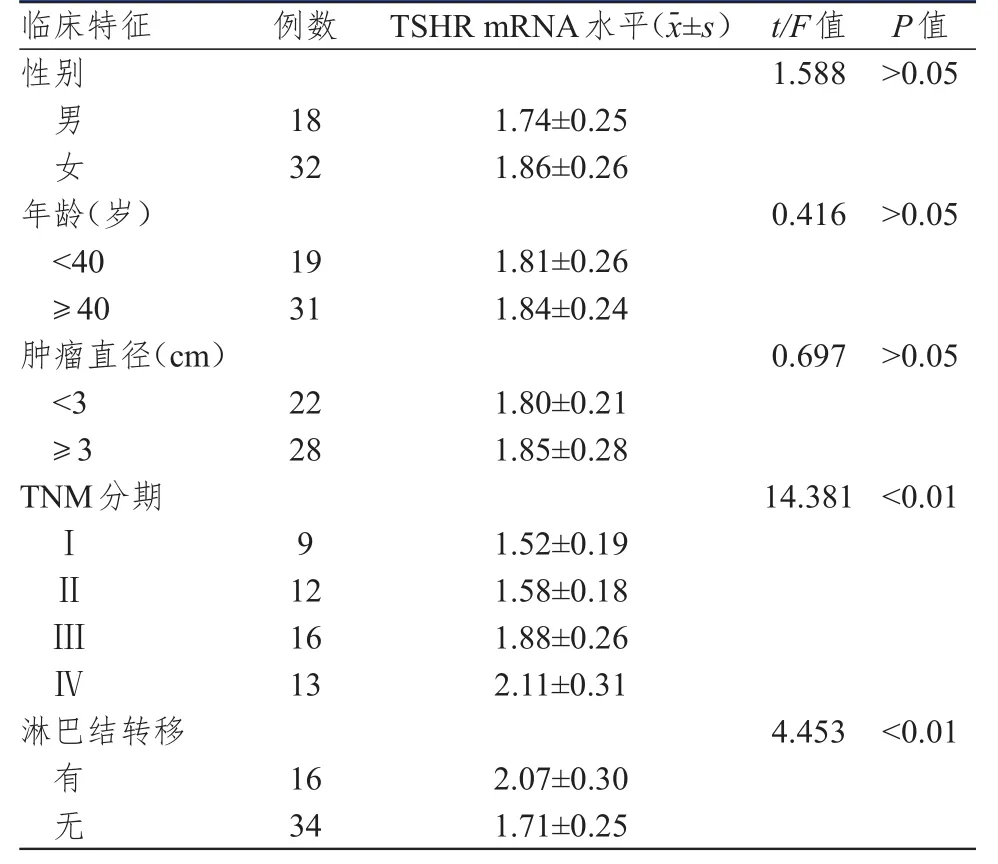
表1 PTC患者外周血TSHR mRNA表达水平与临床特征的关系
促甲状腺激素与其受体TSHR是调控甲状腺功能的关键蛋白。正常情况下TSH与TSHR结合后可以激活腺苷酸环化酶和磷酸酯酶C,进而通过环磷酸腺苷、乙酰甘油和1,4,5-三磷酸肌醇传递信号,从而刺激甲状腺细胞生长,并参与调节甲状腺球蛋白(thyroglobulin,Tg)、甲状腺过氧化物酶(thyroid peroxidase,TPO)和钠碘转动体(sodium iodide symporter,NIS)等表达,其中 TSHR在甲状腺的调控中起主导作用。已有研究证实,在正常的甲状腺细胞和癌细胞中均有TSHR表达,其表达水平存在差异[7]。王朝晖等[8]的研究显示,应用免疫组化法检测PTC组织和正常甲状腺组织标本中TSHR蛋白表达情况,PTC组织中TSHR蛋白表达高于正常甲状腺组织,这可能是甲状腺癌发生的早期标志。这些研究表明,TSHR可以作为诊断PTC的生物标志物。
过往研究多集中于甲状腺癌根治术后肿瘤组织中TSHR蛋白表达的变化,而外周血中其基因表达变化的研究较少。Ishikawa等[9]在甲状腺癌患者的外周血中发现了甲状腺细胞,且TSHR mRNA表达异常。Torosian等[10]的研究发现,正常人外周血中存在少量的甲状腺细胞。血液中TSHR mRNA的表达与循环中的癌细胞TSHR mRNA高表达有关[11]。这些研究表明,可以通过外周血甲状腺细胞中目的基因的变化情况诊断甲状腺疾病。本研究对外周血单核细胞中TSHR mRNA进行相对定量检测发现,PTC患者和健康受试者的外周血中均发现TSHR mRNA表达,且PTC患者的TSHR mRNA表达水平明显高于健康受试者,提示外周血细胞中TSHR mRNA表达水平升高与甲状腺病变有关。
刘翔和高明[12]采用免疫组化法检测侵袭性PTC患者肿瘤组织中TSHR蛋白表达情况,低分化、高侵袭性、有淋巴结转移的患者中TSHR蛋白表达水平明显降低,且其表达水平与肿瘤恶性程度呈明显负相关。许少伟等[13]的研究发现,PTC原发病灶中TSHR表达水平与患者的年龄、性别、TNM分期、淋巴结转移等均无关。本研究中发现,外周血TSHR mRNA的表达水平与PTC患者的年龄、性别、肿瘤直径无关,与之前研究一致;然而,本研究中有淋巴结转移者的外周血TSHR mRNA表达水平明显高于无淋巴结转移者(P﹤0.01),推测发生淋巴结转移的患者,其PTC癌细胞的侵袭性相对较强,更易于从组织中脱落而进入外周血,使外周血中甲状腺细胞数量增加,从而使TSHR mRNA表达水平升高。另外,本研究发现,Ⅰ~Ⅱ期PTC患者外周血TSHR mRNA表达水平明显低于Ⅲ~Ⅳ期患者(P﹤0.01),提示TSHR mRNA表达水平升高与PTC进展有关。
综上所述,外周血中TSHR mRNA表达水平升高与甲状腺病变有关,且与患者TNM分期和淋巴结转移情况有关。本研究中所选取的样本数量较少,且未同时研究其他TSHR相关生物标志物在PTC中的表达变化情况,在后续研究中需要进一步补充。
[1]He H,Li W,Liyanarachchi S,et al.Genetic predisposition to papillary thyroid carcinoma:involvement of FOXE1,TSHR,and a novel lincRNA gene,PTCSC2[J].J Clin Endocrinol Metab,2015,100(1):E164-172.
[2]Jemal A,Siegel R,Xu J,et al.Cancer Statistics,2010[J].CACancer J Clin,2010,63(5):277-300.
[3]Cox AE,LeBeau SO.Diagnosis and treatment of differentiated thyroid carcinoma[J].Radiol Clin North Am,2011,49(3):453-462.
[4]Sciuto R,Romano L,Rea S,et al.Natural history and clinical outcome of differentiated thyroid carcinoma:a retrospective analysis of 1503 patients treated at a single institution[J].Ann Oncol,2009,20(10):1728-1735.
[5]黄广英,禤文婷.促甲状腺激素受体在甲状腺癌中的表达及其临床意义[J].中国实用医药,2017,12(7):78-79.
[6]Tuncel M.Thyroid stimulating hormone receptor[J].Mol Imaging Radionucl Ther,2017,26(Suppl 1):87-91.
[7]Chinnappa P,Taguba L,Arciaga R,et al.Detection of thyrotropin-receptor messenger ribonucleic acid(mRNA)and thyroglobulin mRNA transcripts in peripheral blood of patients with thyroid disease:sensitive and specific markers for thyroid cancer[J].J Clin Endocrinol Metab,2004,89(8):3705-3709.
[8]王朝晖,李玉中,宋丽媛,等.TSHR和MMP-9在甲状腺乳头状癌组织中的表达及其临床意义[J].大连医科大学学报,2012,34(5):443-445.
[9]Ishikawa T,Miwa M,Uchida K.Quantitation of thyroid peroxidase mRNA in peripheral blood for early detection of thyroid papillary carcinoma[J].Thyroid,2006,16(5):435-442.
[10]Torosian L,Manrique G,Alvarez B,et al.Blood thyroglobulin and TSH receptor mRNA detection by RT-PCR in the follow-up of differentiated thyroid cancer patients[J].Rev Esp Med Nucl,2010,29(3):109-113.
[11]姜威,王朝晖,李玉中,等.血液TSHR-mRNA作为分子肿瘤标志物在甲状腺癌诊断中的应用[J].医学与哲学,2015,36(10):74-77.
[12]刘翔,高明.促甲状腺素抗氧化传导通路与甲状腺乳头状癌侵袭力的关系[J].中华耳鼻咽喉头颈外科杂志,2009,44(4):287-291.
[13]许少伟,杨熙鸿,刘木元,等.TSHR在甲状腺乳头状癌中的表达及其临床意义[J].实用癌症杂志,2017,32(2):196-199.
