ALDH1在膀胱癌组织中的表达及与临床特征的相关性分析
2018-05-03张钢林毅枢王强
张钢,林毅枢#,王强
1北京大学第三医院海淀院区(北京市海淀医院)泌尿外科,北京 100080
2解放军第三〇九医院泌尿外科,北京 100091
膀胱癌是泌尿系统上皮来源恶性肿瘤中发病率最高的疾病,流行病学研究显示膀胱癌的发病率可达223/10万~455/10万[1]。膀胱癌的发病机制较为复杂,包括遗传因素、基因突变或分子生物学水平的相关改变等。乙醛脱氢酶1(aldehyde dehydrogenase 1,ALDH1)为过氧化因子家族成员,其能够通过对膀胱移行上皮细胞的促进增殖及凋亡抑制作用,增加膀胱癌的发生风险,加剧膀胱腺癌或者透明细胞癌等的发生率[2]。已有的相关临床研究揭示了ALDH1在膀胱癌患者中的异常表达情况,认为高表达ALDH1是促进膀胱癌患者不良预后的重要因素[3-4],但缺乏对于ALDH1与膀胱癌患者临床病理特征的关系研究。为了进一步揭示ALDH1在促进膀胱癌发病过程中的作用,本研究收集手术后切除的膀胱癌组织标本100例,探讨了ALDH1的表达与膀胱癌患者临床分期、癌细胞分化程度等的关系,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2014年12月至2016年8月于北京市海淀医院进行手术治疗的100例膀胱癌患者的临床资料,收集患者手术后切除的膀胱癌标本100例。纳入标准:①膀胱癌的诊断标准参考中华医学会的标准;②组织标本来源于膀胱癌患者实施手术后的标本;③术前未接受放化疗、免疫治疗;④临床资料完整。排除标准:①临床资料缺失严重,无法进行统计学分析;②合并其他部位的肿瘤疾病;③复发性膀胱癌患者。膀胱癌患者中,男67例,女33例;年龄41~82岁,平均(65.1±11.7)岁;临床分期:Ta期 9例,Tis期 22例,T1期 18例,T2期 25例,T3期20例,T4期6例;病理学分级:Ⅰ级18例、Ⅱ级24例,Ⅲ级58例。选取相应的癌旁正常膀胱组织40例作为对照。
1.2 免疫组化染色方法
采用石蜡切片脱蜡至水,采用离子水进行反复洗涤,加入牛奶液体封闭抗体,封闭时间为5 min,加入ALDH1蛋白抗体(鼠来源,购自美国Abcam公司),37℃孵育2 h,采用磷酸盐缓溶冲液冲洗3次,滴加荧光染色标记的二抗抗体(购自美国Abcam公司),37℃孵育30 min,加入磷酸盐缓冲溶液冲洗5 min,连续冲洗3次,采用南京凯基生物制剂公司生产的显色剂进行显色,封片,镜下观察。
1.3 判定标准
免疫组化结果判定标准:ALDH1蛋白的阳性表达位于细胞浆,染色呈黄色、棕黄色、褐色。①根据细胞的染色强度评分:无色为0分,淡黄色为1分,棕黄色为2分,褐色、黑色为3分;②根据阳性细胞所占百分比评分:无阳性细胞为0分,阳性细胞数目所占比例≤10%为1分,阳性细胞数目所占比例占11%~50%为2分,阳性细胞数目所占比例占51%~75%为3分,阳性细胞数目所占比例﹥75%为4分。两种积分相乘,总分﹤3分为阴性(-),≥3分为阳性,其中3~5分为弱阳性(+),6~9分为阳性(++),﹥9分为强阳性(+++)。
1.4 统计学方法
采用SPSS 16.0软件对数据进行统计分析,计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料以率(%)表示,组间比较采用χ2检验。以P﹤0.05为差异有统计学意义。
2 结果
2.1 不同组织中ALDH1蛋白表达情况的比较
膀胱癌组织中ALDH1蛋白的阳性表达率为42.00%,明显高于癌旁正常膀胱组织的5.00%,差异有统计学意义(χ2=18.150,P﹤0.01)。(表1、图1)
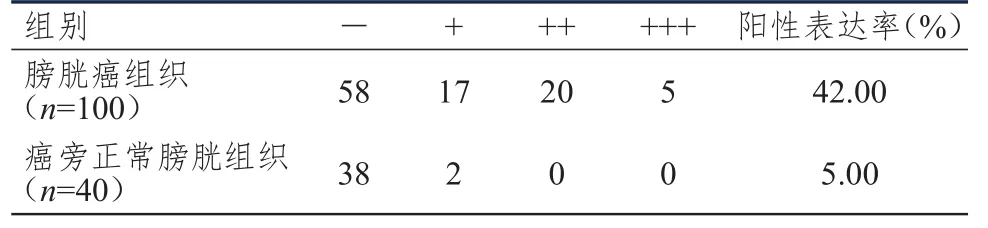
表1 不同组织中ALDH1蛋白的表达情况
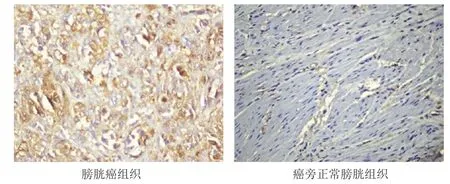
图1 不同组织中ALDH1蛋白的表达情况(免疫组化染色,×400)
2.2 膀胱癌组织中ALDH1蛋白的阳性表达率与膀胱癌患者临床病理特征的关系
有脉管浸润、有神经浸润、有淋巴结转移、T2~4期膀胱癌组织中ALDH1蛋白的阳性表达率均高于无脉管浸润、无神经浸润、无淋巴结转移、Ta~1期的膀胱癌组织,差异均有统计学意义(P﹤0.05)。(表2)
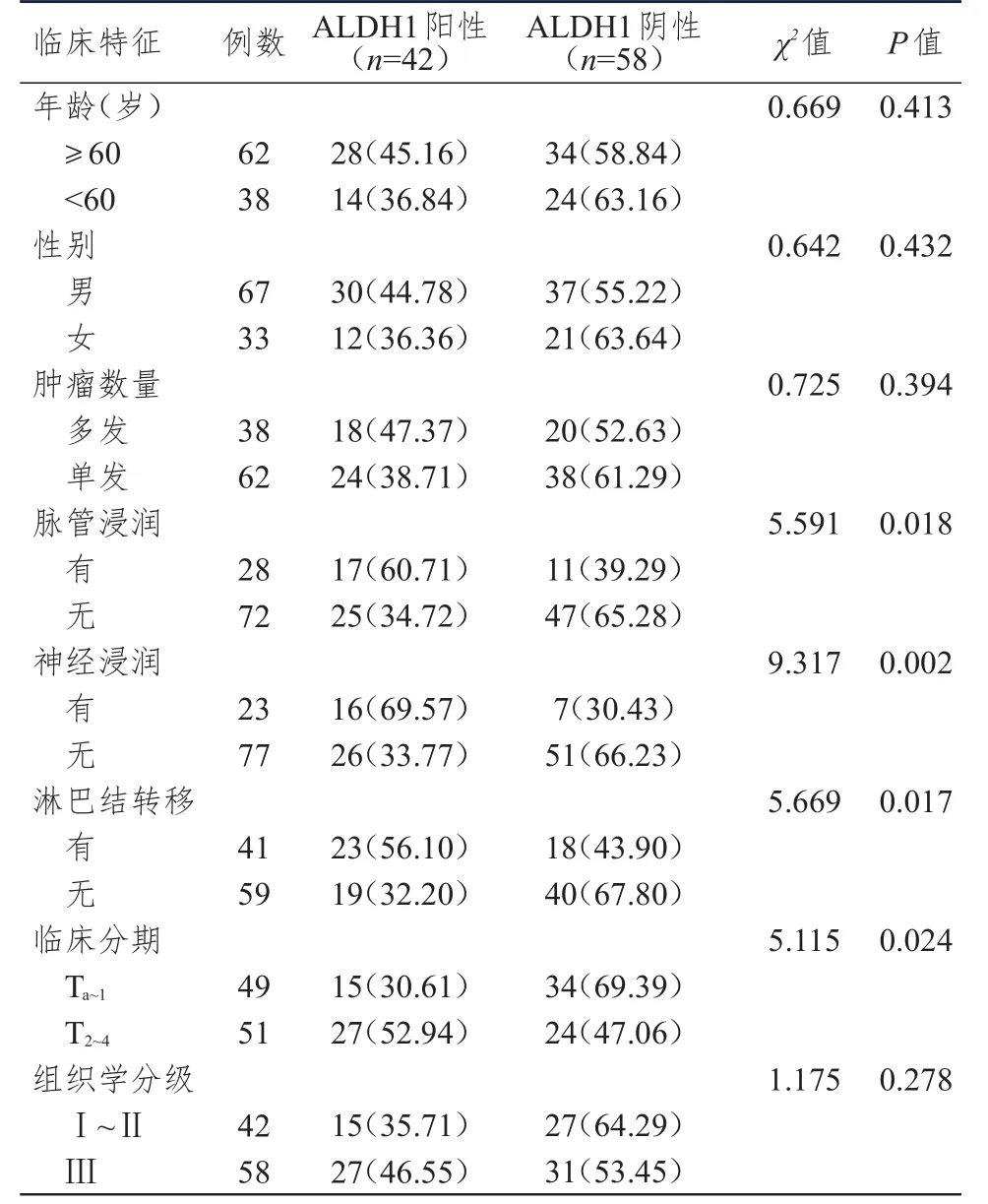
表2 ALDH1蛋白阳性表达率与膀胱癌患者临床特征的关系[n(%)]
3 讨论
目前临床上膀胱癌的总体治疗有效率不足25%[2],包括手术或者联合放化疗等综合性治疗措施的临床病情缓解率均较低。同时,对于膀胱癌的早期发病缺乏有效的筛查指标,虽然CA125等上皮肿瘤糖蛋白成分能够在一定程度上提高膀胱癌的诊断率,但其筛查的灵敏度或者特异度等的局限性仍然较为明显。本次对于分子生物学相关指标的研究,具有下列几个方面的显著意义:①能够为膀胱癌的分子诊断学提供新的研究方向;②能够为揭示膀胱癌的发病原因提供理论基础,并为后续临床药理学实验提供治疗靶点。
近年来,分子生物学水平的异常被认为是影响恶性肿瘤发生的核心因素,分子水平的表达调控异常增加了癌细胞过度扩增的风险,导致癌细胞的正常分化或者促凋亡过程明显失常[5-6]。ALDH1是核糖体修饰因子,其对于核糖体羧基末端的修饰作用能够提高染色体DNA的错配风险,并抑制基因错配修复因子cyc活性。ALDH1的高表达提高了癌细胞对于血管内皮或者淋巴管内皮的黏附能力,对于恶性肿瘤的进展具有一定的促进作用[7-8]。同时,ALDH1对于泌尿系统移行上皮细胞的细胞核增殖、细胞周期的调控或者癌细胞的变形能力等的影响,能够增加膀胱癌病灶组织对于邻近正常组织的浸润,促进膀胱癌临床分期的进展[9-10]。回顾国内外已有的相关研究,部分研究者在探讨ALDH1对恶性肿瘤发生的影响时发现,ALDH1能够促进卵巢癌或者甲状腺癌等恶性肿瘤的发病,但在膀胱癌中的研究并不充分。
本研究发现,在膀胱癌组织中,ALDH1蛋白的阳性表达率明显高于癌旁正常膀胱组织,差异有统计学意义(χ2=18.150,P﹤0.01),提示ALDH1蛋白的表达可能与膀胱癌的发生、发展有关,ALDH1蛋白的高表达能够通过以下几个方面促进恶性肿瘤的病情进展[11-13]:①ALDH1蛋白的高表达促进了癌细胞细胞周期中G1/S期的比例,导致癌细胞DNA扩增速度的改变;②ALDH1蛋白影响到了癌细胞分化凋亡抑制因子的表达,抑制了早期膀胱移行上皮细胞的分化成熟,导致癌细胞的凋亡减少。Masaoka等[14]研究者探讨了小样本量的中晚期膀胱癌患者的免疫组化资料,发现在膀胱癌病灶组织的中心部分可见明显的ALDH1蛋白阳性表达率的上升,且患者的远期生存预后越差,病程越长,ALDH1蛋白的阳性表达率越高。免疫组化染色分析可见,ALDH1蛋白的阳性表达主要定位于膀胱癌细胞核及细胞质内,且癌细胞的分化程度越低,癌细胞的异型性越明显,ALDH1蛋白的阳性表达率越高,但也发现部分癌细胞中ALDH1蛋白的阳性表达,提示其可能还影响到了癌细胞间信息的传递。在探讨ALDH1蛋白与膀胱癌患者临床病理特征的关系过程中发现,在发生了淋巴结转移的患者中,ALDH1蛋白的阳性表达率较高,这主要考虑与ALDH1蛋白对于淋巴结内皮细胞黏附分子的激活,或者对于分化转录调控因子的影响有关。同时,在有脉管浸润、有神经浸润或者临床分期较晚的膀胱癌患者中,ALDH1蛋白的阳性表达率同样较高,这提示ALDH1对于神经元或者组织间质成分中的引流管等均具有一定的亲和力,而其对于临床分期的影响可能与其对于膀胱邻近综上所述,正常组织器官的浸润有关。
本研究的创新性在于探讨了ALDH1蛋白与膀胱癌患者神经浸润或者脉管浸润的关系。ALDH1蛋白在膀胱癌组织中呈高表达,且与膀胱癌患者的脉管浸润、神经浸润、淋巴结转移情况、临床分期有关,其可能在膀胱癌的发生、发展过程中起重要作用。
[1]Mitin T,Shipley WU,Efstathiou JA,et al.Trimodality therapy for bladder conservation in treatment of invasive bladder cancer[J].Curr Urol Rep,2013,14(2):109-115.
[2]曹明丽,王淼,宋丰举.天津市河西区膀胱癌流行现状和趋势分析[J].中华肿瘤防治杂志,2016,23(17):1138-1140;1148.
[3]王卉,李成柏,蒋光亮,等.非肌层浸润性膀胱癌免疫治疗研究进展及机制探讨[J].现代泌尿外科杂志,2017,22(5):392-395.
[4]邹宝嘉,陈明坤,叶云林,等.高危非肌层浸润性膀胱癌的临床病理特点分析:10年经验总结[J].新医学,2015,46(6):378-382.
[5]马重,林建水,曾蜀雄,等.膀胱癌无创性早期诊断标志物的研究进展[J].上海医学,2015,38(4):347-350.
[6]徐宾,张天禹.膀胱癌相关肿瘤标志物的研究进展[J].华夏医学,2015,28(2):106-110.
[7]许宁,邵明明,金美善,等.肿瘤干细胞标记蛋白ALDH1在浸润性膀胱癌组织中的表达及其与临床病理和预后的关系[J].吉林大学学报(医学版),2014,40(4):828-832.
[8]李庆,王莉,杨树才,等.肿瘤淋巴管入侵与无淋巴结转移膀胱癌复发及预后的相关性分析[J].现代生物医学进展,2015,15(5):854-857.
[9]曹敬毅,王淇超,王乾,等.肌层浸润性膀胱癌髂内动脉化疗的临床疗效[J].江苏医药,2015,41(11):1267-1269.
[10]郭伟宣.膀胱癌40例临床病理分析[J].中国民族民间医药,2015,24(11):95-97.
[11]Huang YC,Yu HS,Chai CY.Aldehyde dehydrogenase induction in arsenic-exposed rat bladder epithelium[J].Exp Toxicol Pathol,2016,68(1):b61-68.
[12]Orywal K,Jelski W,Werel T,et al.The activity of class I,II,III and IV alcohol dehydrogenase isoenzymes and aldehyde dehydrogenase in the sera of bladder cancer patients[J].Acta Biochim Pol,2017,64(1):81-84.
[13]Xu N,Shao MM,Zhang HT,et al.Aldehyde dehydrogenase 1(ALDH1)expression is associated with a poor prognosis of bladder cancer[J].Cancer Epidemiol,2015,39(3):375-381.
[14]Masaoka H,Ito H,Soga N,et al.Aldehyde dehydrogenase 2(ALDH2)and alcohol dehydrogenase 1B(ADH1B)polymorphisms exacerbate bladder cancer risk associated with alcohol drinking:gene-environment interaction[J].Carcinogenesis,2016,37(6):583-588.
