pH调控对瘤胃液接种稻秸厌氧消化中水解菌及产甲烷菌的影响
2018-05-02邓玉营阮文权黄一波
邓玉营,阮文权,郁 莉,黄一波
(1.常州工程职业技术学院,江苏 常州 213164;2.江南大学环境与土木工程学院,江苏 无锡 214122)
秸秆是农业有机废弃物的主要来源,受技术的制约,现阶段综合利用效率不高。厌氧消化被认为是秸秆资源化的重要途径,秸秆的半纤维素、纤维素等成分被用于产生沼气,而且可以获得沼渣沼液肥,综合效益显著。但秸秆复杂的结构导致其较难水解,是厌氧消化的主要限速过程[1]。瘤胃微生物被认为是高效的秸秆纤维素降解者,其中瘤胃球菌属(Ruminococcus)、产琥珀酸丝状杆菌(Fibrobacter succinogenes)等水解菌发挥了重要作用[2-3],常用于瘤胃接种秸秆的厌氧消化[4-6]。
瘤胃微生物群落中仅含有少量的嗜氢型产甲烷菌[7],挥发性脂肪酸(VFAs)主要通过瘤胃上皮细胞吸收。但在厌氧消化中水解产生的VFAs易造成积累,导致pH值下降,水解活性受到抑制[4-5]。研究表明,pH值会形成不同的生态位,为微生物提供最适的生长环境。如水解菌最适pH值范围在5.3~8.3之间[8];甲烷菌的最适pH值生态幅度比水解菌要窄,在6.5~8.2之间[9],低于6.2会对甲烷菌产生毒害作用[1]。因此调控pH值在适宜的范围内有利于水解和产甲烷活性的提高,如Yang等[10]研究表明,高固态餐厨垃圾厌氧消化中提高pH值可强化水解酶和产甲烷活性。在以往的研究中尝试了瘤胃接种体系投加甲烷菌来减少VFAs积累[6];但在厌氧消化体系通过调控pH改变功能菌群结构和丰度,以提高秸秆转化效率的研究鲜有相关报道。
研究表明,秸秆降解体系常利用16S rDNA来分析菌群变化[11],但功能基因的检测更具应用价值[3,12-13]。研究者将糖苷酶和酯酶按照活性中心氨基酸序列的差异划分为不同的水解酶(GH)家族,从Cazy数据库中收录的情况来看,GH 5、GH 9、GH 45和 GH 48包含了大多数厌氧纤维素酶。瘤胃的纤维素水解菌(如Bacteroides、Clostridium、Ruminococcus和 Fibrobacter)含有GH 5基因[3,13],能用于水解菌的分析检测。甲烷菌中甲基辅酶M转移酶(mcrA)是产甲烷途径中从甲基四氢甲烷蝶呤到甲基辅酶M的关键酶,基因数量的变化可以用于表征产甲烷活性高低[14]。
为此,本研究通过添加缓冲液来调控pH值,为功能菌群提供适宜的生长环境,减少中间代谢产物的抑制,强化稻秸降解以及产甲烷活性。通过MiSeq高通量测序进行菌群丰度分析;采用相对定量PCR(QPCR)检测GH 5和mcrA基因来分析水解菌及产甲烷菌的变化,从而探索pH调控对功能菌群及厌氧消化特性的影响。
1 材料与方法
1.1 实验原料
从无锡某屠宰场收集成年黄牛的瘤胃消化物,通过两层纱布过滤掉未消化的草料获得瘤胃液接种物,其总固体含量(TS)和挥发性固体含量(VS)分别为2.28%和1.32%,初始pH值为6.81,碳氮比为12.48,储存在4℃冰箱中并在3 h内完成实验。稻秸从江苏徐州地区稻田收割后购得,50℃烘箱中干燥,使用粉碎机(湖南中诚制药机械厂,中国)粉碎过40目筛后,储存在密封袋中备用,其TS、VS及碳氮比分别为93.74%、84.62%和43.15。
1.2 实验装置
实验在2 L有效容积的机械搅拌装置中进行,操作原理如图1所示。瘤胃液接种物使用去离子水稀释5倍后补入反应体系中。使用NaHCO(35.00 g·L-1)及K2HPO4·3H2O(1.34 g·L-1)、KH2PO(40.51 g·L-1)组成双效缓冲液,调整pH值为6.8~7.1。整个厌氧消化在(39±1)℃和 60 r·min-1条件下运行。包括三个阶段,每个阶段运行 16 d,有机负荷分别为 1.5、3.5 g·L-1·d-1和 7 g·L-·1d-1。每 4 d 添加稻秸前,排出沼渣沼液;调控体系中用上述缓冲液补充沼液,对照处理则使用去离子水补充。通过铝塑袋收集气体并进行各组分含量分析,将量筒口浸入水中,通过排出水的量来测定沼气体积。每个阶段收集样品提取DNA,用于相对QPCR分析,瘤胃接种物和消化结束时样品同时进行高通量测序。
1.3 测定方法
1.3.1 理化指标
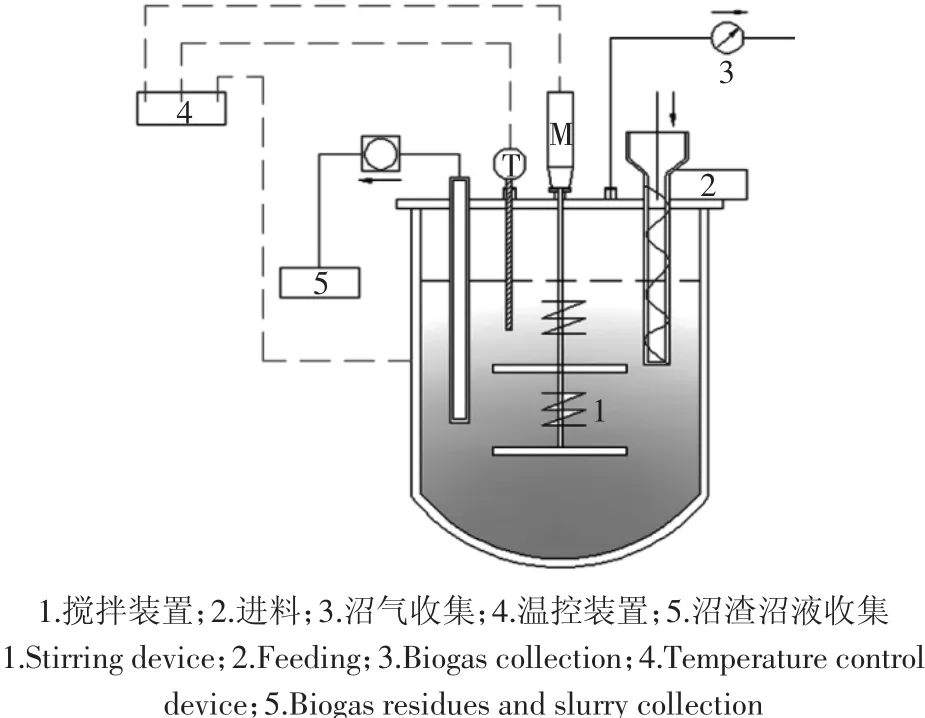
图1 半连续反应装置示意图Figure 1 Schematic diagram of the semi-continuous reactor
收集的沼液通过两层纱布过滤后,滤液在12 000 r·min-1离心 10 min,上清液用于 pH、VFAs和酶活性测定。pH用DELTA 320 pH计(梅特勒-托利多仪器,美国)测定。VFAs使用GC-2010 Plus气相色谱(岛津,日本)分析,进样器和检测器程序设定参考Liu等[15]的方法。水解酶通过滤纸酶(FPase)和羧甲基纤维素酶(CMCase)来表征,参考以前的方法测定[6]。1个酶活力单位定义为每毫升每分钟上清液释放1 μg葡萄糖的酶量。气体成分使用GC-2014气相色谱(岛津,日本)分析。
1.3.2 相对Q-PCR
分别利用总细菌通用性基因[14]、GH 5水解家族基因[12]及甲烷菌mcrA基因[14]的引物对进行相对QPCR实验,使用SYBRPremixExTaqTMⅡ试剂(RR820A,大连宝生物,中国)构建PCR体系,引物终浓度为0.2 μmol·L-1、DNA 模板为 20ng。每个反应重复3 次,程序按Step One PCR仪操作说明自动采集荧光[12,14],得到目标基因的阈值(CT)。将总菌通用基因设为内标基因,定量分析GH 5水解微生物以及甲烷菌相对于起始接种物的变化。每个阶段样品与接种物的变化量利用 2-ΔΔCT法确定,ΔΔCT值为每个阶段目标菌的 CT值和总菌CT值的差值与接种物中两个CT值相减的结果。按照定义最初接种物的2-ΔΔCT设定为1,目标菌的变化量用增长或减少的倍数来表示[16]。
1.3.3 菌群丰度分析
引物对515F和806R对16S的V4区进行扩增,利用MiSeq(Illumina公司,美国)技术进行测序,原始序列参考以前的方法分析[6],经拼接后加工处理,按照97%相似度进行聚类分析,物种注释及菌群组成变化用相对丰度表示。原始序列提交到NCBI中的SRA,序列号为SRP123714。
1.4 数据处理
通过SPSS 19.0中的单因素方差(ANOVA)单元进行差异显著性分析,阈值水平设为0.05。使用O-riginPro 8.5软件绘图。
2 结果与讨论
2.1 厌氧消化特性
2.1.1 产沼气和甲烷变化
如图2所示,调控体系中的沼气产率在83.33~343.33 mL·L-1·d-1范围内变动。沼气产率逐渐增加,在40 d时达到最大值,随后产率有所下降。对照体系中甲烷含量变化范围为16%~27%,呈下降趋势;调控体系的甲烷含量在24%~32%之间变动,提高显著(P<0.05)。经计算三个阶段的甲烷产率均值分别达到了36.87、58.00 mL·L-1·d-1和 79.24 mL·L-1·d-1,和对照体系相比均显著提高(P<0.05),分别提高了1.98、1.99倍和1.53倍(表1)。
在接种瘤胃厌氧消化实验中发现,甲烷的含量不超过19.6%[4-5],和本研究对照体系所得结论一致。主要是因为瘤胃接种物中缺少产甲烷菌,造成秸秆降解产生的VFAs积累,并导致pH值下降,抑制产甲烷菌活性[5]。而调控体系保证了最适的pH值范围,有利于甲烷菌活性的提高。如Yang等[10]在高固态餐厨垃圾厌氧消化研究中,调控pH值为8,提高了水解酶(如淀粉酶和蛋白酶)的活性,并激活了嗜氢型产甲烷菌中的辅酶F420,使甲烷产率和含量分别达到了171.0 mL·g-1TS 和 53.1%。Deng 等[6]在秸秆厌氧消化中,通过甲烷菌强化使pH值在6.91以上,有效减少了VFAs积累,使甲烷产率明显提高。
2.1.2 体系中pH值和VFAs浓度的变化
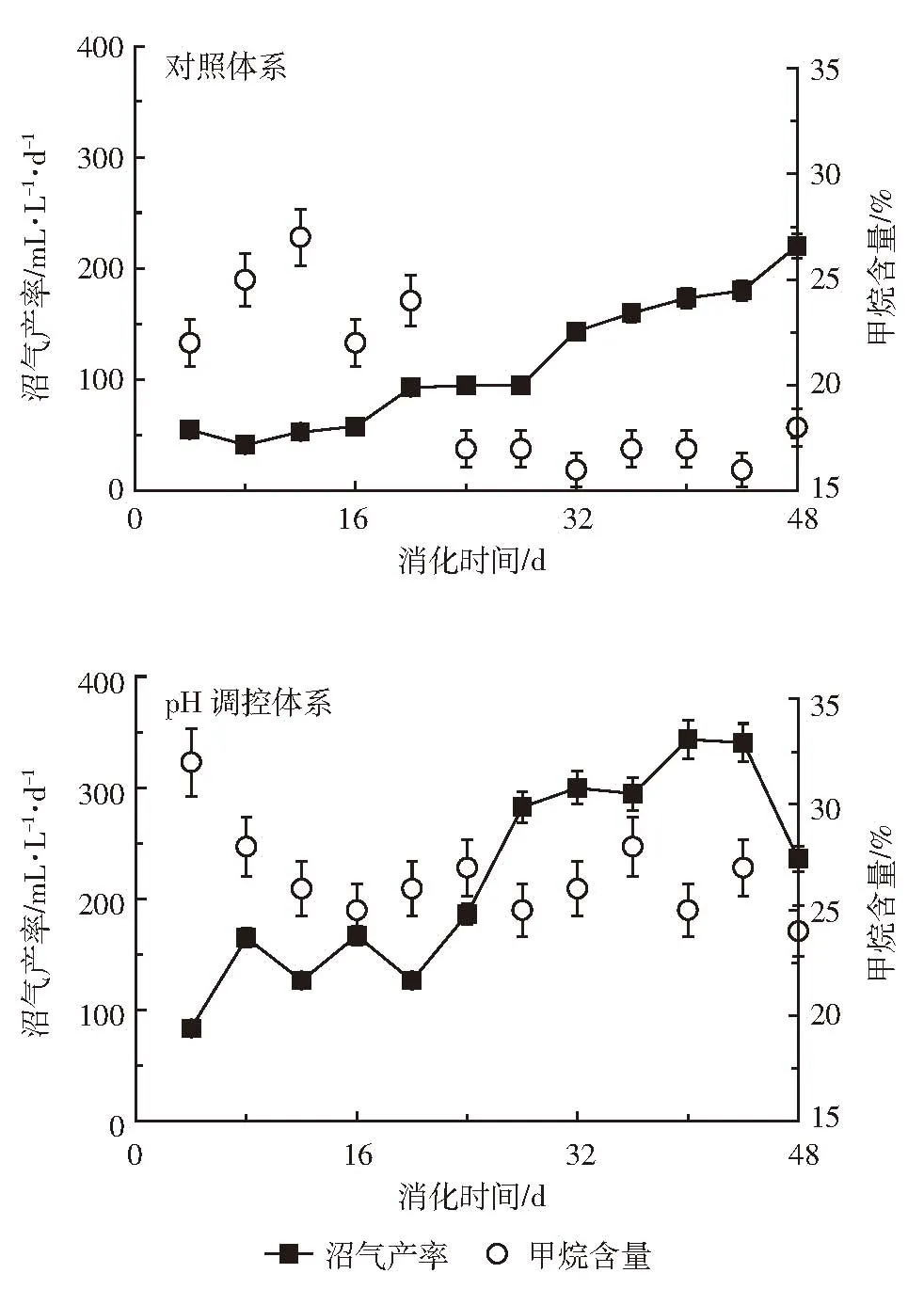
图2 厌氧消化过程中沼气产率和甲烷含量的变化Figure 2 The biogas production rates and methane contents during anaerobic digestion

表1 三个阶段消化参数(沼气和甲烷产率、VFAs总浓度及pH值)的变化Table 1 The digestion parameters of the biogas and methane yields,total VFAs concentrations and pH values during the three stages
VFAs作为厌氧消化中间产物,能够表征过程中产酸和产甲烷之间的动态平衡。对照体系三个阶段VFAs总浓度分别为 3.89、2.82 g·L-1和 4.63 g·L-1;而调控体系 VFAs浓度分别达到了 2.97、2.86 g·L-1和5.52 g·L-1,差异不显著(表 1)。VFAs浓度的变化如图3所示,乙酸和丙酸是主要组分,浓度分别在1.32~3.08 g·L-1和 1.12~1.76 g·L-1之间变动,两者比例先减少后逐渐增大。相比之下,对照体系中乙酸和丙酸浓度分别在 1.37~2.91 g·L-1和 1.15~1.72 g·L-1之间,而丁酸在第一和第三阶段均有积累,均值分别为0.70 g·L-1和 0.99 g·L-1。如表 1 所示,受到 VFAs积累的影响,对照体系pH值降至6.08~7.01之间;而调控体系在三个阶段均显著提高(P<0.05),pH 值在 6.24~7.77之间变动,均值达到了7.14,处于最适产甲烷范围内[9]。
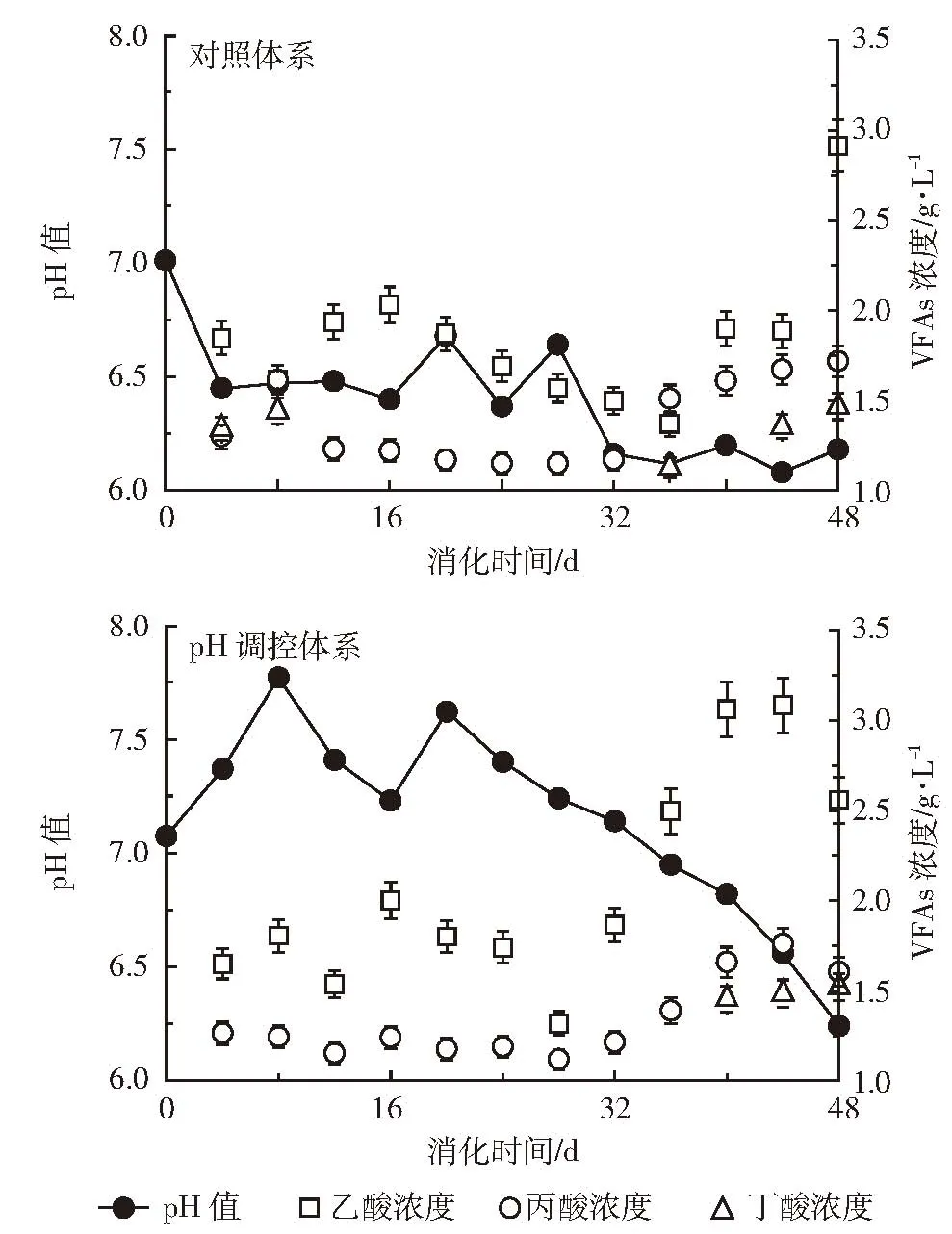
图3 消化过程中pH值和单个VFA浓度的变化Figure 3 The changes of pH values and individual VFA during the anaerobic digestion
当有机负荷提高为 7 g·L-1·d-1,调控体系中单个VFAs的积累造成pH值下降,最低达到了6.24。根据Lerm等[17]的研究,随着有机负荷升高,代谢产生的氢和还原力NADH来不及被甲烷菌利用时会产生丙酸(或丁酸),这是厌氧消化受抑制的重要标志;而乙酸经过短暂积累后可以被甲烷菌所利用。本研究中调控使pH值在适宜的范围内,乙酸和丙酸之间比例逐渐升高,有利于产甲烷代谢。如Deng等[6]在稻秸瘤胃接种体系中同样发现,乙酸能被用于产甲烷,其浓度和甲烷产率呈正比。而另一个稻秸厌氧消化研究表明,瘤胃液预处理超过48 h后,丙酸的积累是造成甲烷产率下降的主要原因[5]。
2.1.3 秸秆纤维素水解活性
CMCase和FPase常被用于衡量纤维素水解酶活的变化,三个阶段的变化如图4所示。调控体系中CMCase 酶活分别在 0.24~0.72、0.87~1.10 U·mL-1和1.37~2.23 U·mL-1范围内变动。FPase酶活变化范围为0.19~0.35、0.54~0.98U·mL-1和 0.61~0.98U·mL-1,呈增长趋势。CMCase和FPase酶活都比对照样品显著提高(P<0.05),这也体现出调控体系的水解优势。首先,pH值高低影响纤维素水解,如Romsaiyud等[8]发现低pH值会对纤维素水解菌产生离子毒性,抑制水解酶的产生;而Hu等[4]在接种瘤胃研究中表明,通过提高pH值能增加纤维素降解的效率。其次,纤维素的降解需要各类微生物协同作用[6],调控体系为甲烷菌提供了适宜的pH值,加快了功能菌群种间氢传递,水解和产甲烷活性都能得到明显提高。
2.2 菌群相对丰度的变化
利用MiSeq测序分析了接种物和消化结束时样品中菌群相对丰度的变化,包括细菌和甲烷菌两类。如图5a所示,细菌中拟杆菌目(Bacteroidales)和梭菌目(Clostridiales)相对丰度较高,而伯克氏菌目(Burkholderiales)和芽胞杆菌目(Bacillales)厌氧消化结束后消失。互营菌目(Synergistales)常与甲烷菌形成互营氧化菌群[18],相对丰度升高表明了调控体系中协同作用的增强。
在调控体系中,发酵产酸微生物Bacteroidales的相对丰度从29.73%下降到23.31%[11],但在对照体系中则升高为37.37%。Clostridiales相对丰度从13.29%升高到60.48%,研究发现该目是秸秆及纤维素底物重要的水解菌[13],如梭状芽孢杆菌属(Clostridium)和Ruminococcus[2-3]。Clostridium是秸秆纤维素的主要降解者[19];Ruminococcus在瘤胃内纤维素降解中发挥重要作用,但在人工反应器中很少被检测到。而本研究调控体系中尽管Clostridium相对丰度为21.18%,但是Ruminococcus的含量提高了12.47倍,而来源瘤胃的另一种水解菌Fibrobacter则从体系中消失(图5b)。

图4 厌氧消化过程中羧甲基纤维素酶和滤纸酶活性的变化Figure 4 The changes of the CMCase and FPase activities during anaerobic digestion
瘤胃中甲烷菌类型主要以嗜氢型甲烷短杆菌属(Methanobrevibacter)为主[3,7]。如图 5c 所示,本研究接种物中Methanobrevibacter丰度达到了0.87%。厌氧消化结束后,在调控体系中Methanobrevibacter相对丰度升高到了3.73%,而甲烷八叠球菌属(Methanosarcina)的相对丰度为0.07%。在对照体系中,Methanobrevibacter比例降低,无Methanosarcina存在。Methanosarcina能够利用体系中产生的乙酸,在秸秆水解体系中发挥重要作用[6,10]。产甲烷菌群的变化表明,pH调控体系不仅提高了嗜氢型Methanobrevibacter比例,也增加了嗜乙酸型甲烷菌相对丰度,对产甲烷活性的提高起到了关键作用。

图5 厌氧消化后菌群相对丰度的变化Figure 5 Changes of relative abundances on the microbial communities after anaerobic digestion
2.3 GH 5水解和甲烷菌的变化
GH 5 水解菌群在厌氧体系中分布广泛[3,12-13],Sun等[13]发现,GH 5基因含量的变化能用于研究秸秆或纤维素降解的效率。如图6a所示,本研究利用GH 5基因表征纤维素水解菌,调控体系的变化趋势为先降低后升高,最后趋于稳定,厌氧消化结束时比接种时提高了1.65倍。水解菌开始阶段的减少可以用Russell等[2]的研究结论来解释,瘤胃微生物离开生境后,环境条件的改变使部分水解菌无法适应而从人工装置中消失。对照体系中的水解菌数量整个过程变化不大。甲烷菌的变化如图6b所示,和瘤胃接种物相比,pH调控使甲烷菌先降低后升高,最后增加了0.57倍;而对照中甲烷菌明显减少。甲烷菌数量的变化也解释了不同反应装置中沼气产率和甲烷含量的差异。
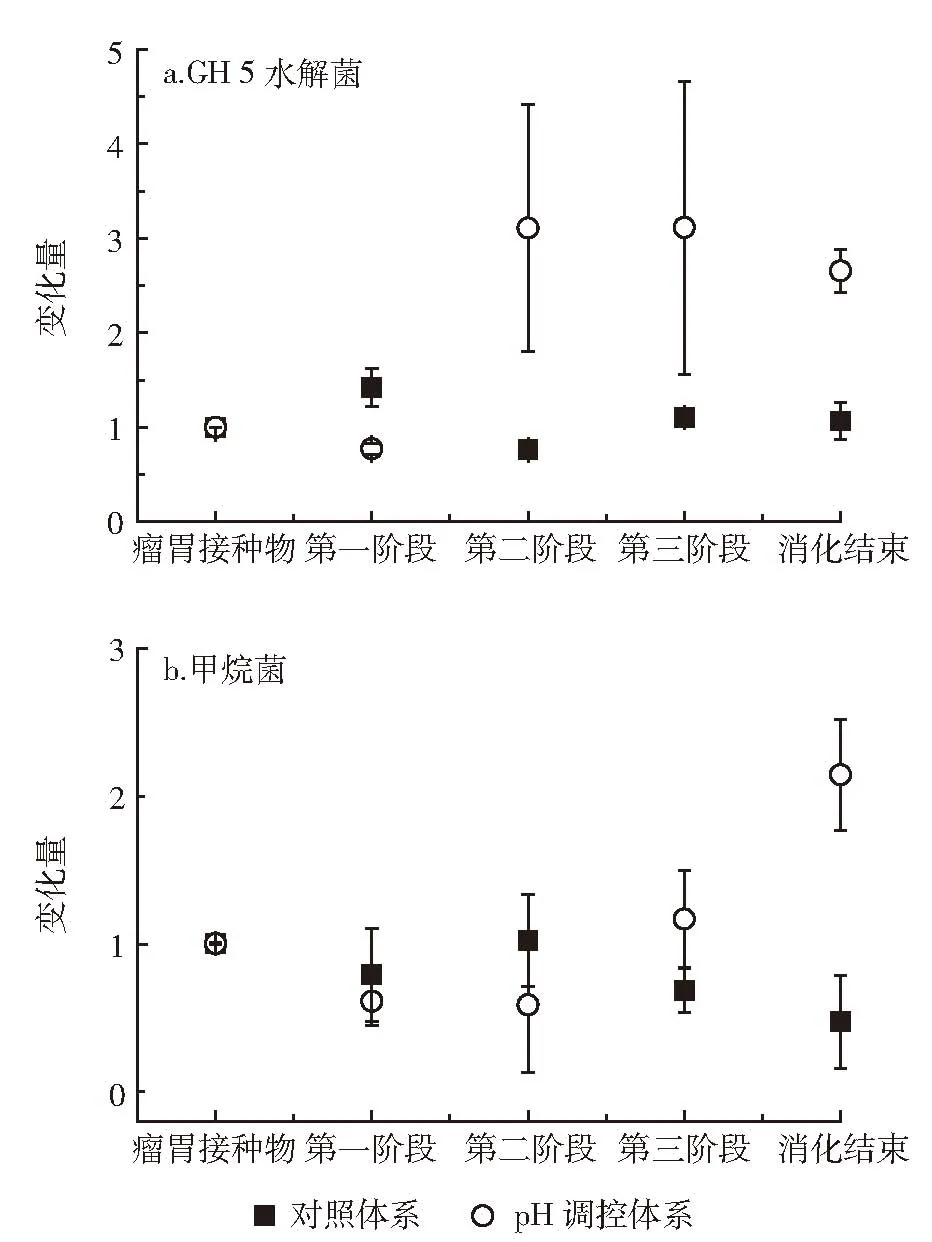
图6 功能菌群的变化特征Figure 6 The change characteristics of the function consortia
瘤胃中水解菌和嗜氢型甲烷菌存在种间氢传递。白色瘤胃球菌(Ruminococcus albus)通过糖酵解中丙酮酸氧化途径获得NADH用于产H2,H2被利用得到乙醇。但当H2被利用产甲烷后,实现了NAD+的再生,产乙酸成为主要代谢类型[20]。如Ruminococcus albus 7降解微晶纤维素时,加入Methanobrevibacter smithii PS后,产甲烷效率提高[21]。黄化瘤胃球菌(Ruminococcus flavefaciens)产生的还原型辅酶NADH既能用于产琥珀酸又能用于产H2,通过种间氢传递给甲烷菌后,产氢产乙酸途径得到强化。如添加Methanobacterium ruminantium PS到R.flavefaciens C94降解纤维素体系中,使产生的乙酸与琥珀酸比例提高了15倍[22]。Piao等[23]同样发现了Methanobrevibacter在牛瘤胃的柳枝稷消化中发挥了重要作用,增强了降解效果。研究还表明,甲烷菌活性受到抑制,会影响到功能菌群的活性,使水解菌含量下降。如Lazuka等[24]在小麦秸厌氧消化研究中,添加溴乙基磺酸钠(BES)抑制甲烷菌后,来源于瘤胃的Ruminococcus从体系中消失。本研究pH调控提高了甲烷菌的活性,Methanobrevibacter含量升高,可以与瘤胃水解菌Ruminococcus形成功能菌群,加快了种间氢传递,从而使水解和产甲烷活性都得到了提高。
秸秆厌氧消化研究发现,可以通过强化嗜乙酸型产甲烷途径来降低VFAs积累现象。如Wang等[25]在青贮牧草降解中,发现纤维素降解产生的乙酸刺激了Methanosarcina在固渣表面的生长,从而加快了底物的降解。Miller等[21]利用瘤胃水解菌Ruminococcus albus和Methanobrevibacter降解微晶纤维素时,再投入嗜乙酸型Methanosarcina barkeri,乙酸利用率提高到88%,强化了甲烷产率;而没有与甲烷菌共消化时,易造成VFAs积累。在稻秸厌氧消化中,Deng等[6]尝试通过瘤胃液和活性污泥共接种稻秸厌氧消化策略,发现来源于污泥的甲烷菌有利于乙酸产甲烷代谢。并且发现在稻秸干式发酵中,甲烷菌菌群结构和数量的变化会影响产甲烷效率[26]。本研究中Methanosarcina相对丰度仅为0.07%,易造成乙酸的短暂积累。因此,在pH调控强化瘤胃液接种秸秆厌氧消化中,需要提高嗜乙酸甲烷菌的含量,来解除发酵产物中VFAs的积累,进一步增强产甲烷效率。
3 结论
(1)与对照相比,pH调控使甲烷产率分别提高了1.98、1.99倍和1.53倍,甲烷含量在24%~32%之间变动。VFAs浓度中乙酸和丙酸分别在1.32~3.08 g·L-1和1.12~1.76 g·L-1之间变动,比值逐渐增大;pH 值维持在6.24~7.77之间。
(2)调控体系秸秆纤维素水解活性提高,CMCase和FPase酶活呈增加趋势,分别在0.24~2.23 U·mL-1和 0.19~0.98 U·mL-1之间变动。
(3)微生物菌群分析表明,调控体系中Bacteroidales和Clostridiales目成为优势菌群;来源于瘤胃的Burkholderiales和Bacillales目从体系中消失。Clostridiales的Clostridium仍是优势菌属(21.18%),但Ruminococcus的比例提高了12.47倍,Fibrobacter从体系中消失。
(4)调控体系中嗜氢型 Methanobrevibacter相对丰度从 0.87%提高到3.73%,成为优势菌属;嗜乙酸型Methanosarcina相对丰度增加至0.07%。
(5)功能菌群相对Q-PCR分析表明,pH调控使GH 5水解菌群提高了1.65倍,甲烷菌提高了0.57倍。
参考文献:
[1]Chandra R,Takeuchi H,Hasegawa T.Methane production from lignocellulosic agricultural crop wastes:A review in context to second generation of biofuel production[J].Renewable&Sustainable Energy Reviews,2012,16(3):1462-1476.
[2]Russell J B,Muck R E,Weimer P J.Quantitative analysis of cellulose degradation and growth of cellulolytic bacteria in the rumen[J].FEMS Microbiology Ecology,2009,67(2):183-197.
[3]Dai X,Tian Y,Li J T,et al.Metatranscriptomic analyses of plant cell wall polysaccharide degradation by microorganisms in the cow rumen[J].Applied and Environmental Microbiology,2015,81(4):1375-1386.
[4]Hu Z H,Yu H Q,Zhu R F.Influence of particle size and pH on anaerobic degradation of cellulose by ruminal microbes[J].International Biodeterioration&Biodegradation,2005,55(3):233-238.
[5]Zhang H B,Zhang P Y,Ye J,et al.Improvement of methane production from rice straw with rumen fluid pretreatment:A feasibility study[J].International Biodeterioration&Biodegradation,2016,113:9-16.
[6]Deng Y Y,Huang Z X,Zhao M X,et al.Effects of co-inoculating rice straw with ruminal microbiota and anaerobic sludge:Digestion performance and spatial distribution of microbial communities[J].Applied Microbiology&Biotechnology,2017,101(14):5937-5948.
[7]Janssen P H,Kirs M.Structure of the archaeal community of the rumen[J].Applied&Environmental Microbiology,2008,74(12):3619-3625.[8]Romsaiyud A,Songkasiri W,Nopharatana A,et al.Combination effect of pH and acetate on enzymatic cellulose hydrolysis[J].Journal of Environmental Sciences,2009,21(7):965-970.
[9]Chen Y,Cheng J J,Creamer K S.Inhibition of anaerobic digestion process:A review[J].Bioresource Technology,2008,99(10):4044-4064.
[10]Yang L L,Huang Y,Zhao M X,et al.Enhancing biogas generation performance from food wastes by high-solids thermophilic anaerobic digestion:Effect of pH adjustment[J].International Biodeterioration&Biodegradation,2015,105:153-159.
[11]Li T,Mazéas L,Sghir A,et al.Insights into networks of functional microbes catalysing methanization of cellulose under mesophilic conditions[J].Environmental Microbiology,2009,11(4):889-904.
[12]Pereyra L,Hiibel S,Riquelme M,et al.Detection and quantification of functional genes of cellulose-degrading,fermentative,and sulfate-reducing bacteria and methanogenic archaea[J].Applied&Environmental Microbiology,2010,76(7):2192-2202.
[13]Sun L,Liu T,Müller B,et al.The microbial community structure in industrial biogas plants influences the degradation rate of straw and cellulose in batch tests[J].Biotechnology for Biofuels,2016,9(1):128.
[14]Denman S E,Tomkins N,McSweeney C S.Quantitation and diversity analysis of ruminal methanogenic populations in response to the antimethanogenic compound bromochloromethane[J].FEMS Microbiology Ecology,2007,62(3):313-322.
[15]Liu X L,Liu H,Chen Y Y,et al.Effects of organic matter and initial carbon-nitrogen ratio on the bioconversion of volatile fatty acids from sewage sludge[J].Journal of Chemical Technology and Biotechnology,2008,83(7):1049-1055.
[16]Livak K J,Schmittgen T D.Analysis of relative gene expression data using Real-Time quantitative PCR and the 2-ΔΔCTmethod[J].Methods,2001,25(4):402-408.
[17]Lerm S,Kleyböcker A,Miethling-Graff R,et al.Archaeal community composition affects the function of anaerobic co-digesters in response to organic overload[J].Waste Management,2012,32(3):389-399.
[18]Vartoukian S R,Palmer R M,Wade W G.The division"Synergistes"[J].Anaerobe,2007,13(3):99-106.
[19]Azman S,Khadem A F,Lier J B V,et al.Presence and role of anaerobic hydrolytic microbes in conversion of lignocellulosic biomass for biogas production[J].Critical Reviews in Environmental Science&Technology,2015,42(1):29-39.
[20]Rychlik J L,May T.The effect of a methanogen,Methanobrevibacter smithii,on the growth rate,organic acid production,and specific ATP activity of three predominant ruminal cellulolytic bacteria[J].Current Microbiology,2000,40(3):176-180.
[21]Miller T,Currenti E,Wolin M.Anaerobic bioconversion of cellulose by Ruminococcus albus,Methanobrevibacter smithii,and Methanosarcina barkeri[J].Applied Microbiology and Biotechnology,2000,54(4):494-498.
[22]Latham M,Wolin M.Fermentation of cellulose by Ruminococcus flavefaciens in the presence and absence of Methanobacterium ruminantium[J].Applied and Environmental Microbiology,1977,34(3):297-301.
[23]Piao H,Lachman M,Malfatti S,et al.Temporal dynamics of fibrolytic and methanogenic rumen microorganisms during in situ incubation of switchgrass determined by 16S rRNA gene profiling[J].Frontiers in Microbiology,2014,5:307.
[24]Lazuka A,Auer L,Bozonnet S,et al.Efficient anaerobic transformation of raw wheat straw by a robust cow rumen-derived microbial consortium[J].Bioresource Technology,2015,196:241-249.
[25]Wang H,Vuorela M,Keränen A L,et al.Development of microbial populations in the anaerobic hydrolysis of grass silage for methane production[J].FEMS Microbiology Ecology,2010,72(3):496-506.
[26]邓玉营,阮文权,黄振兴,等.基于卧式厌氧装置的稻秸高固态消化与甲烷菌变化研究[J].农业机械学报,2017,48(7):272-279.DENG Yu-ying,RUAN Wen-quan,HUANG Zhen-xing,et al.High solid-state digestion of rice straw and changes of methanogens in horizontal anaerobic reactor[J].Transactions of the Chinese Society for A-gricultural Machinery,2017,48(7):272-279.
