铅胁迫对金丝草AsA-GSH循环及铅积累的影响
2018-05-02陈顺钰赵雅曼侯晓龙蔡丽平刘爱琴周垂帆
韩 航 ,陈顺钰 ,赵雅曼 ,侯晓龙 ,2,3*,蔡丽平 ,3,刘爱琴 ,3,周垂帆 ,3
(1.福建农林大学林学院,福州 350002;2.福建农林大学资源与环境学院,福州 350002;3.海峡两岸红壤区水土保持协同创新中心,福州 350002)
“三废”排放、工矿业活动等导致的土壤重金属污染日趋严重,已成为生态文明和农业可持续发展的重大威胁[1-2]。铅(Pb)是植物非必需元素,较低含量 Pb就会对植物生长和生理代谢过程等产生明显毒害作用,降低作物质量和产量。Pb可通过食物链进入人体,对人体血液、神经系统等造成不可逆伤害[3]。自1977年Brooks等[4]提出重金属超积累植物概念以来,绿色经济、操作性强的植物修复技术逐渐受到重视,提高植物修复效率与应用能力成为研究热点[5]。
植物对重金属Pb的抗性主要由对Pb的避性、耐性组成[6]。其中,植物抗氧化系统中抗坏血酸-谷胱甘肽(Ascorbate-glutathione,AsA-GSH)循环响应和Pb累积机制被证实是植物逆境响应的重要途径[7]。AsA-GSH循环存在于植物细胞内叶绿体、线粒体等多种亚细胞器中,具有清除多余活性氧(ROS)及其他外源有害物质的功能[8-9]。在AsA-GSH循环中,谷胱甘肽还原酶(GR)将氧化型谷胱甘肽催化成还原型谷胱甘肽(GSH),促进抗坏血酸(AsA)的再生,并与抗坏血酸过氧化物酶(APX)等抗氧化物质共同作用,避免了氧化胁迫造成细胞蛋白、核酸的损伤及细胞功能的紊乱,提高了植物耐性[10]。另一方面,耐性植物还可通过细胞壁固Pb作用,限制Pb离子的跨膜运输及液泡区室化作用来削弱Pb对细胞代谢的毒害[11]。多年生禾本科金丝草(Pogonatherum crinitum)是本课题组发现并证实的一种Pb超富集植物,具有分布范围广、抗贫瘠、繁殖速率快、生物量相对较高等特点,可作为植物修复备选植物[12]。但目前Pb胁迫下金丝草耐性机制、亚细胞分布等尚不清楚,金丝草叶片及根系响应是否存在差异仍有待验证。鉴于此,以金丝草为材料,设置不同浓度Pb胁迫实验,测定各Pb处理下金丝草叶片和根系AsA-GSH循环响应、细胞超微结构变化及亚细胞Pb分布等指标,旨在揭示超富集植物对Pb的响应机理。
1 材料与方法
1.1 试验材料
在福建尤溪铅锌矿区采取金丝草种子,在恒温箱培养发芽后,转移到营养土中继续培养到12 cm左右,选取长势一致的幼苗进行Pb胁迫试验。胁迫基质选用洗净河沙和黄心土按1∶3混合,去除杂质后过2 mm筛。基质理化性质及重金属含量见表1。
1.2 试验设计
共设计4个 Pb处理,Pb2+浓度分别为0、1000、2000、3000 mg·kg-1,分别记作 CK、Pb1000、Pb2000、Pb3000,每个处理5个重复。试验用盆直径30 cm,高25 cm,基质填充 8 kg(以干土计),使用(CH3COO)2Pb溶液定量施加到相应浓度后,钝化30 d。参考文献[13]的方法,一次性施加定量KH2PO4和尿素作基肥,标准为每千克土肥料用量为 N 100 mg、P2O280 mg、K2O 100 mg,将钝化后土壤取出平铺于牛皮纸上,与底肥混合均匀后,重新装盆。将金丝草幼苗移栽至胁迫盆中,每盆10株。试验在玻璃温室中进行,温度(25±2)℃,湿度65%~75%,并保持含水量在田间持水量的70%左右。胁迫60 d时收获金丝草,分析测定金丝草植物形态和生理生化指标。
1.3 测定方法
1.3.1 根系指标
胁迫试验60 d收获金丝草后,利用数字化扫描仪(STD1600 Epson USA)对每盆10株金丝草的总根系进行扫描,并利用WinRhizo(Version 4.0B)进行根系分析,得出金丝草根系总根长、根表面积、根平均直径和根体积。
1.3.2 AsA-GSH 循环
胁迫试验60 d收获金丝草后,将每盆10株金丝草叶片和根系取样后混匀待测。GR、GSH含量测定参考Ma等[14]方法;APX活性、AsA含量分别参考Nakano等[15]和 Tanaka 等[16]方法。

表1 试验基质理化性质Table 1 The physical and chemical properties of soil used in the experiment
1.3.3 金丝草植株Pb含量
将前期处理好的金丝草地上部和根系样品各称取 0.2 g于三角瓶中,采用湿灰化法(HNO3∶HClO4=4∶1)加热消解,2%HNO3处理定容至50 mL容量瓶,使用Pb标准样品进行标准曲线制作和校准,相关系数合格后开始测定样品Pb含量,仪器选用北京瑞利分析仪器公司WFX-136型号的原子吸收分光光度计。
1.3.4 亚细胞组分Pb含量
采用差速离心法[17],对金丝草叶片和根系进行不同亚细胞组分分离。分别取金丝草叶片和根系0.3 g,加入缓冲液(蔗糖 0.25 mol·L-1、pH 7.5 的 Tris HCl 50 mmol·L-1、二硫赤鲜糖醇 1 mmol·L-1),液氮研磨匀浆。离心过程均在4℃下操作,将组织匀浆液于高速冷冻离心机300 r·min-1下离心1 min,得沉淀为细胞壁(F1)组分,上清液在 2000 r·min-1下离心 20 min,得沉淀为细胞核和叶绿体(F2)组分;上清液在12 000 r·min-1下离心 30 min,得沉淀为线粒体(F3)组分,上清液为可溶(F4)组分。亚细胞各组分Pb含量参考1.3.3方法进行测定。
1.3.5 亚细胞分布
用pH 7.2的磷酸缓冲液洗净样品,2.5%的戊二醛固定、2%的锇酸浸泡过夜,酒精逐级脱水(50%、70%、85%、90%、95%、100%),Spur包埋,70℃聚合 8 h后,使用LKB8800型超薄切片机切片,使用JEM-100CX型透射电镜(TEM)对金丝草组织结构改变及Pb分布进行检测,并采用能谱仪(EDS)进一步进行定性分析。
1.4 数据统计分析
试验数据使用SPSS 20.0软件,采用单因素方差分析(One-way ANOVA)对不同生理指标数据进行差异和显著性分析(α=0.05)。采用Origin 8.0软件作图。图表中的数据用5个重复的均值±标准差表示。
2 结果与分析
2.1 Pb胁迫对金丝草根系形态的影响
由图1可知,金丝草总根长和根表面积在Pb 1000处理下达最大值,较对照增长8.4%和7.0%,随Pb胁迫浓度增加,总根长和根表面积发育受到抑制,显著低于对照(P<0.05)。金丝草根体积则表现为先增后减趋势,在Pb1000处理时略有增长。值得注意的是,金丝草根平均直径在Pb1000和Pb2000处理下显著高于对照(P<0.05),且在Pb2000处理时达最大值,增长20.9%。这可能是金丝草根系对Pb胁迫响应的重要补偿措施。
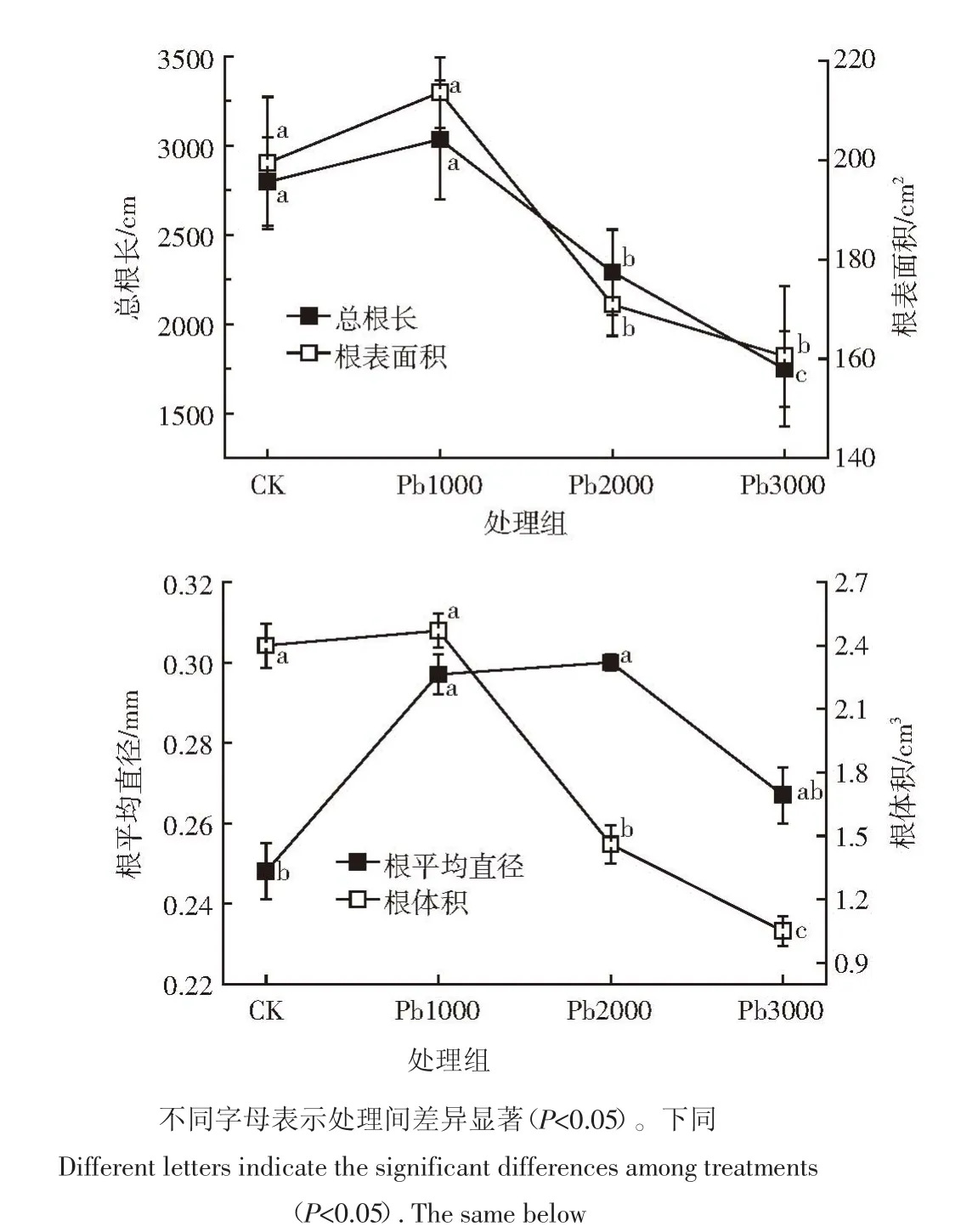
图1 不同Pb胁迫对金丝草根系形态的影响Figure 1 Effects of different Pb concentration treatments on the root morphology of Pogonatherum crinitum
2.2 Pb胁迫对金丝草AsA-GSH循环的影响
由图2A可知,不同Pb处理对金丝草叶片GR活性影响较小,GR活性基本保持稳态。金丝草根系GR活性在Pb1000处理时较对照增长41.1%,显著高于对照(P<0.05),随胁迫浓度增加,仍保持较高水平。由图2B可知,金丝草叶片GSH含量在各Pb处理下,均高于对照(1.04~1.36倍),在Pb2000处理下达最大值。金丝草根系GSH含量也基本高于对照,呈增长趋势,但未达显著水平(P>0.05)。由图2C可知,Pb处理对金丝草叶片AsA含量有一定促进作用,在Pb3000处理下达最高水平。金丝草根系AsA含量在Pb1000处理下显著增长(P<0.05),增幅达60.6%,之后随胁迫浓度增加显著下降(P<0.05)。由图2D可知,Pb胁迫会抑制金丝草叶片APX活性,Pb1000和Pb2000处理下,叶片APX活性显著低于对照(P<0.05)。Pb处理下金丝草根系APX活性均高于对照,其中Pb1000处理为对照的 1.74 倍,增长显著(P<0.05),Pb2000、Pb3000处理下则与对照无显著差异(P>0.05)。此外,除金丝草根系GSH含量低于叶片外,金丝草GR、AsA、APX在对照和不同Pb处理中,根系水平均高于叶片。故推测金丝草根系抗氧化系统响应和清除活性氧能力优于叶片,处于较核心地位。
2.3 Pb胁迫对金丝草体内Pb含量的影响
由图3可知,不同Pb处理下,金丝草地上部和根系Pb含量均显著高于对照(P<0.05),且呈现根系>地上部的趋势。Pb3000处理下,金丝草地上部和根系Pb 含量达 1 220.1、4 866.2 mg·kg-1,显著高于对照(P<0.05),分别为对照的697.2和4 505.7倍,表现出较强的Pb富集能力。
2.4 铅胁迫对金丝草体内亚细胞组分Pb含量的影响
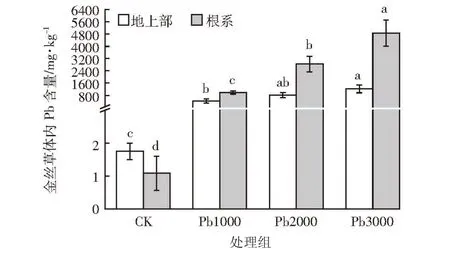
图3 不同Pb胁迫对金丝草体内Pb含量的影响Figure 3 The Pb concentration in shoots and roots of Pogonatherum crinitum under Pb stress
由表2可知,无Pb处理下,叶片和根系亚细胞各组分未检测出Pb。总量上,金丝草根系亚细胞各组分Pb含量均高于叶片各组分含量,随Pb浓度增加,叶片和根系各组分Pb含量呈增长趋势。且叶片和根系各组分Pb含量均在Pb3000处理下达最大值。分配比例上,Pb主要分布于金丝草叶片和根系的F1组分中,分别占比40.6%~48.1%、57.7%~77.3%;其次为F4组分,占比为20.9%~32.6%、10.2%~30.2%。随胁迫浓度增加,金丝草叶片F3组分占比下降、F4组分占比增大,根系F1组分显著增加。可得,金丝草通过根系和叶片差异化分配,通过将Pb离子限制在根系细胞壁、叶片可溶组分中,降低了Pb离子对细胞代谢活跃区域的影响,提高了金丝草抗逆能力。
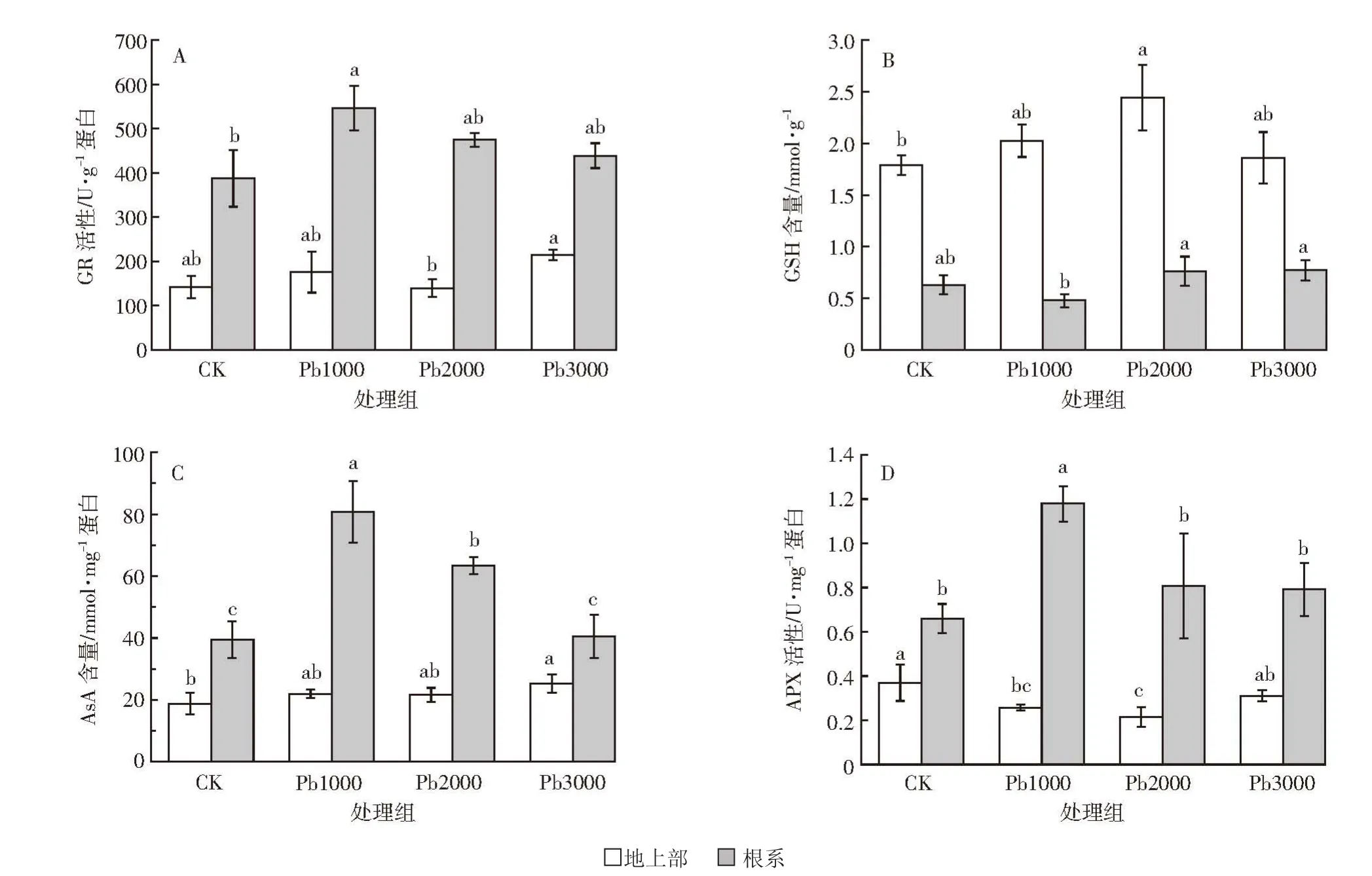
图2 不同Pb胁迫对金丝草体内AsA-GSH循环的影响Figure 2 Effects of different Pb concentration treatments on the ascorbate-glutathione cycle of Pogonatherum crinitum
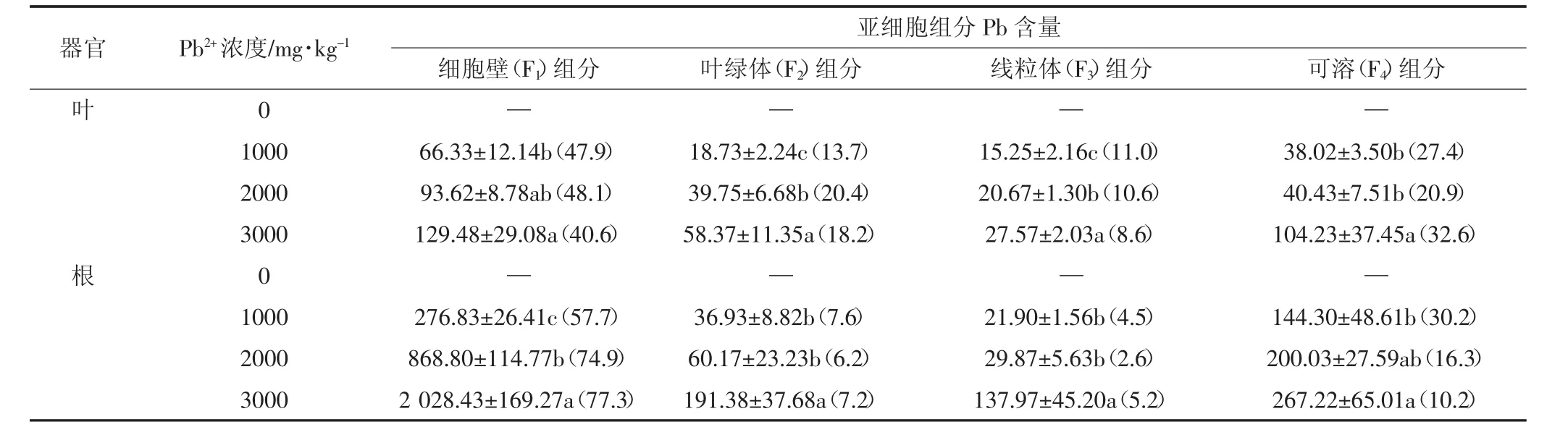
表2 金丝草体内的亚细胞Pb含量分布(mg·kg-1)Table 2 Subcellular distribution of Pb2+in roots and leaves of Pogonatherum crinitum(mg·kg-1)
2.5 Pb胁迫下金丝草亚细胞Pb分布

图4 Pb胁迫下的金丝草叶片细胞透射电镜图Figure 4 Ultrastructure of leave cells of Pogonatherum crinitum in the different Pb treatments
由图4知,对照(图4a、图4 b)叶片组织结构完整,各细胞器结构无损伤,细胞形状正常,内有完整大液泡,叶绿体、线粒体结构清晰可见,细胞壁及细胞膜表面光滑、清晰。Pb1000处理(图4c、图4d)细胞结构较完整,存在一定程度质壁分离,细胞壁组分有少量黑色颗粒沉淀。随胁迫浓度增加,Pb2000(图4e、图4f)和 Pb3000处理(图 4g、图 4h)对金丝草亚细胞结构造成较大损伤。其中,叶绿体受损明显,类囊体膨大、排序紊乱、基粒片层扭曲、被膜结构模糊;线粒体数量降低,脊突结构膨胀,分布不均匀,外膜破损;细胞壁沉积大量黑色颗粒物,通过能谱分析(图5)发现,金丝草叶片细胞中Pb峰值与C、O相当,且吸附于2.41、2.46、10.51 keV等位点,可证实存在于细胞壁、细胞间隙、叶绿体中黑色颗粒主要成分为Pb。
由图6可知,金丝草对照(图6a、图6b)根系细胞壁清晰完整,无质壁分离,细胞器无损伤现象。Pb 1000处理(图6c、图6d)组织结构较完整,出现轻微质壁分离,细胞壁发现部分黑色颗粒沉淀。Pb2000(图6e、图 6f)和 Pb3000 处理(图 6g、图 6h)对金丝草根系细胞形状和结构产生明显损伤,细胞间隙增大,质壁分离加剧,细胞核核膜破裂,核质多泡、核仁凝集现象明显,且细胞质和细胞壁黑色颗粒数量增加。进一步通过能谱分析(图7)发现,黑色颗粒吸附于2.44、3.06、10.52、12.51 keV等位点,可证实其主要成分为Pb。
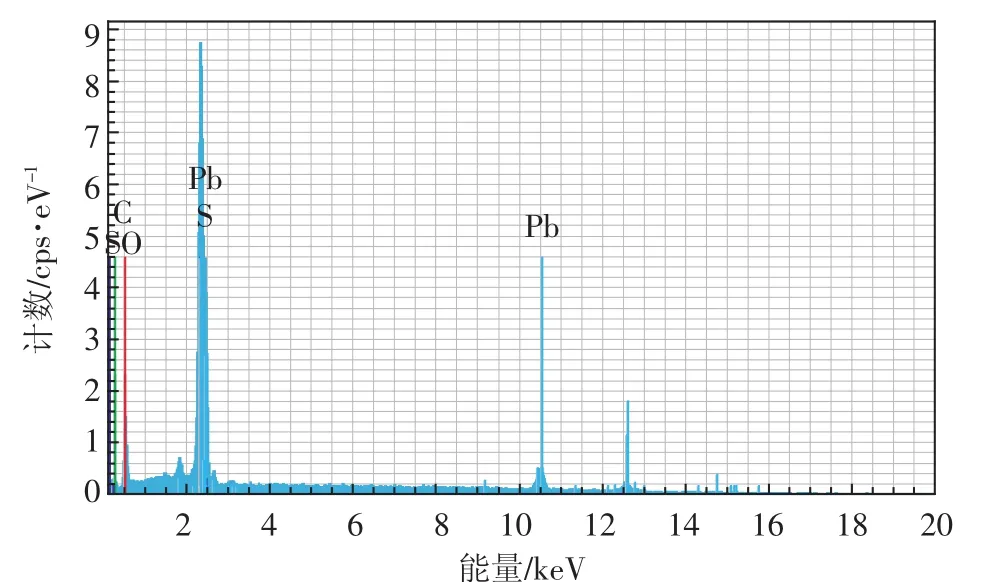
图5 1000 mg·kg-1Pb处理下金丝草叶片细胞能谱分析图Figure 5 The EDS analyses of leaves cells of Pogonatherum crinitum under Pb treatment(1000 mg·kg-1Pb)
3 讨论
3.1 Pb逆境下金丝草AsA-GSH循环及根系形态响应
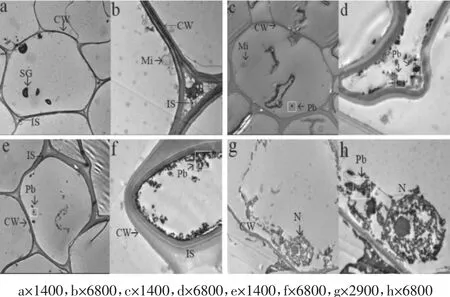
图6 Pb胁迫下的金丝草根系细胞透射电镜图Figure 6 Ultrastructure of root cells of Pogonatherum crinitum in the different control treatment
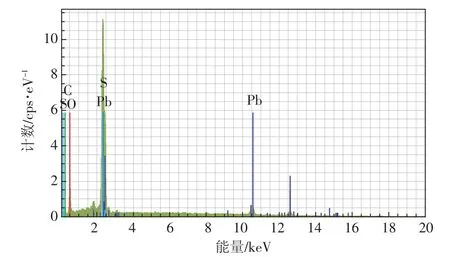
图7 1000mg·kg-1Pb处理下金丝草根系细胞能谱分析图Figure 7 The EDS analysis of roots cells of Pogonatherum crinitum under Pb treatment(1000 mg·kg-1Pb)
重金属Pb对植物毒害主要途径之一是活性氧大量产生,造成细胞损伤、功能紊乱等氧化胁迫作用,耐性植物可通过诱导酶促和非酶促抗氧化系统响应来抵御过氧化毒害[18]。AsA-GSH循环是植物抗氧化系统中清除活性氧自由基的主要通路之一,与植物抗逆性密切相关[19]。研究发现,Pb、Cd等逆境下,转基因拟南芥(Arabidopsis thaliana)[20]、石竹(Dianthus chinensis)幼苗[21]、小白菜(Brassica chinensis L.)叶片[22]、芨芨草(Achnatherum splendens)[23]等,可通过 AsA-GSH 循环的响应来提高自身抗逆能力。AsA-GSH循环由GR、GSH、AsA、APX、单脱氢抗坏血酸还原酶(MDHAR)等抗氧化酶、抗氧化物组成[24],在多数细胞区室中均有分布。其中,GR是一种主要存在于叶绿体中的黄素蛋白氧化还原酶,也是组成AsA-GSH循环通路的关键酶[25]。有研究发现[26],三叶鬼针草(Bidens pilosa)幼苗在 Pb 浓度为 600 μmol·kg-1处理下,其叶片和根系GR活性分别比对照增加5.5%和12.5%,增强了植株清除细胞内活性氧的能力。本研究中,除Pb2000处理下叶片GR低于对照外,其他Pb处理下金丝草叶片及根系GR活性均高于对照,表明金丝草在Pb胁迫下可通过GR酶活的增加,促进GSH及AsA含量稳定、有利于GSH/GSSG的高比率和金丝草整体抗氧化能力的提升。Pb胁迫下金丝草叶片GSH含量为对照的1.04~1.36倍,Pb2000和Pb3000处理下根系GSH水平也优于对照。逆境下金丝草通过保持体内较高的GSH含量,增强了植株直接清除超氧阴离子自由基、羟基自由基的能力,且有利于金丝草体内还原脱氢抗坏血酸、蛋白活性的维持及膜稳定等,与Bashandy等[27]结论基本一致。有研究证实,植物细胞内AsA含量一定程度决定了植物抗逆性强弱[28]。AsA具有调控植物光合作用、细胞生长、糖代谢、激素合成等生理活动的功能,特别对植物细胞衰老调控、活性氧清除等胁迫响应具有重要影响[29]。本试验中,Pb处理下金丝草叶片AsA含量与对照无显著差异,根系AsA含量则在Pb1000和Pb2000处理下显著增加。这可能是一定阈值内,金丝草根系AsA含量对土壤环境改变较敏感,金丝草根系AsA含量的增加削弱了体内过氧化毒害、延缓了细胞衰老进程,根系基本功能得以正常运转。郭智[30]也发现,Cd胁迫下超富集植物龙葵(Solanum nigrum L.)幼苗叶片AsA含量具有浓度和时间效应,且叶片AsA含量的增加提高了其耐Cd能力。同时,AsA是APX清除H2O2的反应底物,APX对底物具有高度专一性,除可清除植物体内过多ROS外,也是叶绿体中调节H2O2代谢的主要酶[31-32]。本研究中,金丝草在逆境下,根系APX活性与AsA含量均高于叶片,这有利于根系抵御过氧化能力和植株整体耐性的增强。
根系是植物与土壤界面联系的唯一载体,土壤环境的改变,根系最先感受及响应。由于植物根系能够快速直接地吸收大量的Pb,常使根系生长率和侧枝发育受到一定程度抑制[33]。本研究中,金丝草根系总根长、根表面积、根体积“低促高抑”现象明显。金丝草根平均直径则呈增长趋势,Pb3000处理下仍高于对照。推测是金丝草通过根系形态优化分配,来使根系平均直径得到补偿增长,从而维持根系生理功能的稳定,主动适应逆境。
3.2 Pb胁迫下金丝草亚细胞累积机制及毒害效应
土壤Pb胁迫下,植物根系损伤首当其冲。Pb通过质体流或扩散流方式到达根表后,土壤Pb浓度、根系性质、Pb形态等因素决定了根系固Pb量,被固定的Pb受根系细胞壁形态变化(局部增厚等)及组分(纤维素、多糖、木质素等)影响,发生络合沉淀,被限制在细胞壁区域,通过与细胞质隔离来减少对细胞的影响[34]。因此,植物根系细胞壁被认为是抵御Pb离子的第一道屏障,也是耐性植物解毒的关键环节[35]。大量研究表明,进入根细胞的Pb大多分布在根细胞间隙、细胞壁及液泡组织中[36]。杨素勤等[37]发现,Pb(100 mg·kg-1)胁迫下,小麦(百农 160)叶片和根系细胞壁、细胞液含Pb量分别占各自总量的72.67%和77.12%。黄玫英等[38]也发现,铅胁迫下类芦根和叶细胞中细胞壁和可溶组分是储存Pb的两个最重要位点。本研究中,金丝草在Pb1000、Pb2000和Pb3000处理下,叶片细胞壁和可溶组分含Pb占比达68.0%~75.3%,根系则更高。这表明金丝草可通过细胞内差异化分配、利用代谢活动弱的细胞壁和可溶组分来限制截留,降低Pb及其化合物对细胞活动的影响,形成区隔作用来解毒。在亚细胞水平上,叶绿体、细胞核、线粒体等常被认为是植物在Pb胁迫下受损最多的细胞器[39]。陈顺钰等[40]发现,高浓度 Pb 处理(1000 mg·kg-1)对柳叶箬叶片和根系亚细胞结构造成了较大损伤,部分细胞壁、细胞膜被破坏,叶绿体基粒类囊体膨胀,基质片层排列无序,被膜结构模糊,且有大量Pb颗粒主要沉淀于细胞壁中。本研究中,金丝草叶片及根系在无Pb处理下,细胞质膜、细胞壁光滑连续,细胞组织结构完整。随胁迫浓度增加,细胞壁等区域Pb颗粒沉淀显著增加,叶片及根系细胞超微结构明显遭到破坏。这表明金丝草体内对Pb的区隔化作用有一定阈值,随胁迫浓度增加,金丝草细胞壁与Pb结合位点饱和,Pb离子进入细胞内,细胞结构及细胞器受损,毒害作用加剧,与江行玉等[41]研究结论一致。
此外,耐性植物体内重金属离子分布受植株类型、器官组织分布、重金属种类等诸多因素影响,不同的分配方式会影响植物耐性和富集能力。研究发现,土壤中Pb离子通过根系表面固定、跨细胞质膜运输、皮层细胞的横向转运、中柱薄壁细胞转移至木质部导管及进一步地上运输和细胞内重新分配等复杂程序后,逐渐在根系累积并转运至地上部[42]。本研究中,随Pb胁迫浓度增加,金丝草根系累积、转运至地上部能力显著提高。在Pb3000处理下,叶片和根系富集量分别达 1 220.1、4 866.2 mg·kg-1,表明金丝草对 Pb 有较强的富集能力,也反映出金丝草对Pb的积累与土壤胁迫浓度之间存在正相关关系。且金丝草根系Pb含量高于地上部,一定程度减少了Pb离子对金丝草地上重要组织及器官的毒害,提高了金丝草生存能力。
4 结论
(1)低 Pb 处理(Pb 1000 mg·kg-1)对金丝草根系发育和AsA-GSH循环中抗氧化酶、抗氧化物含量有一定促进作用。随胁迫浓度增加(Pb 2000、3000 mg·kg-1),金丝草植株地上部和根系Pb含量显著增加,根系生长受到抑制,细胞超微结构损伤明显。
(2)土壤中一定Pb用量范围内,金丝草可通过增加叶片GSH含量和根系GR、AsA、APX含量、增强细胞壁和可溶组分对Pb的区隔作用以及根系形态补偿增长,来抵御过氧化毒害、减少细胞内Pb毒害影响范围、维持根系功能稳定,较好地适应土壤Pb胁迫。
参考文献:
[1]李三中,徐华勤,陈建安,等.某矿区砷碱渣堆场周边土壤重金属污染评价及潜在生态风险分析[J].农业环境科学学报,2017,36(6):1141-1148.LI San-zhong,XU Hua-qin,CHEN Jian-an,et al.Pollutions and potential ecological risk of heavy metals in soils around waste arseniccontaining alkaline sites[J].Journal of Agro-Environment Science,2017,36(6):1141-1148.
[2]Kumar N,Bauddh K,Kumar S,et al.Accumulation of metals in weed species grown on the soil contaminated with industrial waste and their phytoremediation potential[J].Ecological Engineering,2013,61(1):491-495.
[3]Salazar M J,Rodriguez J H,Nieto G L,et al.Effects of heavy metal concentrations(Cd,Zn and Pb)in agricultural soils near different emission sources on quality,accumulation and food safety in soybean[Glycine max(L.)Merrill][J].Journal of Hazardous Materials,2012,233/234(10):244-253.
[4]Brooks R R,Lee J,Reeves R D,et al.Detection of nickeliferous rocks by analysis of herbarium specimens of indicator plants[J].Journal of Geochemical Exploration,1977,7:49-57.
[5]欧阳林男,吴晓芙,陈永华,等.锰矿修复区植物生态系统自由能与化学势分析[J].生态学报,2017,37(8):2694-2705.OUYANG Lin-nan,WU Xiao-fu,CHEN Yong-hua,et al.Gibbs free energy and chemical potentials of plant communities in a manganeseore tailing site undergoing ecological restoration[J].Acta Ecologica Sinica,2017,37(8):2694-2705.
[6]Baker A J M.Metal tolerance[J].New Phytologist,1987,106(s1):93-111.
[7]甘 龙,罗玉红,李晓玲,等.铅污染条件下小飞蓬的铅积累与生长及叶绿素荧光动力学响应[J].农业环境科学学报,2017,36(5):876-883.GAN Long,LUO Yu-hong,LI Xiao-ling,et al.Pb accumulation,growth and chlorophyll fluorescence of Conyza canadensis to different concentrations of Pb stress[J].Journal of Agro-Environment Science,2017,36(5):876-883.
[8]Gill S S,Tuteja N.Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J].Plant Physiology&Biochemistry,2010,48(12):909-930.
[9]Alscher R G.Biosynthesis and antioxidant function of glutathione in plants[J].Physiologia Plantarum,1989,77(3):457-464.
[10]Yousuf P Y,Hakeem K U R,Chandna R,et al.Role of glutathione reductase in plant abiotic stress[M]//Ahmad P,Prasad M N V.Abiotic stress responses in plants:Metabolism,productivity and sustainability.New York:Springer Science+Business Media,2012:149-158.
[11]Chen Y X,Yu M G,Duan D C.Tolerance,accumulation,and detoxification mechanism of copper in Elsholtzia splendens[M]//Sherameti I,Varma A.Detoxification of heavy metals.Berlin:Springer,2011:317-344.
[12]侯晓龙,常青山,刘国锋,等.Pb超富集植物金丝草(Pogonatherum crinitum),柳叶箬(Lsache globosa)[J].环境工程学报,2012,6(3):989-994.HOU Xiao-long,CHANG Qing-shan,LIU Guo-feng,et al.Two leadhyperaccumulator:Pogonatherum crinitum and Lsache globosa[J].Chinese Journal of Environmental Engineering,2012,6(3):989-994.
[13]孙建云.甘蓝(Brassica oleracea L.)耐镉性的品种差异及其机理研究[D].南京:南京农业大学,2011.SUN Jian-yun.Varietal difference in cadmium tolerance and mechanism in cabbage[D].Nanjing:Nanjing Agricultural University,2011.
[14]Ma F W,Cheng L L.The sun-exposed peel of apple fruit has higher xanthophyll cycle-dependent thermal dissipation and antioxidants of the ascorbate-glutathione pathway than the shaded peel[J].Plant Science,2003,165(4):819-827.
[15]Nakano Y,Asada K.Hydrogen peroxide is scavenged by ascorbatespecific peroxidase in spinach chloroplasts[J].Plant and Cell Physiology,1981,22(5):867-880.
[16]Tanaka K,Suda Y,Kondo N.O3tolerance and the ascorbate-dependent H2O2decomposing system in chloroplasts[J].Plant Cell Physiol,1985,26(7):1425-1431.
[17]罗洁文,黄玫英,殷丹阳,等.类芦对铅镉的吸收动力特性及亚细胞分布规律研究[J].农业环境科学学报,2016,35(8):1451-1457.LUO Jie-wen,HUANG Mei-ying,YIN Dan-yang,et al.Uptake kinetic characteristics and subcellular distribution of Pb2+and Cd2+in Neyraudia reynaudiana[J].Journal of Agro-Environment Science,2016,35(8):1451-1457.
[18]黄亚萍,俎丽红,沈广爽,等.铅胁迫对蜀葵重金属积累及抗氧化酶活性的影响[J].农业环境科学学报,2017,36(9):1746-1752.HUANG Ya-ping,ZU Li-hong,SHEN Guang-shuang,et al.Effects of lead stress on accumulation ability and antioxidant enzyme activities of Althaea rosea Cavan[J].Journal of Agro-Environment Science,2017,36(9):1746-1752.
[19]Mittler R.Oxidative stress,antioxidants and stress tolerance[J].Trends in Plant Science,2002,7(9):405-410.
[20]Freeman J L,Persans M W,Nieman K,et al.Increased glutathione biosynthesis plays a role in nickel tolerance in Thlaspi nickel hyperaccumulators[J].The Plant Cell Online,2004,16(8):2176-2191.
[21]丁继军,潘远智,刘柿良,等.土壤重金属镉胁迫对石竹幼苗生长的影响及其机理[J].草业学报,2013,22(6):77-85.DING Ji-jun,PAN Yuan-zhi,LIU Shi-liang,et al.Effect and mechanisms of soil cadmium stress on Dianthus chinensis seedling growth[J].Acta Prataculturae Sinica,2013,22(6):77-85.
[22]孙惠莉,吕金印,贾少磊.硫对镉胁迫下小白菜叶片AsA-GSH循环和植物络合素含量的影响[J].农业环境科学学报,2013,32(7):1294-1301.SUN Hui-li,LÜ Jin-yin,JIA Shao-lei.Effects of sulfur on ascorbateglutathione cycle and the content of phytochelatins in the leaves of pakchoi(Brassica chinensis L.)under cadmium stress[J].Journal of A-gro-Environment Science,2013,32(7):1294-1301.
[23]李牡丹.重金属Pb对芨芨草种子萌发及其幼苗生长的影响[D].北京:北京林业大学,2008.LI Mu-dan.The effect of heavy metal Pb on seed germination and seedling growth of Achnatherum splendens(Trin.) Nevskia[D].Beijing:Beijing Forestry University,2008.
[24]Jin Y H,Tao D L,Hao Z Q,et al.Environmental stresses and redox status of ascorbate[J].Journal of Botany,2003,45(7):795-801.
[25]蒋 婷,姜贝贝,潘远智,等.不同形态氮素对龙葵镉毒害的缓解效应[J].农业环境科学学报,2015,34(6):1060-1068.JIANG Ting,JIANG Bei-bei,PAN Yuan-zhi,et al.Mitigation of different forms of exogenous nitrogen on Cd toxicity to Solanum nigrum[J].Journal of Agro-Environment Science,2015,34(6):1060-1068.
[26]杨志娟.铅胁迫下NO信号在三叶鬼针草中的产生和作用机理研究[D].兰州:兰州交通大学,2016.YANG Zhi-juan.The production and signal mechanism of NO molecule in Bidens pilosa under Pb stress[D].Lanzhou:Lanzhou Jiaotong University,2016.
[27]Bashandy T,Guilleminot J,Vernoux T,et al.Interplay between the NADP-linked thioredoxin and glutathione systems in Arabidopsis auxin signaling[J].Plant Cell,2010,22(2):376-391.
[28]夏方山,闫慧芳,朱艳乔,等.活性氧非酶促清除剂对老化种子的影响[J].草业科学,2016,33(6):1126-1135.XIA Fang-shan,YAN Hui-fang,ZHU Yan-qiao,et al.Review on the non-enzymatic scavenging agent of reactive oxygen species in aged seeds[J].Pratacultural Science,2016,33(6):1126-1135.
[29]Welinder K G.Superfamily of plant,fungal and bacterial peroxidases[J].Current Opinion in Structural Biology,1992,2(3):388-393.
[30]郭 智.超富集植物龙葵(Solanum nigrum L.)对镉胁迫的生理响应机制研究[D].上海:上海交通大学,2009.GUO Zhi.Study on mechanisms of physiological response of hyperaccumulayor plant Solanum nigrum L.to cadmium stress[D].Shanghai:Shanghai Jiao Tong University,2009.
[31]丁顺华,陈 珊,卢从明.植物叶绿体谷胱甘肽还原酶的功能研究进展[J].植物生理学报,2016(11):1703-1709.DING Shun-hua,CHEN Shan,LU Cong-ming.Research progress on functions of glutathione reductase in chloroplasts of plants[J].Plant Physiology Journal,2016(11):1703-1709.
[32]李泽琴,李静晓,张根发.植物抗坏血酸过氧化物酶的表达调控以及对非生物胁迫的耐受作用[J].遗传,2013,35(1):45-54.LI Ze-qin,LI Jing-xiao,ZHANG Gen-fa.Expression regulation of plantascorbateperoxidaseanditstolerancetoabioticstresses[J].Hereditas,2013,35(1):45-54.
[33]柳 丹,潘 凡,杨肖娥.铅富集植物对铅的吸收及其耐性生理机制进展研究[J].池州学院学报,2007,21(5):88-91.LIU Dan,PAN Fan,YANG Xiao-e.Study on lead uptake and its physiological mechanism in lead enriched plants[J].Journal of Chizhou College,2007,21(5):88-91.
[34]Brown J E,Lisman J E.An electrogenic sodium pump in Limulus ventral photoreceptor cells[J].Journal of General Physiology,1972,59(6):720-733.
[35]时 萌,王芙蓉,王棚涛.植物响应重金属镉胁迫的耐性机理研究进展[J].生命科学,2016(4):504-512.SHI Meng,WANG Fu-rong,WANG Peng-tao.Research advances in the tolerance mechanism of plant response to heavy metal cadmium stress[J].Chinese Bulletin of Life Sciences,2016(4):504-512.
[36]伍 钧,孟晓霞,李 昆.铅污染土壤的植物修复研究进展[J].土壤,2005,37(3):258-264.WU Jun,MENG Xiao-xia,LI Kun.Phytoremediation of soils contaminated by lead[J].Soils,2005,37(3):258-264.
[37]杨素勤,程海宽,景鑫鑫,等.不同铅吸收特性小麦Pb的亚细胞分布和化学提取态[J].中国农业科学,2015,48(14):2848-2856.YANG Su-qin,CHENG Hai-kuan,JING Xin-xin,et al.Subcellular distribution and chemical-extraction of lead in wheat with different characteristics of lead absorption[J].Scientia Agricultura Sinica,2015,48(14):2848-2856.
[38]黄玫英,罗洁文,黄彩凤,等.Pb在类芦组织和亚细胞中的分布规律和毒害效应[J].农业环境科学学报,2016,35(11):2077-2085.HUANG Mei-ying,LUO Jie-wen,HUANG Cai-feng,et al.The distribution and toxic effects of Pb at the levels of the tissue and sub-cellular in Neyraudia reynaudiana[J].Journal of Agro-Environment Science,2016,35(11):2077-2085.
[39]潘 攀,杨俊诚,邓仕槐,等.土壤-植物体系中农药和重金属污染研究现状及展望[J].农业环境科学学报,2011,30(12):2389-2398.PAN Pan,YANG Jun-cheng,DENG Shi-huai,et al.Proceedings and prospects of pesticides and heavy metals contamination in soil-plant system[J].Journal of Agro-Environment Science,2011,30(12):2389-2398.
[40]陈顺钰,韩 航,陈加松,等.柳叶箬对Pb胁迫的生理响应及其体内Pb的亚细胞分布研究[J].农业环境科学学报,2017,36(5):884-890.CHEN Shun-yu,HAN Hang,CHEN Jia-song,et al.Effects of Pb stress on physiological characteristics and subcellular distribution of Pb in Isachne globosa[J].Journal of Agro-Environment Science,2017,36(5):884-890.
[41]江行玉,赵可夫.铅污染下芦苇体内铅的分布和铅胁迫相关蛋白[J].植物生理与分子生物学学报,2002,28(3):169-174.JIANG Xing-yu,ZHAO Ke-fu.The distribution of Pb and Pb-stressed relative proteins in Pb-polluted Phragmites australis seedlings[J].Journal of Plant Physiology and Molecular Biology,2002,28(3):169-174.
[42]段德超,于明革,施积炎.植物对铅的吸收、转运、累积和解毒机制研究进展[J].应用生态学报,2014,25(1):287-296.DUAN De-chao,YU Ming-ge,SHI Ji-yan.Research advances in uptake,translocation,accumulation and detoxification of Pb in plants[J].Chinese Journal of Applied Ecology,2014,25(1):287-296.
