土壤脲酶活性调控因素和脲酶活性细菌系统发育研究*
2018-04-25张知晓泽桑梓户连荣刘凌季梅
张知晓,泽桑梓,户连荣,刘凌,季梅
(1.云南省林业科学院,云南 昆明 650201;2.云南省林业有害生物防治检疫局,云南 昆明 650051)
脲酶是一种专一性尿素水解酶,在农林业生态系统中扮演关键角色。土壤脲酶可分解氮肥和尿素产生铵根离子,为植物提供营养[1],还能调节植物根际分泌物的分泌,进而影响根际细菌和线虫的种类和数量,具有防治根部病害的潜力[2]。我国氮肥利用率不足40%[3],与土壤脲酶活性有很大关系。农业上利用土壤脲酶的分解作用提高土壤肥力,但尿素氮转化速度过快,植物来不及吸收利用,导致营养挥发损失[4]。因此,如何调控土壤脲酶活性以服务于农林业生产值得研究。
目前土壤脲酶活性的研究多集中于向土壤中施用化学类脲酶抑制剂,来控制氮肥的释放速度,然而这多伴随着严重的环境污染问题[5]。此外,土壤有机质、全氮、全磷、速效氮、速效钾、土壤pH和重金属离子等土壤理化性质已被多项研究证明是土壤脲酶活性的影响因素[6]。土壤中还存在植物、真菌和细菌等脲酶活性生物。细菌在土壤中种类和数量最多,也具有较强的产酶能力[7]。然而目前脲酶活性细菌与土壤脲酶活性的关联性尚不明确,脲酶活性细菌对土壤脲酶活性规律影响的研究尚属空白。细菌在土壤的成功定殖是影响酶活性的前提。在农业上常用沼气渣、动物粪便、农家肥和淤泥作为肥料施入土壤中[8],而这些物质中的脲酶活性细菌也被带入土壤中,分析这类肥料与施肥后的土壤中脲酶细菌差异,能够了解细菌经过长期农业施肥措施后,能否成功在土壤定殖,进而明确外源添加脲酶活性细菌调节土壤脲酶活性的可行性,为调控土壤脲酶活性找到新途径。此外,进一步研究土壤脲酶细菌多样性和其他生境的脲酶活性细菌多样性特点,也能为后期研究利用微生物制剂改良和管理土壤,防治植物根部病害提供科学依据。
1 研究区域与研究方法
1.1 供试材料
(1)土壤 在云南省昆明市东川区因民镇(26°19′28″N、102°53′21″E)随机选取20块农田[前茬作物主要为豌豆(Lathyrussplendens)、萝卜(Raphanussativus)以及白菜(Brassicachinensisvar.oleifera)],每块农田采用十字交叉法,选取5个取样点,每个样点取样直径5cm处,土层深度0-20cm的土壤样品置于塑料袋中充分混匀组成混合样品,土样过20 目筛后,每块农田独立取1份副样(500g)置于塑料袋中,带回实验室后置于4℃的冰箱中保存备用。
(2)土壤关联的脲酶活性材料 在云南省昆明市东川区因民镇(26°19′28″N,102°53′21″E)取沼气渣(5份)、动物粪便(鸡粪、猪粪、驴粪、牛粪和羊粪共计5份)、农家肥(5份)和淤泥(5份)。
(3)土壤无关联脲酶活性材料 来源于南海北部和印度洋沿海红树林的海底淤泥由云南大学微生物研究所提供,共25份;不同种类的珍稀动物粪便[圆通山动物园:大象(Elephasmaximus)、羊驼(Vicugnapacos)、棕熊(Ursusarctos)、马来熊(Helarctosmalayanus)、东北虎(Pantheratigris)、孟加拉虎(Pantheratigris)、白虎(Pantheratigris)、长颈鹿(Giraffacamelopardalis)、麋鹿(Elaphurusdavidianus)、梅花鹿(Cervusnippon)共计10份]。
1.2 土壤理化性质分析
土壤脲酶活性采用靛酚比色法测定[9];土壤总N测定先用凯氏消化,然后用NaOH进行蒸馏,最后通过25mmol/L的H2SO4进行滴定(硼酸指示剂)[10];土壤铵态氮和硝态氮用2mol/L的KCl进行提取,后进行蒸馏和滴定[11];土壤有机质含量测定用重铬酸钾容量法[12];土壤pH测定采用pH计法完成[13]。
1.3 脲酶活性细菌分离及其物种多样性分析
1.3.1 培养基
LB培养基 酵母提取物10g,蛋白胨5g,NaCl 5g,水1L,pH 7。
酸性平板培养基 蛋白胨3g,葡萄糖20g,KH2PO42g,NaCl 5g,MgSO40.1g,Na2HPO41g,尿素10g,溴甲酚红0.1g,琼脂30g,pH 5.5。
中性平板培养基 蛋白胨2g,葡萄糖10g,KH2PO42g,NaCl 3g,MgSO40.1g,Na2HPO41g,尿素10g,中性酚红0.1g,琼脂30g,pH 7.0。
碱性平板 蛋白胨2g,葡萄糖10g,KH2PO42g,NaCl 3g,MgSO40.1g,Na2HPO41g,尿素10g,百里酚酞0.1g,琼脂30g,pH 10.0。
NH4+-YE培养基 酵母粉3g,葡萄糖10g,KH2PO42g,NaCl 3g,MgSO40.1g,Na2HPO41g,NiCl 0.01g,尿素10g,百里酚酞0.1g,琼脂30g,pH 6.0。
1.3.2 菌株的分离
土壤样品中脲酶活性细菌分离采用蔗糖离心法[14]。称取1g新鲜土壤样品,置于10mL 70%蔗糖溶液中。30℃,180rpm震荡培养30min,后取出离心(500rpm,1min),取上清液用灭菌水稀释至10-2,涂布酸性、中性和碱性平板,每种样品,每种培养基涂布3皿。30℃黑暗条件恒温培养7d后计数形成蓝色或红色晕圈的菌落数,并挑取变色菌落在LB培养基上进行纯化,纯化的菌落在NH4+-YE培养基上做进一步鉴定,产生相同颜色变化和刺激性氨味的细菌则鉴定为脲酶活性细菌[15]。土壤脲酶活性细菌数量计算公式为,脲酶活性细菌数量(CPU)=∑菌落数×500。
1.3.3 菌株的分子鉴定
脲酶活性细菌的16S rRNA测序是用LB平板活化脲酶活性菌株,并接种至LB营养液中,180rpm/min震荡培养至对数期,取2mL菌液离心收集菌体,用细菌基因组DNA提取试剂盒按照操作说明提取细菌总DNA。细菌总DNA用细菌通用引物(27F & 1492R)进行PCR扩增,扩展体系为50μL(10×PCR Buffer 5.0μL,dNTP Mix 4.0μL,Primer-L 2.0μL,Primer-R 2.0μL,模板DNA 1.0μL,rTaq酶 0.5μL,DD H2O 35.5μL),反应条件是95℃预变性5min,95℃变性30s,55℃退火30s,72℃延伸1min,35个循环,72℃延伸10min。 PCR产物用1%的琼脂糖凝胶电泳完成检测,条带清晰的PCR产物用DNA琼脂糖回收。回收DNA连接至PMD18-T质粒,并转化至Escherichia coli DH5α后,送北京华大基因完成测序[16-17],测序结果在NCBI上进行比对,以鉴定脲酶活性细菌的种类。
1.4 其他生境中脲酶活性细菌分离及其物种多样性分析
每种样品准确称量1g置于10mL 1%的尿素溶液中,30℃,180rpm/min震荡富集培养24h。取出后震荡均匀,取1mL样品溶液进行离心(500 rpm/min),取上清液1mL用灭菌水稀释至10-2,取200μL涂布酸性、中性和碱性平板,每种样品,每种培养基涂布3皿。30℃黑暗条件恒温培养7d后,挑取变色菌落在LB培养基上进行纯化,纯化的菌落在NH4+-YE培养基上培养3d再次鉴定,产生相同颜色变化和刺激氨味的细菌则鉴定为脲酶活性细菌,脲酶活性细菌用20%-30%的甘油液于-20℃进行编号冻存备用。
脲酶活性细菌的16S rRNA测序的方法按照本章1.3描述的方法完成。
1.5 数据分析
土壤的理化性质数据在统计分析前进行正态分布和方差齐次性检验,不符合正态分布的数据用log(x+1)进行标准化处理。采用SPSS 16.0软件完成数据的方差分析、SNK分析、相关分析、通径分析和主成分分析等统计分析。16S rRNA序列数据则利用EzTaxon和BLAST软件进行在线相似性分析,采用Clustal X软件进行多系列比较,并用MEGA 4.1软件进行系统发育进化分析。
2 结果与分析
2.1 土壤脲酶活性的关联因素
土壤样品的脲酶活性和理化性质见表1。由表1可知,土壤的脲酶活性是4.43-45.70U,平均是16.64U;土壤的有机质含量是21.24-73.58mg/g,平均是37.68mg/g;土壤的总氮含量是1.18-1.75mg/g,平均是1.45mg/g;土壤的C/N是14.35-42.05,平均是25.24;土壤的铵离子含量是10.69-16.44μg/g,平均是13.07μg/g;土壤的硝酸根离子含量是5.61-44.77μg/g,平均是17.75μg/g;土壤的无机氮含量是20.06-58.72μg/g,平均是30.82μg/g;土壤的脲酶活性细菌数量是3.24-18.15 × 103CFU,平均是7.82× 103CFU;土壤的pH值是5.60-6.54,平均是6.09。
由表2可知,土壤脲酶活性和土壤有机质含量(r=0.747**)、土壤总氮含量(r=0.985**)、土壤C/N(r=0.624**)、土壤硝酸根离子浓度(r=0.914**)、土壤无机氮含量(r=0.862**)、土壤脲酶活性细菌数量(r=0.976**)具有极显著正相关性,和土壤pH(r=-0.606)和土壤铵离子浓度(r=-0.114)呈现负相关关系,但未达到显著水平。
由表3可知,土壤脲酶活性影响因子的通径系数为,土壤有机质含量(1.755**)、总氮含量(-0.105)、C/N(-1.370**)、铵根离子浓度(-0.506)、硝酸根离子浓度(-4.324)、无机氮含量(4.071)、土壤脲酶活性细菌数量(0.835**)和土壤pH(-0.056),其中土壤有机质含量、C/N和土壤脲酶活性细菌数量对土壤脲酶活性的直接影响达到极显著水平。
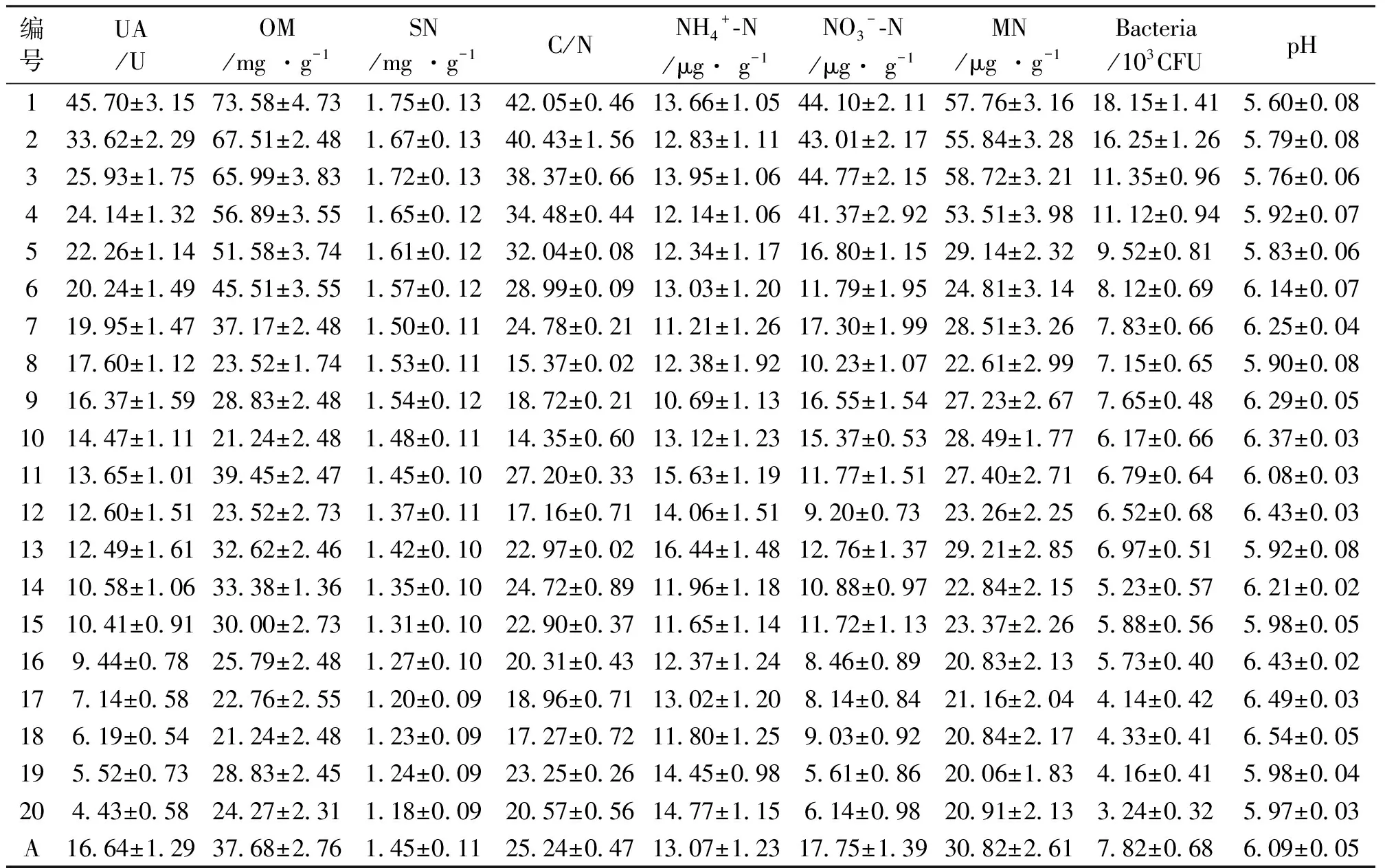
表1 土壤样品的理化性质
注:UA为土壤的脲酶活性,OM为有机质含量,SN为总氮含量,MN为无机氮含量,Bacteria为脲酶活性细菌数量,下同。α=0.05。
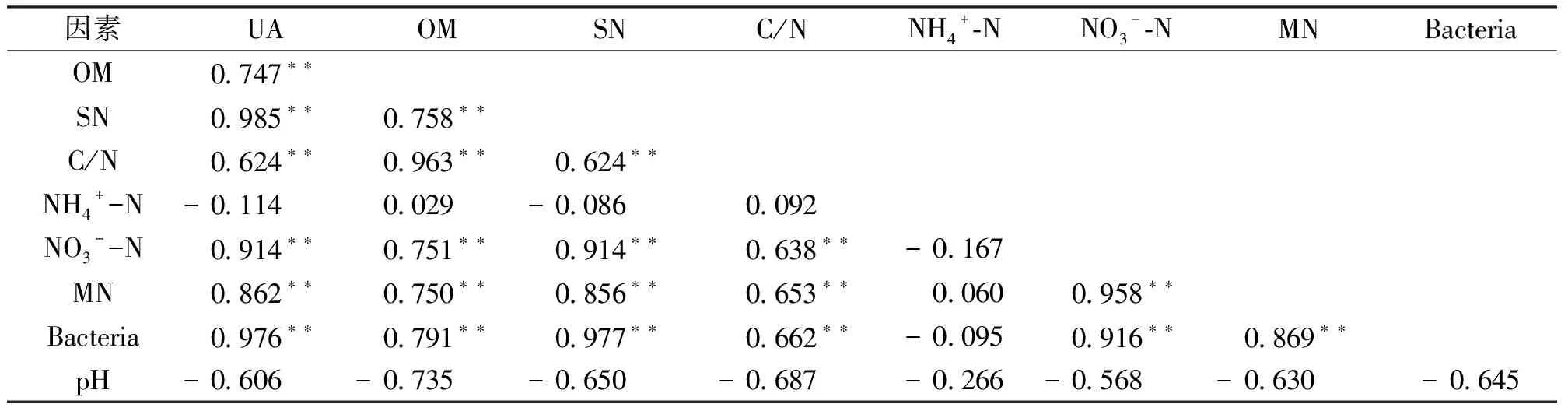
表2 土壤化学性质和土壤脲酶活性的相关性
注:斯皮尔曼相关系数,**表示显著性水平α= 0.01。
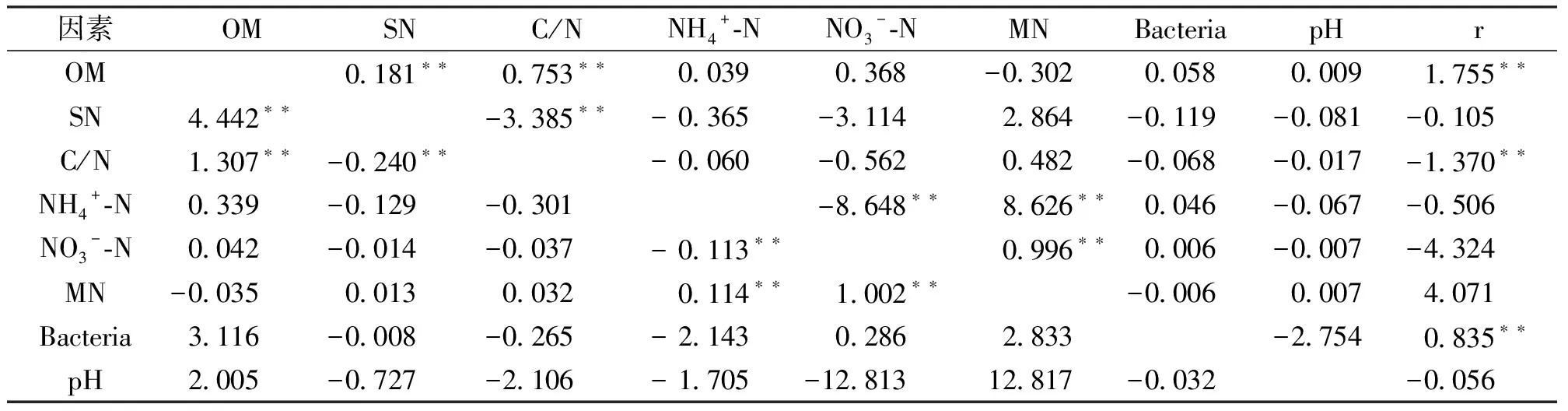
表3 土壤性质对土壤脲酶活性的通径系数
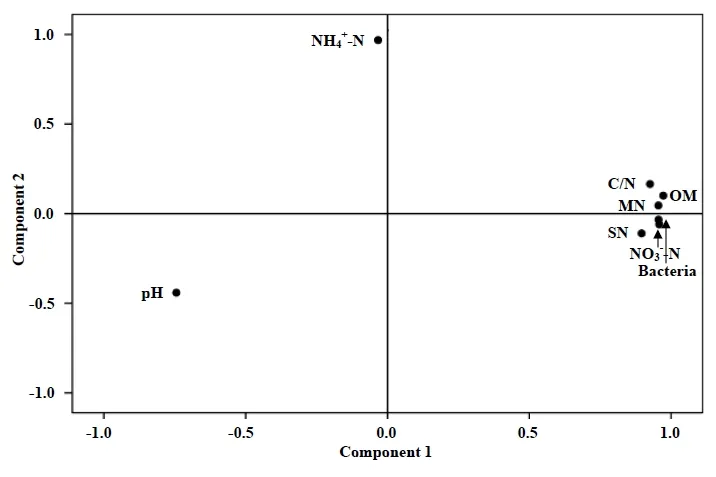
图1脲酶活性关联因子的因子载荷图
Fig.1 Component plot in rotated space of effective factor
主成分分析结果见图1。由图1可知,土壤有机质含量、总氮含量、C/N、硝酸根离子浓度、无机氮含量、土壤脲酶活性细菌数量和土壤pH在第一公因子(图1中第一、四象限)上有较大的载荷,其中土壤有机质含量、总氮含量、C/N、硝酸根离子浓度、无机氮含量和土壤脲酶活性细菌数量为正载荷,土壤pH为负载荷;铵根离子浓度在第二公因子(图1中第二象限)上有较大的正载荷。结果说明可以把有机质含量等7个土壤脲酶活性关联因子综合成2类因素,第1类(图1中第一、四象限)是脲酶活性控制因素,包括土壤有机质含量、总氮含量、C/N、硝酸根离子浓度、无机氮、土壤pH和土壤脲酶活性细菌数量等,这类因素直接影响土壤脲酶的活性;第2类(图1中第二象限)是反馈作用因素,即铵离子浓度,这类因素主要影响尿素和铵离子的动态平衡,通过反馈作用影响土壤脲酶活性。
2.2 土壤脲酶活性细菌系统发育分析
采用16S rRNA序列分析的方法对土壤脲酶活性细菌进行初步鉴定。试验分离出土壤脲酶活性细菌分属于厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)2大类群。厚壁菌门发现杆菌属(Bacillus)、芽孢八叠球菌属(Sporosarcina) 和芽孢杆菌属(Lysinibacillus) 3属,其中杆菌属(Bacillus)有2种,分别是海滨芽胞杆菌(B.litoralis)、芽孢杆菌(B.tequilensis);芽孢杆菌属(Lysinibacillus)有4种,分别是梭形芽孢杆菌(L.fusiformis)、L.macroides、L.parviboronicapiens、L.xylanilyticus;芽孢八叠球菌属(Sporosarcina)有1种是八叠球菌(S.pasteurii)。变形菌门发现产碱杆菌属(Alcaligenes)和假单胞菌属(Pseudomonas)2个属,都是单属单种,分别是粪产碱杆菌(A.faecalis)和绿脓假单胞菌(P.aeruginosa)(图2)。结果显示土壤脲酶活性细菌优势类群是厚壁菌门,间或分布变形菌门菌株,具有明显的特异性。
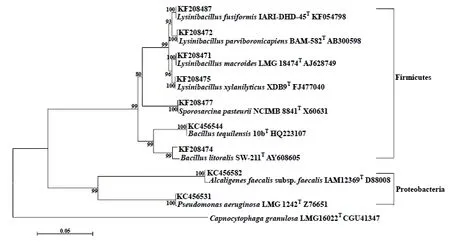
图2 土壤中可分离脲酶活性细菌的系统发育树
2.3 3种材料脲酶活性细菌的特点
采用16S rRNA序列分析的方法对脲酶活性细菌进行初步鉴定,脲酶活性细菌菌株信息见表4。在土壤关联的脲酶活性材料(取自土壤取样地的沼气渣、动物粪便、农家肥和淤泥)中发现9种脲酶活性细菌,其中放线菌门细菌1种,为谷氨酸棒杆菌(Corynebacteriumglutamicum);厚壁菌门细菌2种,分别为科氏葡萄球菌(Staphylococcuscohnii)和木糖葡萄球菌(Staphylococcusxylosus);变形菌门是土壤关联材料的优势种群,共分离出粪产碱杆菌、奥斯陆莫拉菌(Moraxellaosloensis)和绿脓假单胞菌等6种。与之相比,土壤中未发现放线菌门细菌,厚壁菌门是土壤脲酶细菌的优势种群,分离出细菌海滨芽胞杆菌和芽孢杆菌等7种,但活性材料中的科氏葡萄球菌和木糖葡萄球菌并未发现,土壤中仅发现变形菌门的粪产碱杆菌和绿脓假单胞菌2种细菌。
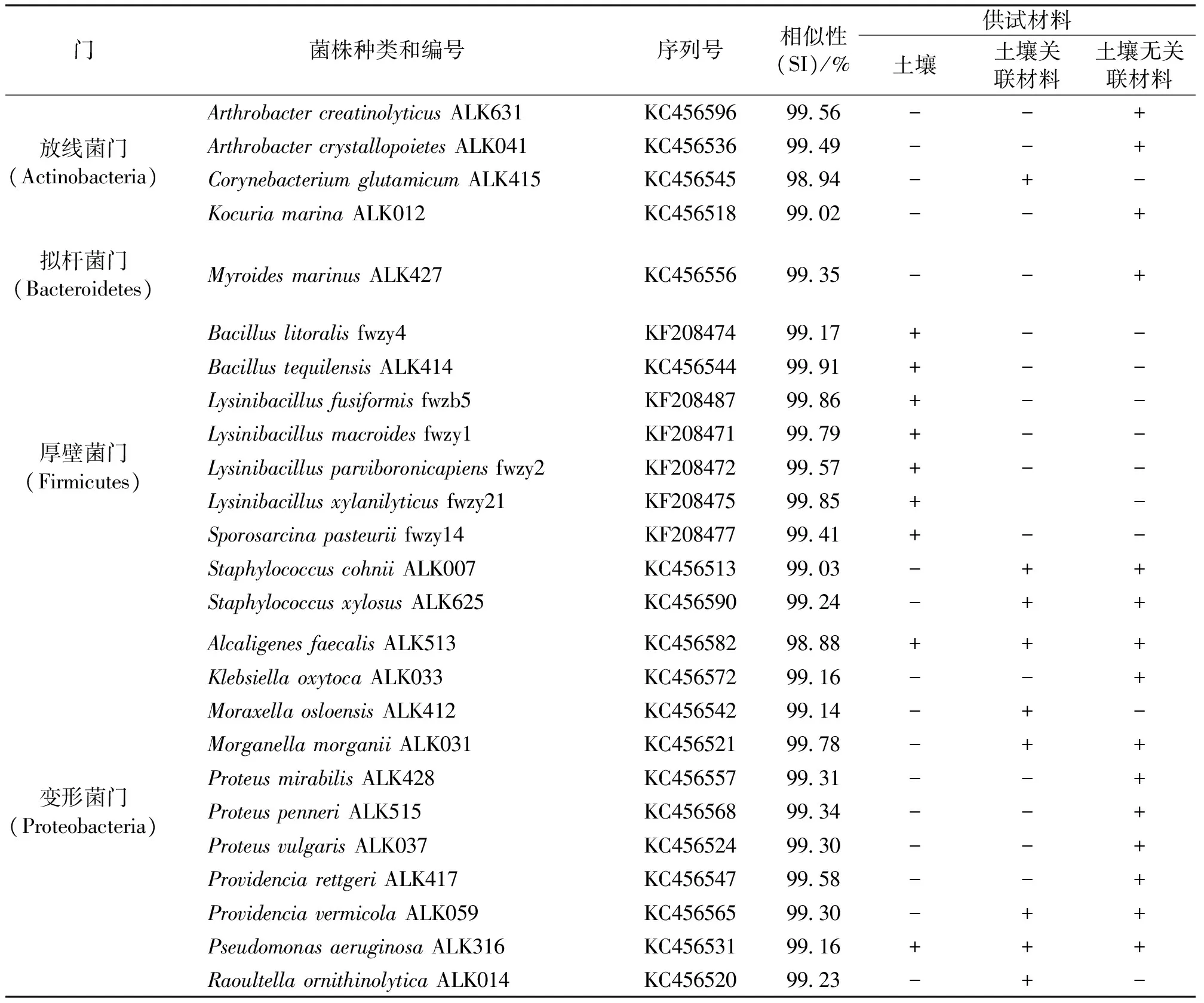
表4 脲酶活性菌株信息统计表
注:“+”表示在该供试材料中分离到该菌种的菌,“-”表示未分离到该菌种的菌。
土壤无关联脲酶活性材料(来源于南海北部和印度洋沿海红树林的海底淤泥及圆通山动物园的不同种类的珍稀动物粪便)中分离出Arthrobactercreatinolyticus、成晶节杆菌(A.crystallopoietes)和考克氏菌(Kocuriamarina)、Myroidesmarinus、科氏葡萄球菌和木糖葡萄球菌、粪产碱杆菌、产酸克雷伯菌(Klebsiellaoxytoca)、摩氏摩根菌(Morganellamorganii)、奇异变形杆菌(Proteusmirabilis)、羽状变形菌(P.penneri)、普通变形杆菌(P.vulgaris)、雷氏普罗威登斯菌(Providenciarettgeri)、普罗威登斯菌(P.vermicola)和绿脓杆菌10属15种脲酶活性细菌,分属于放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)4个类群。
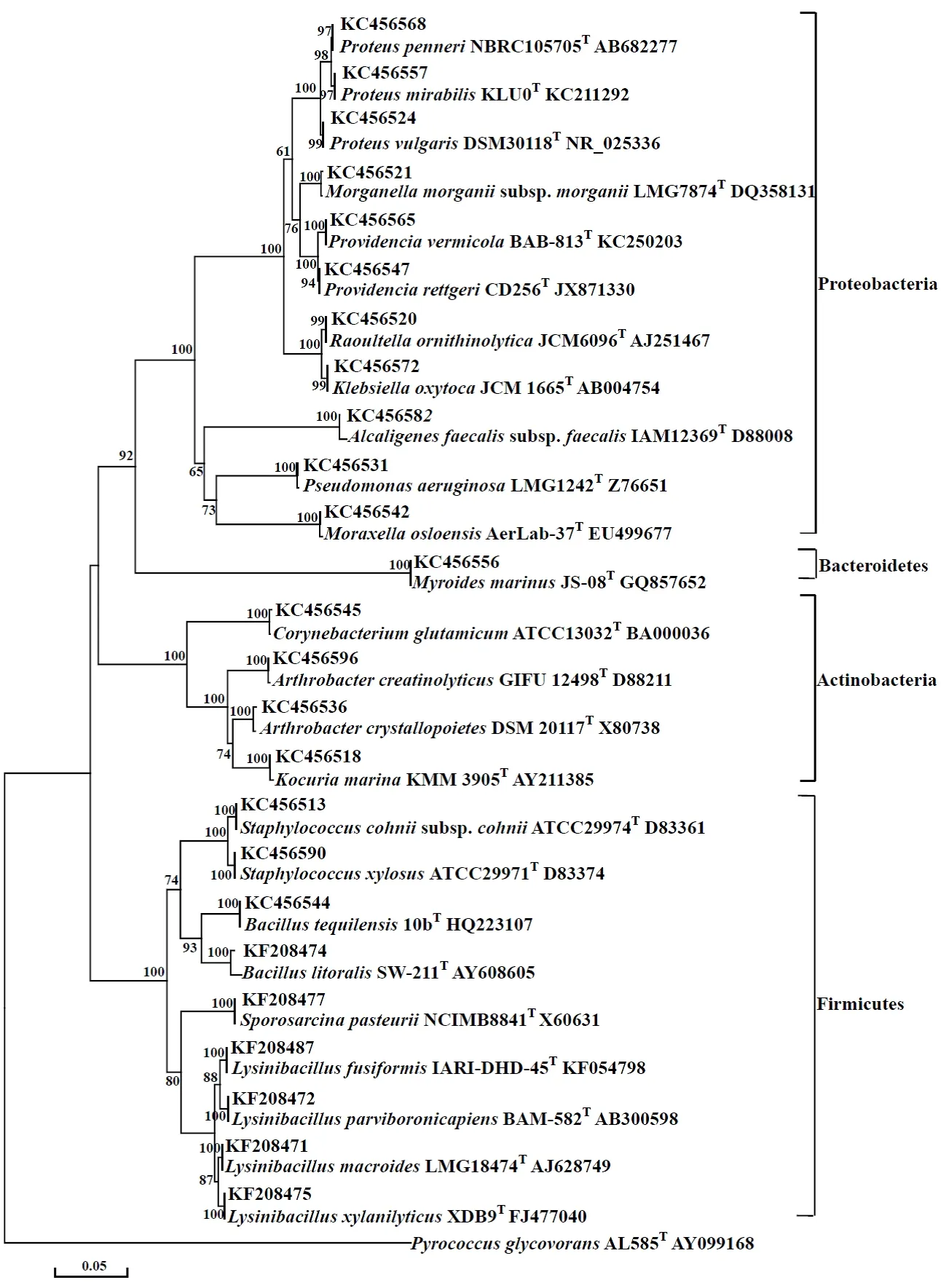
图3纯培养细菌16属的系统发育树
Fig.3 Phylogenetic tree of cultural urease-active bacteria in 16 genera
2.4 脲酶活性细菌的系统发育分析
采用16S rRNA序列分析的方法对脲酶活性细菌进行初步鉴定。发现脲酶活性细菌的分属情况(图 3)是,(1)放线菌门(Actinobacteria)分布3属4种,分别是棒状杆菌属(Corynebacterium)、节杆菌属(Arthrobacter)和 考克氏菌属(Kocuria),其中节杆菌属有A.creatinolyticus和成晶节杆菌(A.crystallopoietes),棒状杆菌属(Corynebacterium)有谷氨酸棒杆菌(C.glutamicum),考克氏菌属(Kocuria)有考克氏菌(K.marina);(2)拟杆菌门(Bacteroidetes)仅有1属1种 ,是Myroidesmarinus;(3)厚壁菌门(Firmicutes)分布4属9种,分别是芽孢杆菌属(Bacillus)、葡萄球菌属(Staphylococcus)、芽孢八叠球菌属 和梭杆菌属(Lysinibacillus)4属,其中芽孢杆菌属有2种,是海滨芽胞杆菌(B.litoralis)、芽孢杆菌(B.tequilensis),梭杆菌属(Lysinibacillus)有4种,分别是L.fusiformis、L.macroides、L.parviboronicapiens、L.xylanilyticus,葡萄球菌属(Staphylococcus)有2种,分别是科氏葡萄球菌(S.cohnii)、木糖葡萄球菌(S.xylosus),芽孢八叠球菌属有1种,是八叠球菌;(4)变形菌门 (Proteobacteria)有8属11种,分别是变形杆菌属(Proteus)、摩根氏菌属(Morganella)、普罗维登斯菌属(Providencia)、拉乌尔菌属(Raoultella)、克雷白氏杆菌属(Klebsiella)、产碱杆菌属(Alcaligenes)、假单胞菌属和莫拉克斯氏菌属(Moraxella)8属,变形杆菌属有奇异变形杆菌(P.mirabilis)、羽状变形菌、普通变形杆菌3种,摩根氏菌属(Morganella)有摩氏摩根菌(M.morganii) 1种,普罗维登斯菌属(Providencia)有雷氏普罗威登斯菌(P.rettgeri)、普罗威登斯菌(P.vermicola)2种,拉乌尔菌属(Raoultella)分布解鸟氨酸拉乌尔菌(R.ornithinolytica)1种,克雷白氏杆菌属(Klebsiella)有产酸克雷伯菌(K.oxytoca)1种,产碱杆菌属有粪产碱杆菌1种,假单胞菌属有绿脓假单胞菌1种。结果显示脲酶活性细菌多数分属变形菌门(Proteobacteria),分布跨度巨大,分属于4门16属,且单属单种现象明显。
3 结论与讨论
引入土壤脲酶活性细菌分析土壤脲酶活性因素发现,脲酶活性细菌、有机质、总氮、C/N、硝酸根离子、无机氮含量和土壤脲酶活性间具有极显著阳性相关性。脲酶活性细菌是产生脲酶的一类重要微生物,直接关系土壤脲酶的性质和数量[18]。土壤C和N是微生物的发酵底物,影响土壤微生物的种类和数量[19],C/N影响微生物的生长速度[20],进而影响土壤脲酶的性质和数量。另外,有机质分解产生的腐殖质能够固定脲酶,增加脲酶的稳定性[21],也可以影响脲酶活性。主成分和通径分析结果显示上述土壤脲酶活性关联因子可以分为两类,一类是脲酶活性控制因素,另一类是反馈作用因素。同时通径分析发现土壤有机质、C/N和土壤脲酶活性细菌是直接作用因素,其余则是间接作用因素。
土壤脲酶活性细菌在尿素氮循环中扮演了重要角色。本研究分离和初步鉴定了20份土壤样品的脲酶活性细菌,共发现5属9种细菌具有脲酶活性,相比较文献中已发现的土壤脲酶活性细菌[22-24],本实验结果具有较低的多样性。这可能是因为研究取样范围狭窄以及分离、人工培养的方式对于微生物具有极强的选择性[19],因此,要准确地阐述土壤脲酶活性细菌的多样性,需要在更为宽泛的尺度进行非培养法(宏基因组或酶切图谱分析)的测试。
脲酶活性细菌在自然界中是丰富多样的,目前已经发现的脲酶活性细菌有内氏放线菌(Actinomycesnaeslundii)、产气杆菌(Aerobacteraerogenes)、巨大芽胞杆菌(Bacillusmegaterium)、支气管波氏杆菌(Bordatellabronchiseptica)、Dactylosprangiumaurantiacum、小球菌(Micrococcuscerficans)、绿脓假单胞菌(Pseudomonasaeruginosa)、苜蓿根瘤菌(Rhizobiummeliloti)、反刍月形单胞菌(Selenomonasruminantium)、桃红荚硫菌(Thiocapsaroseopersicina)、支气管分枝杆菌(Mycobacteriumbronchiseptica)、耶尔森氏假结核病菌(Yersiniapseudotubercuosis)和鼠疫耶尔森菌(Y.Pestis)等43个物种[22-29]。本实验共计发现4门16属26种细菌具有脲酶活性,其中以变形菌门为优势类群,有8属11种;其次是厚壁菌门4属9种;再次是放线菌门3属4种;最后是拟杆菌门1属1种。研究发现的脲酶细菌和已报道的脲酶活性细菌多数不一样,结果证明脲酶活性细菌具有高度多样性。
通过比较不同材料中的脲酶活性细菌发现:样地内土壤关联脲酶活性材料的优势种群是变形菌门,而土壤脲酶细菌的优势种群是厚壁菌门,土壤中的脲酶活性菌株和土壤关联材料中的脲酶活性菌株具有明显的种类差异性,仅变形菌门菌株粪产碱杆菌(Alcaligenesfaecalis)和绿脓假单胞菌(Pseudomonasaeruginosa)能够在2类分离材料中发现。农业上常用沼气渣、动物粪便、农家肥和淤泥作为肥料施入土壤中,本实验样品采集地长期利用以上物质进行施肥,然而本实验结果发现农民长期使用的这些有机肥与施加后的土壤所含脲酶细菌种类上有较大差异。这可能是由于土壤相较有机质而言具有抑菌作用,营养贫瘠的特点[30],外源施加的细菌难以长期定殖。而厚壁菌门菌株不光具有厚壁保护,也能形成芽孢,具有极强的抗逆性,在其适应土壤生态环境中发挥极重要的作用[31]。
综上所述,土壤脲酶活性细菌直接影响土壤脲酶活性,且脲酶细菌在自然界中多样性丰富。然而由于土壤是一个稳定的生态系统,稳定的生态系统对于外来生物具有排斥性,想通过外来生物对土壤环境起到持续的干扰作用,只有创造新的生态系统动态平衡才能实现[32-33]。因此,外源施用菌剂的方式调控土壤脲酶活性,要么增加系统干扰能力,创造一个新的动态平衡才能实现,要么通过保护和调控本土微生物维持一个健康的动态才能成功。
参考文献:
[1]Zantua M I,Bremner J M.Soil Urease Activity of Sundarban Mangrove Ecosystem,India[J].Advances in Microbiolgy,2017,7(8):617-632.
[2]Bachmeier K L,Williams A E,Warmington J R,etal.Urease activity in microbiologically-induced calcite precipitation[J].Journal of Biotechnology,2002,93(2):171-181.
[3]高喜,曹建华,程阳,等.绿肥种植对石灰土脲酶活性与土壤肥力的影响[J].安徽农业科学,2008,36(31):13725-13728.
[4]康莉,周文生,侯翠红.脲酶抑制剂的研究综述[J].河南化工,2009,26(2):8-10.
[5]焦晓光,隋跃宇,张兴义,等.土壤有机质含量与土壤脲酶活性关系的研究[J].农业系统科学与综合研究,2008,24(4):12-14.
[6]安韶山,黄懿梅,郑粉莉.黄土丘陵区草地土壤脲酶活性特征及其与土壤性质的关系[J].草地学报,2005,13(3):233-237.
[7]向仕敏,陆梅,徐柳斌,等.5种林分类型林地土壤氮含量与其土壤微生物学性质的研究[J].西部林业科学,2008,37(1):41-45.
[8]司海丽.几种农业废弃物好氧发酵产物的性状及田间应用效果研究[D].银川:宁夏大学,2014.
[9]黄娟,李稹,张健.改良靛酚蓝比色法测土壤脲酶活性[J].土木建筑与环境工程,2012,34(1):102-107.
[10]袁静,季平扬,袁艺.修正的凯氏法测定土壤中的总氮[J].环境科学与管理,2009,34(2):143-146.
[11]苗艳芳,李生秀,扶艳艳,等.旱地土壤铵态氮和硝态氮累积特征及其与小麦产量的关系[J].应用生态学报,2014,25(4):1013-1021.
[12]郝国辉,邵劲松.土壤有机质含量测定方法的改进研究[J].农业资源与环境学报,2014,31(2):202-204.
[13]王嫒华,段增强,董金龙,等.温室土壤酸化评估的不同pH测定方法比较研究[J].农业环境科学学报,2014,33(11):2164-2170.
[14]王元元.丛枝菌根真菌在四川主要农田土壤中分布特点的研究[D].雅安:四川农业大学,2005.
[15]程曼.黄土丘陵区典型植物枯落物分解对土壤有机碳、氮转化及微生物多样性的影响[D].杨凌:西北农林科技大学,2015.
[16]Sipos R,Székely A J,Palatinszky M,etal.Effect of primer mismatch,annealing temperature and PCR cycle number on 16S rRNA gene-targetting bacterial community analysis[J].FEMS Microbiology Ecology,2007,60(2):341-350.
[17]Sung C H,Chae S H,Im W T,etal.Myroidesmarinussp.nov.,a member of the family Flavobacteriaceae,isolated from seawater[J].International Journal of Systematic and Evolutionary Microbiology,2011,61(4):938-941.
[18]Farshid N,Carlos M M.Effects of soil properties and trace metals on urease activities of calcareous soils[J].Biology and Fertility of Soils,2004,40:359-362.
[19]Liu Q H,Shao T,Zhang J G.Determination of aerobic deterioration of corn stalk silage caused by aerobic bacteria[J].Animal Feed Science and Technology,2013,183 (3):124-131.
[20]Chiarini L,Bevivino A,Dalmastri C,etal.Burkholderia cepacia complex species:health hazards and biotechnological potential[J].Trends in Microbiology,2006,14(6):277-286.
[21]Oka Y.Mechanisms of nematode suppression by organic soil amendments-a review[J].Applied Soil Ecology,2010,44:101-115.
[22]彭仁,邱业先,汪金莲.脲酶高产菌的筛选和产酶条件的研究[J].江西师范大学学报,2003,27(3):273-275.
[23]Varenyam A,Xiangliang P.Characterization of urease and carbonic anhydrase producing bacteria and their role in calcite precipitation[J].Current Microbiol,2011,25(5):127-128.
[24]Li M,Cheng X H,Guo H X.Heavy metal removal by biomineralization of urease producing bacteria isolated from soil[J].International Biodeterioration & Biodegradation,2013,76:81-85.
[25]Kakimoto S,Okazaki K,Sakane T,etal.Isolation and taxonomic characterization of acid urease-producing bacteria [J].Agricultural and Biology Chemistry,1989,53(4):1-8.
[26]Lauková A,Koniarová I.Survey of urease activity in ruminal bacteria isolated from domestic and wild ruminants[J].Microbiology,1995,84(338):7-11.
[27]赵圣国.牛瘤胃脲酶基因多样性分析与脲酶活性调控[D].北京:中国农业科学院,2012.
[28]Ferrero R L,Hazell S L,Lee A.The urease enzymes ofCampylobacterpyloriand a related bacterium[J].Journal of Medical Microbiology,1988,27(1):33-40.
[29]Syed G,Dastager C K,Deepa A P,etal.Potential plant growth-promoting activity ofSerratianematodiphilaNII-0928 on black pepper[J].World Journal of Microbiology and Biotechnology,2011,27(2):259-265.
[30]潘玮,穆常青,蒋细良.木霉的孢子与土壤抑菌作用[J].中国生物防治,2006,22(2):87-91.
[31]Ogawa Y,Ooka T,Shi F,etal.The genome ofErysipelothrixrhusiopathiae,the causative agent of swine erysipelas,reveals new insights into the evolution of Firmicutes and its intracellular adaptations[J].Journal of Bacteriology,2011,8(3):120-124.
[32]Anthony R I,Stephen R C.Stability and diversity of ecosystems[J].Science,2007,317(58):58-62.
[33]Kevin S M.The diversity-stability debate[J].Nature,2000,405:228-233.
