大孔树脂对金钗石斛粗多糖脱色的研究
2018-04-20吕文平寇兴然齐明月张露月刘成祥王洪新
张 玉 , 吕文平 *, 寇兴然 , 齐明月 , 张露月 , 刘成祥 , 王洪新
(1.江南大学 国家功能食品工程技术研究中心,江苏 无锡 214122;2.江南大学 食品学院,江苏 无锡 214122)
金钗石斛 (Dendrobium nobile Lindl)是兰科(Orchidaceae)石斛属(Dendrobium)多年生草本植物[1-2],是中国药典(2010版)记载的名贵中药材,具有滋阴、清热、益胃生津、清肝明目和润肺止咳等功效[3-5]。
多糖是金钗石斛中的主要功效成分之一[6-8],研究表明,金钗石斛多糖具有免疫调节、抑制肿瘤细胞生长、抗衰老等功效[9-10]。传统方法提取的金钗石斛粗多糖往往含有色素等物质。色素的存在不仅影响多糖的品质,而且也是影响金钗石斛多糖价格的重要因素[11]。目前,石斛粗多糖溶液的脱色方法常常采用活性炭吸附法和双氧水氧化法等方法[12],但以上方法耗时长、多糖保留率低,结构易破坏,脱色剂难去除。
大孔树脂作为一种廉价高效的高分子吸附材料,不仅处理量大、好,而且解吸与再生处理容易等[13],被较多地用于多糖的脱色研究[14-15],但尚未见应用于金钗石斛粗多糖脱色的研究报道[16]。本研究筛选出了适合金钗石斛粗多糖脱色的最佳树脂,而且利用响应面法对金钗石斛粗多糖脱色工艺进行了优化[17]。
1 材料与方法
1.1 材料与试剂
金钗石斛材料,来源于贵州赤水国礼金钗石斛发展有限公司;LSA-700、LSD-762树脂,购于西安蓝晓科技新材料有限公司;AB-8、D900、D101树脂,购于沧州宝恩吸附材料科技有限公司;95%乙醇、苯酚、浓硫酸、盐酸及氢氧化钠均为国产分析纯,购于国药集团。
1.2 实验仪器
摇摆式中药粉碎机:温岭市奥力中药机械有限公司产品;DHG-9075A型恒温鼓风干燥箱:金坛市瑞华仪器有限公司产品;HH-4数显恒温水浴锅:常州荣冠实验分析仪器厂制造;电子分析天平:奥豪斯仪器 (上海)有限公司产品;BC-W203旋转蒸发仪:上海贝凯生物化工设备有限公司产品;EX4-1.8离心机:北京京立离心机有限公司产品;UV1800全波长扫描仪:日本岛津公司产品。
1.3 实验方法
1.3.1金钗石斛粗多糖的制备金钗石斛(水分质量分数<12%)粉粹,过60目筛,置于三孔烧瓶中,以料液比 1∶40 (g/mL)加蒸馏水,60 ℃搅拌提取 4 h,过滤、浓缩,加入4倍体积无水乙醇使溶液含醇体积分数至80%,4℃放置12 h,过滤、80%乙醇洗涤得沉淀,40℃真空干燥即得金钗石斛粗多糖[18]。多糖质量分数32.4%。
1.3.2脱色方法与树脂筛选采用静态吸附法[19]对金钗石斛粗多糖溶液进行脱色处理,取2 g预处理过的树脂置于具塞锥形瓶中,加入20 mL质量浓度为2 g/dL粗多糖样品溶液,在转速为120 r/min、温度为30℃的摇床中振荡3 h,观察滤液颜色变化,在450 nm处测定多糖溶液脱色前后的吸光度值,计算脱色率。
1.3.3金钗石斛粗多糖脱色率及保留率的计算金钗石斛粗多糖含量测定方法,采用苯酚-硫酸法[20];脱色前后采用450 nm波长为检测多糖溶液[21]。
多糖脱色率X(%)=(OD脱色前-OD脱色后)/OD脱色前×100%
(1)
多糖保留率 Y(%)=D2/D1(2)
式(2)中,D1、D2:分别为脱色前后溶液中多糖的质量分数。
1.3.4脱色条件优化
1)单因素试验分别取10 mL质量浓度为2 g/dL的样品溶液,采用静态吸附法[22],比较脱色时间、脱色温度、树脂用量对金钗石斛粗多糖溶液脱色效果的影响。
2)响应面试验设计在单因素试验结果的基础上,根据Box-Behnken响应面设计原理[23],选取脱色时间(X1)、脱色温度(X2)和树脂用量(X3)这 3 个因素,采用3因素3水平的Box-Behnken法进行试验设计,试验自变量因素及水平编码见表1。
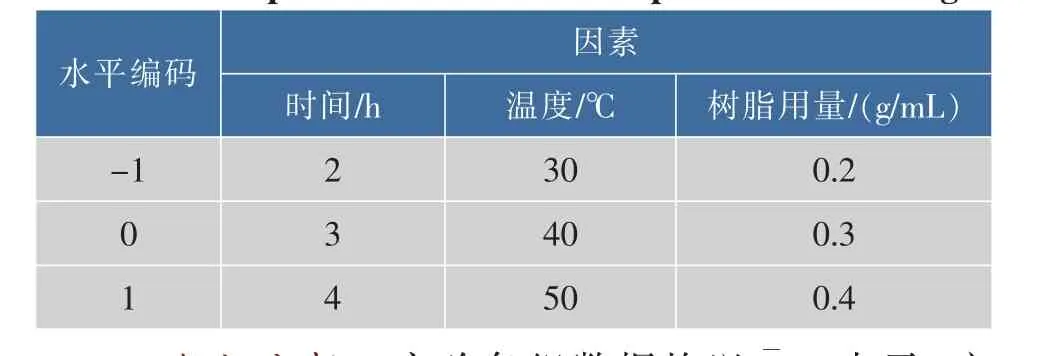
表1 Box-Behnken方案设计的因素及水平编码Table 1 Coded values of corresponding actual values of independent variables in response surface design
1.3.5数据分析实验各组数据均以x±s表示,应用spss20.0软件处理各组数据,采用One-Way ANOVA法分析各组实验数据之间的差异显著关系[24]。其中,P<0.05表示差异显著,P<0.01表示差异极显著。响应面实验中采用Design Expert 8.0软件制图。
2 结果与分析
2.1 树脂的筛选
利用5种大孔树脂对金钗石斛多糖溶液进行脱色处理,D900、LSA700的脱色率分别为83.0%和82.4%,脱色的效果较好,D900的多糖保留率高于LSA762,见表2。因此,本实验中选择D900作为金钗石斛粗多糖脱色的树脂。
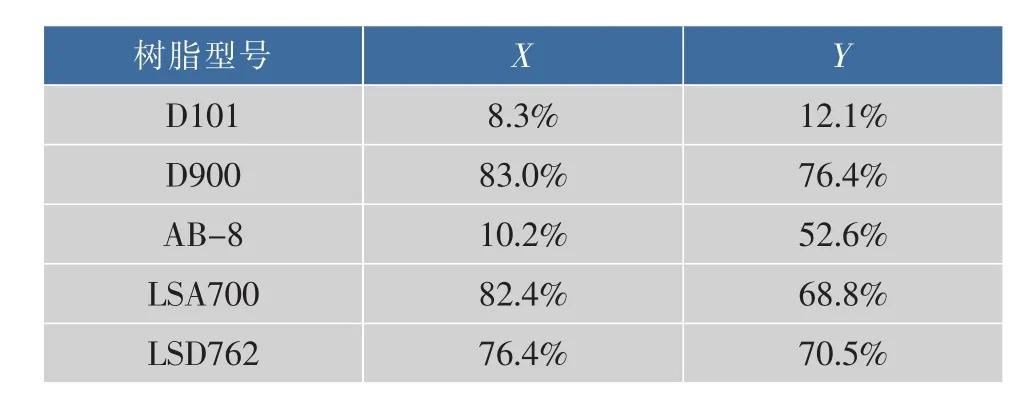
表2 5种大孔树脂脱色率(X)与多糖保留率(Y)Table 2 Assessment of different resinon decolorization rate and polysaccharide retention rate
2.2 单因素实验结果
2.2.1温度对脱色效果的影响脱色率随温度的升高而升高;温度达到50℃之后,脱色率下降,在40℃条件下脱色率达到82.4%,见图1。吸附是放热过程,色素分子的扩散速度岁温度升高加快,利于吸附;当达到吸附平衡时,色素的解吸速度同样会加快,脱色率也会随之下降,因此Box-Behnken设计实验中脱色温度范围应选在30~50℃。
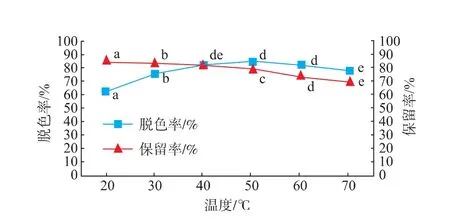
图1 温度对金钗石斛粗多糖脱色率和保留率的影响Fig.1 Effect of temperature on decolorization rateand polysaccharide retention rate
2.2.2树脂用量对脱色效果的影响树脂用量对脱色效果的影响由图2可知,随着树脂用量的增加脱色率不断升高,但当树脂用量高于0.3 g/mL时,金钗石斛粗多糖溶液的脱色率增幅放缓,可能由于树脂与多糖溶液之间达到吸附饱和,因此Box-Behnken设计实验中选择树脂用量范围为0.2~0.4 g/mL。
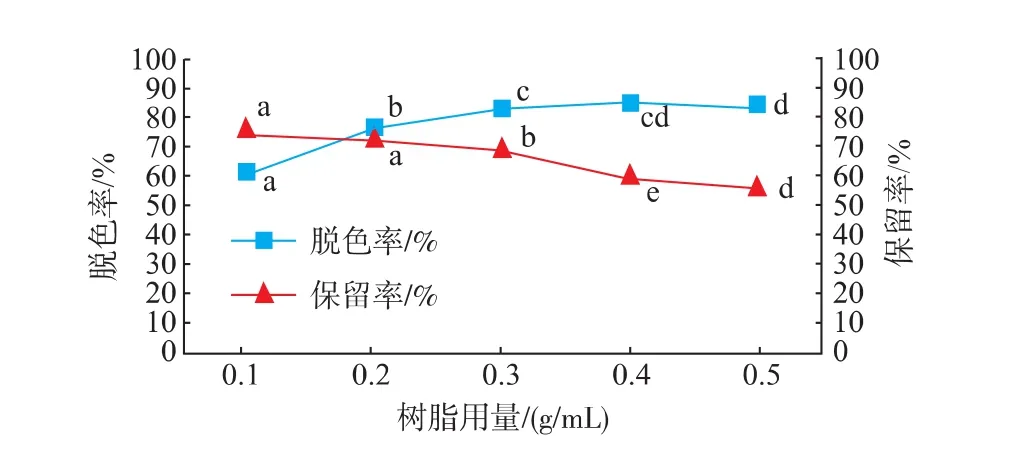
图2 树脂用量对金钗石斛粗多糖脱色率和保留率的影响Fig.2 Effect of resin on decolorization rateand polysaccharide retention rate
2.2.3时间对脱色效果的影响随着吸附时间的延长,金钗石斛脱色率逐渐增大,从第4小时开始,多糖的保留率开始大幅度下降,可能是由于此时树脂的吸附速率大于解吸速率,见图3。因此,多糖保留率随脱色时间的延长,呈现出略微的下降趋势。综合考虑,选择脱色时间2~4 h作为响应面设计实验的脱色时间范围。
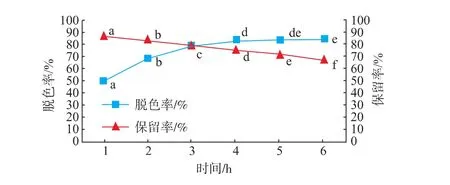
图3 时间对金钗石斛多糖脱色率和保留率的影响Fig.3 Effect of time on decolorization rateand polysac charide retention rate
2.3 响应面实验结果与分析
2.3.1数学模型的建立采用Design Expert8.0软件对脱色率响应值进行回归拟合,建立二次回归模型,得回归方程:
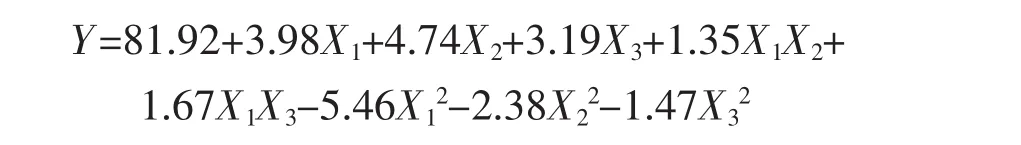
对上述方程进行方差分析,如下表3,R2=0.980 8,说明实验拟合程度良好,失拟项的p值为0.142 6,说明模型失拟项不显著,校正系数说明此模型能说明实验中97.61%的响应值的变化,可用来分析金钗石斛粗多糖脱色率[25]。此外,时间X1、温度X2、树脂用量X3对金钗石斛粗多糖的脱色率有极显著影响;交互作用项均对脱色率有显著影响;其他变量的影响均不显著。由表3可知,影响金钗石斛粗多糖脱色率因素的顺序为 X2(温度)>X1(时间)>X3(树脂用量)。
2.3.22因素间的交互效应分析根据表3,可知X1X2、X1X3对脱色率的影响显著,而X2X3的影响不显著,回归方程作出响应面分析图(见图4):脱色率随 X1X2、X1X3、X2X3的改变而改变,呈现出先增后减的趋势,从响应面的最高点即该模型存在稳定点,且稳定点就是最大值[24]。
2.3.3最优值预测及方法验证软件解析得出金钗石斛粗多糖溶液的最佳脱色条件为:D900树脂用量为0.327 g/mL、脱色时间为3.70 h、脱色温度为39.17℃,在此条件下,金钗石斛粗多糖溶液脱色率理论值为83.4%。考虑到实际操作的方便性和优化结果的准确性,将提取条件更改为D900树脂用量为0.33 g/mL、脱色时间为3.7 h、脱色温度为40℃,3次重复实验测出金钗石斛粗多糖溶液脱色率为82.7%,多糖保留率76.5%,与理论值相比,相对误差仅仅是0.7%。
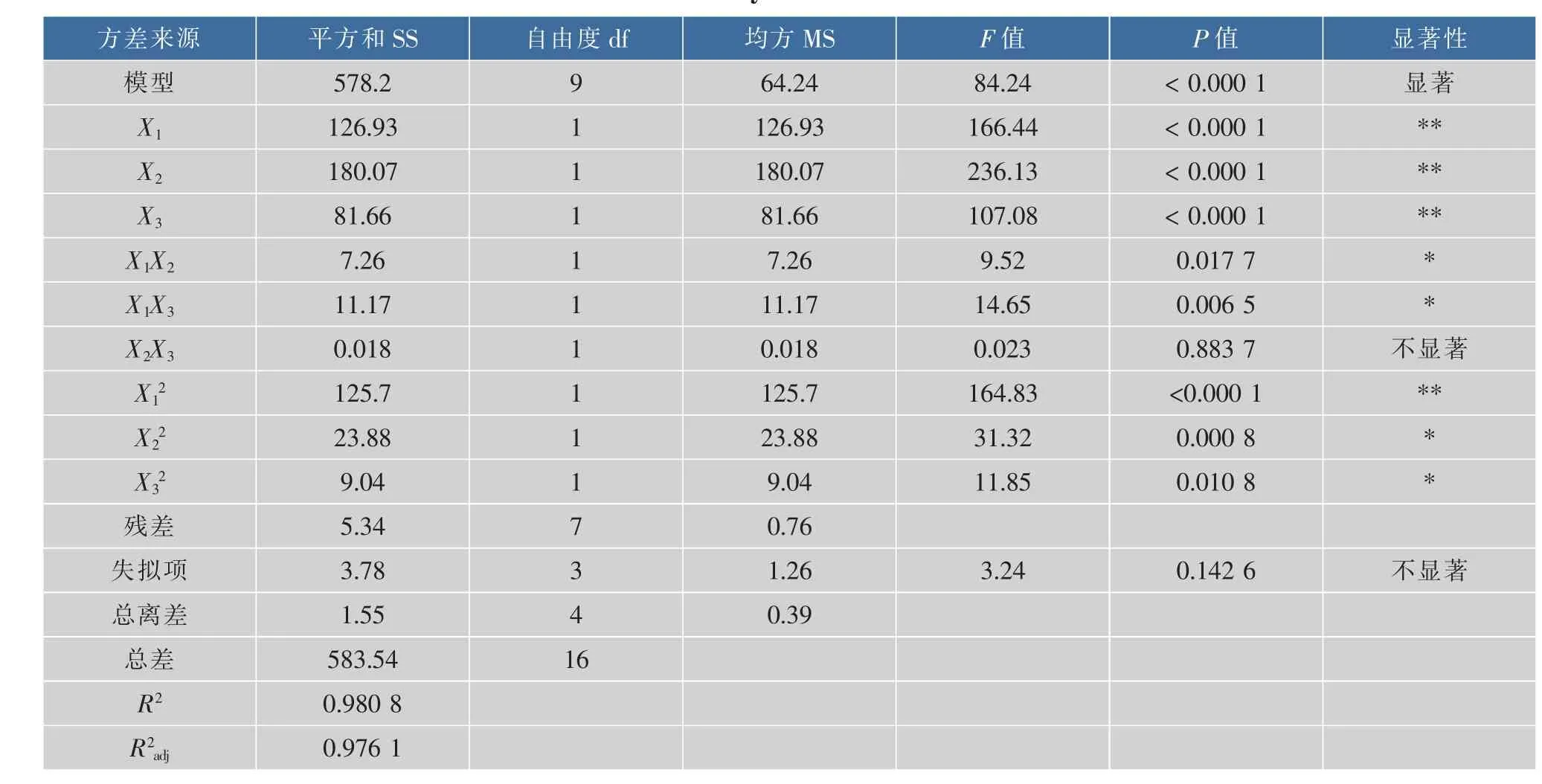
表3 方差分析表Table 3 Analysis of variance table
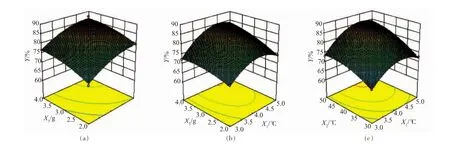
图4 两因素交互影响脱色率的响应面图Fig.4 Response surfaces of the pairwise interactive effects of two decolorization conditions on decolorization rate
本实验中得到的金钗石斛粗多糖脱色工艺,多糖的脱色率保留率分别达到了82.7%和76.5%。而黄森等研究中的石斛多糖脱色率为65.47%;在活性炭脱色时,会残留活性炭;双氧水脱色法对多糖的分子结构具有很大的破坏性[12,26]。因此,本实验优化的工艺不仅仅条件温和,成本低,同时多糖的保留率也较高。
3 结语
本实验作者通过筛选合适树脂,利用RSM响应面法设计金钗石斛的脱色条件,构建脱色率与脱色时间、树脂用量和脱色温度三者之间的数学模型,确定了金钗石斛粗多糖的最佳脱色工艺为:D900树脂用量为3.3 g、脱色时间为3.7 h、脱色温度为40℃,经3次平行实验,得到脱色率为82.7%,保留率为76.5%,可以预见该回归模型具有很好的预测性,对金钗石斛多糖的进一步研究和深度开发具有一定的实践意义。
参考文献:
[1]WANG J H,ZHA X Q,PAN L H,et al.Structural characterization of an immunoactive polysaccharide DNP-W1B from Dendrobium nobile Lindl[J].Chemical Journal of Chinese Universities-Chinese,2013,34(4):881-885.
[2]LUO A,HE X,ZHOU S,et al.Purification,composition analysis and antioxidant activity of the polysaccharides from Dendrobium nobile Lindl[J].Carbohydrate Polymers,2010,79(4):1014-1019.
[3]LIU Ning,SUN Zhirong,LIAO Xiaokang,et al.Mass fraction variation of alkaloids and polysaccharides in Dendrobium nobile Lindl with different harvest time[J].Journal of Jilin University(Science Edition),2010,48(3):5-6.(in Chinese)
[4]LUO A,HE X,ZHOU S,et al.In vitro antioxidant activities of a water-soluble polysaccharide derived from Dendrobium nobile Lindl.extracts[J].International Journal of Biological Macromolecules,2009,45(4):359-363.
[5]LI Mingyuan,DENG Weize,TANG Xianfu,et al.Research status on functional ingredients and health care food of Dendrobium nobile Lindl[J].Journal of Food Science and Biotechnology,2014,33(12):1233-1235.(in Chinese)
[6]SCOPARO C T,DESOUZA L M,RATTMANN Y D,et al.Polysaccharides from green and black teas and their protective effect against murine sepsis[J].Food Research International,2013,53(2):780-785.
[7]WANG S,DONG X,MA H,et al.Purification,characterisation and protective effects ofpolysaccharides from alfalfa on hepatocytes[J].Carbohydr Polym,2014,112:608-614.
[8]NWOKOCHA L M,WILLIAMS P A.Isolation and characterization of a novel polysaccharide from seeds of Peltophorum pterocarpum[J].Food Hydrocolloids,2014,41:319-324.
[9]LIN Ping,BI Zhiming,XU Hong,et al.Advances in studies on pharmacology of plants from Dendrobium Sw[J].China Traditional Herb Drugs,2006,34(11):19-22.(in Chinese)
[10]MOHANTY P,KUMARIA S,TANDON P,et al.High-efficiency cryopreservation of the medicinal orchid Dendrobium nobile Lindl[J].Journal of Plant Biotechnology,2012,10(92):297-300.
[11]YAN Jingfan,JIAO Linshu,ZHANG Shengsheng,et al.Decolorization of carrageenane from eucheumaby two kinds of macroporous resin[J].Food and Fermentation Industries,2015,25(3):121-122.(in Chinese)
[12]LUO A X,FAN Y J.Immune stimulating activity of water soluble polysaccharide fractions from Dendrobium nobile Lindl[J].African Journal of Pharmacy and Pharmacology,2011,5(5):625-626.
[13]KONG Fanli,ZHANG Mingwei,KUANG Ruibing.Decoloration of polysaccharide from litchi fruits by microporous adsorbent resins[J].Food Science and Technology,2012,37(5):180-181.(in Chinese)
[14]LI Yuanyuan,LI Xin,LIANyijun,et al.Optimization for conditions on elaeagnus polysaccharides decoloring material[J].Food Science and Technology,2012,37(3):210-211.(in Chinese)
[15]YUAN Hongbo,ZHANG Jinsong,JIA Wei,et al.Study on decoloration of the low molecular weight Ganoderma lucidum polysaccharides by resin[J].Science and Technology of Food Industy,2009,30(3):204-205.(in Chinese)
[16]CHEN Zhiguo,YE Songhan,FAN Ying,et al.Optimization of extraction technology of polysaccharidefrom Dendrobium nobile and effects on proliferation of mouse splenocytes[J].Chinese Journal of Experimental Traditional Medical Formulae,2011,17(15):28-31.(in Chinese)
[17]HSIEH Y S,CHIEN C,LIAO S K,et al.Structure and bioactivity of the polysaccharides in medicinal plant Dendrobium huoshanense[J].Bioorganic&Medicinal Chemistry,2008,16(11):60-62.
[18]NWOKOCHA L M,WILIAMS P A.Isolation and characterization of a novel polysaccharide from seeds of Peltophorum pterocarpum[J].Food Hydrocolloids,2014,41(3)19-21.
[19]QIN T,CHEN J,WANG D,et al.Optimization of selenylation conditions for Chinese angelica polysaccharide based on immune-enhancing activity[J].Carbohydrate Polymers,2013,92(1):45-46.
[20]ZHANG Qianghua,XIONG Qingping,SHI Yingying.Research on decoloration of stevioside with macroporous resin[J].Science and Technology of Food Industry,2011,32(5):249-251.(in Chinese)
[21]YANG Yongjie,JIANG Ruizhi,CHEN Yinghong,et al.Determination of sugars in heteropolysaccharide by phenol-sulfuricacid method[J].Chinese Traditional Patent Medicine,2005,27(6):706-707.(in Chinese)
[22]HAO Gongyuan,WU Caie,YANG Jianting,et al.Decolorization of crude polysaccharide from ginkgo biloba pollen[J].Food Science,2009,30(14):137-139.(in Chinese)
[23]SHEN Xia,ZHANG Yanhong,YUAN Huihui1,et al.Optimium extraction of polysaccharides from folium Artemisia argyi by response surface methodology[J].Chinese Traditional Patent Medicine,2010,32(1):48-51.(in Chinese)
[24]王军辉.金钗石斛多糖的化学结构与抗白内障活性研究[D].合肥:合肥工业大学,2011.
[25]LIU Junhai,HUAN Gbaoxu,JIANG Dechao.Optimium extraction of polysaccharides from folium Artemisia argyi by response surface methodology[J].Food Science,2009,30(2):114-116.(in Chinese)
[26]HUANG Sen,CHA Xueqiang,LUO Jiangping,et al.Studies on the extraction of active polysaccharide from dendrobium huoshanense with box-behnken method[J].Journal of Chinese Medicinal Materials,2007,30(5):593-594.(in Chinese)
