姜黄素新型纳米乳药动学与生物等效性研究
2018-04-20雷婷婷张景勍张严方
雷婷婷, 张景勍, 张 雪, 张严方, 赵 华
(重庆医科大学 重庆药物高校工程研究中心,重庆 400016)
总姜黄素(Curcuminoids)是从植物姜黄(Curcum Longa L.)的根茎中提取的一种酸性的酚类色素,目前被广泛,目前被广泛用作食品着色剂和食品香料,主要包括姜黄素(Curcumin,Cur)、去甲氧基姜黄素和双去甲氧基姜黄素3种[1],其中Cur在总姜黄素中含量最高,更易获取。大量研究表明,Cur能抑制肿瘤细胞增殖与生长,促进肿瘤细胞凋亡[2-4],使得Cur成为抗肿瘤药物研究热点之一。此外,Cur还具有抗氧化、抗炎、降低血胆固醇等一系列药理作用,且毒副作用小。然而,Cur存在水溶性差、生物半衰期短、口服生物利用度低等缺点,导致其临床应用受到限制[5]。
羟丙基-β-环糊精是一种低毒、安全、有效的药用辅料,将Cur与羟丙基-β-环糊精制成包合物能改善药物水溶性差等问题[6]。磷脂是生物膜的主要成分,广泛用作药物载体,能使药物顺利通过细胞膜,促进药物吸收[7]。研究表明,将多个药物载体组合形成的新载体可能兼具单个载体的优点[8],罗见春等[9-10]制备并评价了 Cur羟丙基-β-环糊精磷脂复合物,考察了其药动学,结果表明将磷脂与羟丙基β-环糊精同时作为药物载体增加了Cur的水溶性,提高了Cur的口服生物利用度。
在此研究基础上,本研究利用纳米乳能增加难溶性药物的溶解度,使药物在体内有一定的缓释作用等优点[11],同时采用了羟丙基-β-环糊精与磷脂2个药物载体联合应用了包合物技术、磷脂复合物技术及纳米乳技术,制备姜黄素新型纳米乳(Curcumin novel nano emulsion, CNNE), 可望能同时解决Cur水中溶解度低、生物半衰期短、口服生物利用度低等问题。本作者首次将Cur制备成CNNE,研究了CNNE的体内药代行为,为本课题组今后CNNE的研究奠定了基础。
1 材料与方法
1.1 材料
1.1.1主要材料、试剂Cur,实验室自制,纯度大于99%;羟丙基β-环糊精,江苏泰兴新鑫医药辅料有限公司产品;卵磷脂,德国Lucas Meyer公司产品;单辛酸甘油酯,河南正通化工有限公司产品;聚氧乙烯蓖麻油,南京都莱生物技术有限公司产品;PEG-400(分析纯),国药集团化学试剂有限公司产品;氯仿(分析纯),国药集团化学试剂有限公司产品;无水乙醇(分析纯),重庆川东化工(集团)有限公司产品;甲酸(分析纯),成都市科龙试剂厂产品;甲醇(色谱纯),美国天地有限公司产品。
1.1.2主要仪器与动物AB204S电子分析天平,购于瑞士Mettler Toledo仪器公司;HWCL-3型集热式恒温磁力搅拌器,购于郑州长城科工贸有限公司;G-16医用离心机,购于北京白洋医疗器械有限公司;RE-2000A旋转蒸发器,购于上海亚荣生化仪器厂;KQ2200B型超声仪,购于昆山市超声仪器有限公司;VOS-30A型真空干燥箱,购于施都凯设备(上海)有限公司;DDS-307A型电导率仪,购于上海仪电科学仪器股份有限公司;QL-901型旋涡混合器,购于海门市其林贝尔仪器制造有限公司;PHS-3C型pH计,购于上海仪电科学仪器股份有限公司;高效液相色谱仪,购于日本岛津公司。
雄性 SD大鼠(250±20)g,由中国人民解放军第三军医大学实验动物中心提供,动物合格证书:SCXK渝2012-0005。
1.2 方法
1.2.1Cur对照品溶液的制备精密称取Cur约10 mg,置100 mL的棕色容量瓶中,用甲醇溶解后稀释至刻度,作为贮备液,精密量取Cur贮备液1 mL,置10 mL的容量瓶中,用甲醇稀释至刻度,即得Cur对照品溶液。
1.2.2CNNE的制备称取Cur 50 mg,羟丙基-β-环糊精187 mg,卵磷脂100 mg溶于20 mL无水乙醇中,置于50℃水浴中磁力搅拌3 h,旋转蒸发除去无水乙醇,真空干燥得固体复合物。另分别称取4.40 g单辛酸甘油酯、3.75 g PEG400、1.25 g聚氧乙烯氢化蓖麻油于烧杯,置于恒温水浴锅中搅拌混匀后加入85 mg固体复合物,待复合物完全溶解,缓慢滴入0.2 mL水,继续恒温水浴搅拌,待溶液变澄清后超声除去气泡,即得油包水型纳米乳CNNE,外观形状为澄清、透明的黄色均一液体。
1.2.3CNNE电导率与pH的测定将制备的CNNE样品分别采用电导率仪与pH计测定电导率与pH,重复测定3次,计算平均值。
1.2.4给药方法和样品收集12只雄性SD大鼠随机平均分成受试组与参比组,给药前禁食12 h,给药途径为口服灌胃给药,受试组给予CNNE(相当于Cur 50 mg/kg)[12-13],参比组给予 Cur(50 mg/kg),2 组分别于给药前取空白血,分别于给药后不同时间点从大鼠眼底取血,收集的血液样品置于含20 μL肝素的离心管中离心,6 000 r/min离心10 min,收集上层血浆,血浆放置-20℃保存,备用。
1.2.5血浆样品的处理与制备精密量取血浆样品 100 μL,加入甲醇 800 μL,涡旋 3 min 后,8 000 r/min离心10 min,吸取上清液,真空干燥挥去甲醇,用150 μL甲醇复溶,12 000 r/min离心5min,吸取100 μL上清液进样检测。
1.2.6色谱条件色谱柱:Hypersil ODS2 C18柱(250 mm ×4.6 mm,5 μm,大连依利特分析仪器有限公司产品);柱温:25℃;流动相:甲醇-0.1%甲酸水溶液(66∶34,体积比);流速:1.0 mL/min;检测波长为 426 nm,进样体积:100 μL。
1.2.7血浆中CNNE含量测定的方法学考察
1)专属性考察取空白血浆、Cur对照品、血浆样品,按1.2.5项下“血浆样品的处理与制备”中操作,按1.2.6项下“色谱条件”进行分析。记录色谱图。
2) 线性关系考察精密量取 12、20、40、100、200、400、800、1 200、1 600 μL Cur对照品溶液分别至10 mL的容量瓶中,加甲醇稀释至刻度,即得Cur系列溶液。精密吸取空白血浆样品100 μL,分别加入不同质量浓度的Cur系列溶液100 μL,即得质量浓度分别为 6、10、20、50、100、200、400、600、800 ng/mL系列标准溶液,按1.2.5进行操作,按1.2.6进行分析,记录峰面积。以Cur质量浓度为横坐标,峰面积为纵坐标进行线性回归,得线性回归方程。
3)回收率考察取空白血浆 100 μL,加入Cur对照品溶液,分别配制成低、中、高质量浓度(10、100、600 ng/mL)的 Cur血浆样品各5份,按 1.2.5项下“血浆样品的处理与制备”中操作,按1.2.6项下“色谱条件”进行分析,记录峰面积,分别计算低、中、高质量浓度(10、100、600 ng/mL)的平均峰面积Ar。另空白血浆100 μL,按1.2.5项下“血浆样品的处理与制备”中操作后加入Cur对照品溶液,分别配制成分别配制成低、中、高浓度(10、100、600 ng/mL)的Cur血浆样品各5份,按1.2.6项下“色谱条件”进行分析,记录峰面积,分别计算低、中、高质量浓度(10、100、600 ng/mL)平均峰面积 As,以峰面积之比 (Ar/As)计算提取回收率;取空白血浆100 μL,加入Cur对照品溶液,分别配制成低、中、高浓度(10、100、600 ng/mL)的 Cur血浆样品各 5 份,按1.2.5项下 “血浆样品的处理与制备”中操作,按1.2.6项下“色谱条件”进行分析,记录峰面积,通过标准曲线计算低、中、高3个质量浓度的实际测得的质量浓度(Cr),以实际测得的质量浓度与理论质量浓度之比(Cr/Cs),考察方法回收率。
4)精密度考察取空白血浆 100 μL,加入 Cur对照品溶液,配制成低、中、高质量浓度(10、100、600 ng/mL)的Cur血浆样品各5份,按1.2.5项下“血浆样品的处理与制备”中操作,按1.2.6项下“色谱条件”进行测定,考察该分析方法的日内精密度,按此方法,连续测定3天,考察该分析方法的日间精密度。
5)血浆样品稳定性 精密量取空白血浆100 μL,加入Cur对照品溶液配成低、中、高3个质量浓度(10、100、600 ng/mL)的血浆样品各 5 份,室温放置8 h、1 d、3 d后,按1.2.5项下“血浆样品的处理与制备”中操作,按1.2.6项下“色谱条件”进行测定,计算平均值与RSD,考察血浆样品室温稳定性;精密量取空白血浆样品100 μL,加入Cur对照品溶液配成低、中、高 3 个质量浓度(10、100、600 ng/mL)的血浆样品各 5份,-20 ℃冷冻保存 7、14、28 d后,按1.2.5项下 “血浆样品的处理与制备”中操作,按1.2.6项下 “色谱条件”进行测定,计算平均值与RSD,考察生物样品-20℃冻存稳定性。
1.2.8CNNE药动学与生物等效性的研究精密量取不同时间点的血浆样品各100 μL,按1.2.5项下“血浆样品的处理与制备”中操作,按1.2.6项下“色谱条件”进行分析,测定血药浓度,并绘制得血药质量浓度-时间曲线。采用药动学软件DAS2.1.1对实验数据进行拟合,计算CNNE和Cur的房室模型与非房室模型主要药代参数,并比较CNNE与Cur的生物等效性。
2 结果与讨论
2.1CNNE的电导率与pH
油包水型CNNE外观性状为黄色澄明的均一液体,电导率为(4.81±0.01) μm/cm,pH 为 5.85±0.01。
2.2 血浆中CNNE含量测定方法学考察
2.2.1方法专属性考察空白血浆、Cur标准品及血浆样品色谱图分别见图1、图2、图3,结果表明,溶剂与血浆中的内源性物质及空白制剂对Cur的测定无干扰。
图1 空白血浆色谱Fig.1 Chromatogram of blank plasma
图2 Cur对照品色谱Fig.2 Chromatogram of Cur standard
图3 血浆样品色谱Fig.3 Chromatogram of plasma sample
2.2.2线性关系考察以Cur峰面积 (A)为纵坐标,Cur浓度(C)为横坐标进行线性回归,线性回归方程为A=103.4C+296.11,r=0.999 9,结果表明,在6~800 ng/mL范围内峰面积与Cur质量浓度呈良好的线性关系。血浆中Cur的检测限(S/N=3)为2 ng/mL,定量限为6 ng/mL。
2.2.3回收率实验结果见表1,血浆样品中Cur低、中、高 3 个质量浓度(10、100、600 ng/mL)的提取回收率与方法回收率均大于85%。结果表明,该分析方法的准确度良好,能够满足体内样品含量测定对回收率的要求。
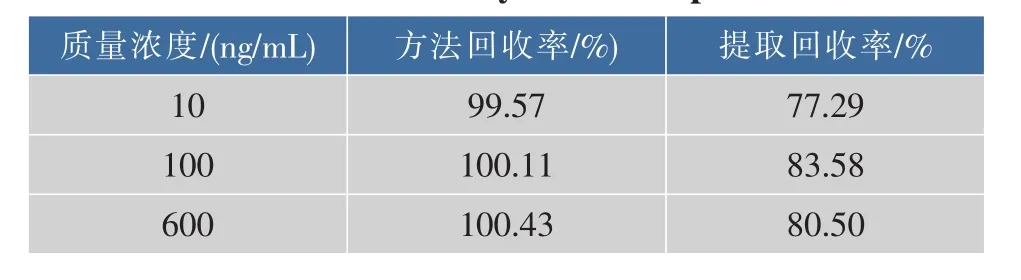
表1 血浆样品中Cur的回收率(n=5)Table 1 Recovery of Cur in plasma
2.2.4精密度实验结果见表2,血浆样品中Cur低、中、高 3 个质量浓度(10、100、600 ng/mL)的日内与日间的RSD均小于15%,表明该分析方法的精密度良好,能够满足体内样品分析的要求。
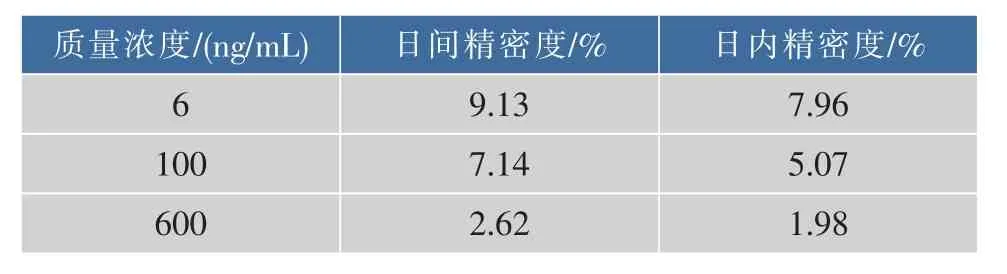
表2 血浆样品中Cur日内和日间精密度(n=5)Table 2 Inter-day and within-day precision of Cur in plasma
2.2.5浆样品稳定性实验结果见表3,血浆样品在室温下放置3 d及-20℃冻存下放置28 d的RSD均小于15%,结果表明,样品在室温下放置3 d和-20℃冻存28 d均稳定。
2.3 CNNE的药代动力学研究
SD大鼠口服灌胃给予Cur(reference)和CNNE(test)后,绘制血药质量浓度-时间曲线,见图4。
由实验结果图4看出,CNNE与Cur灌胃给药后在大鼠体内均有吸收、分布和消除过程,Cur的血药质量浓度Cmax低,在约20 h后大鼠体内的血药质量浓度几乎为零;但CNNE约20 h后仍有较高的血药质量浓度,且能在大鼠体内平稳缓慢地释放药物,当Cur达到最大血药质量浓度时,CNNE仍处于吸收阶段,在约5 h后CNNE的血药质量浓度达到最大,并能在较长时间内能维持较高的血药质量浓度。
采用DAS 2.1.1软件与统计矩法分别计算房室模型与非房室模型的主要药代参数,见表4、表5。根据公式 (相对生物利用度=AUC受试组/AUC参比组×100%)计算CNNE的生物利用度。Tmax与Cmax采用实际测定值。
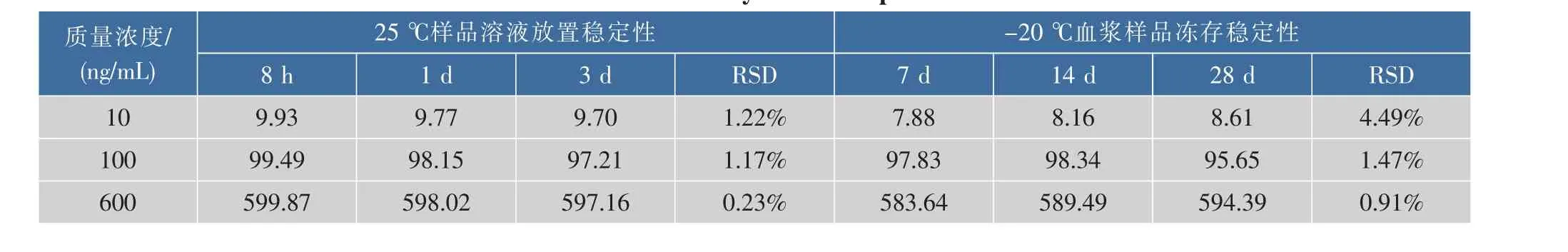
表3 血浆样品中Cur的稳定性(n=5)Table 3 Stability of Cur in plasma
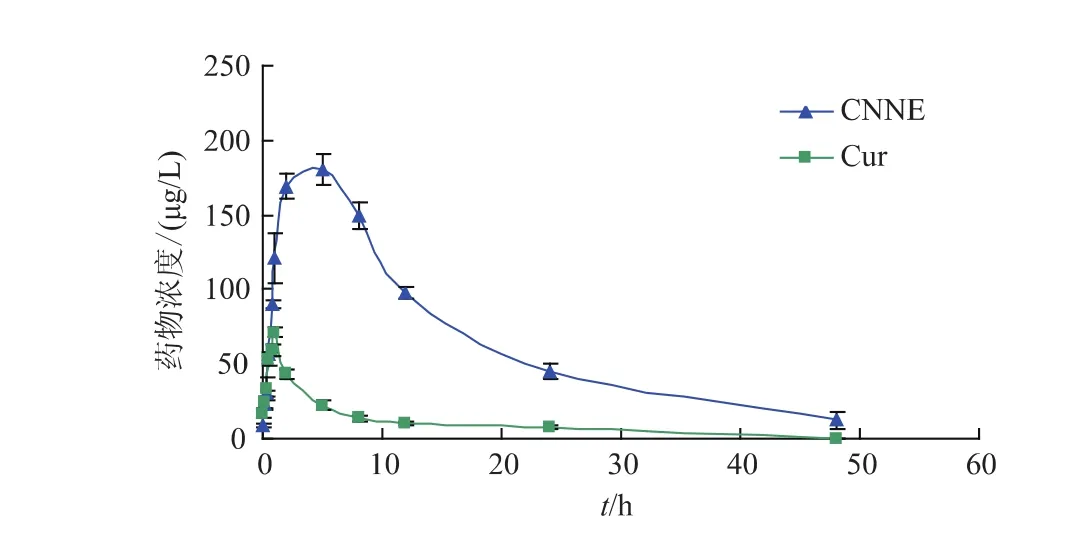
图4 CNNE与Cur口服后药-时曲线(n=6)Fig.4 Concentration-time curves of CNNE and free Cur after oral administration
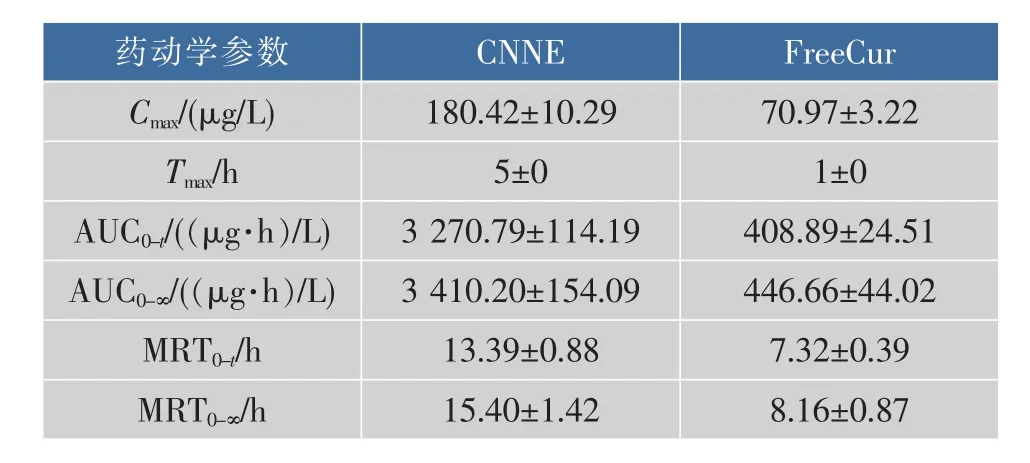
表4 CNNE与Cur的非房室模型主要药动学参数(n=6)Table 4 Non-compartmental model pharmacokinetic parameters of CNNE(n=6)
由表4非房室模型参数看出,CNNE的Cmax为(180.42±10.29) μg/L, 是 Cur的约 3 倍,Tmax为 (5±0),是 Cur的约 5 倍,MRT0-∞为(15.40±1.42) h,是Cur约2倍,CNNE与Cur的AUC0-∞分别为 (3410.20±154.09) (μg·h)/L 和(446.66 ±44.02) (μg·h)/L,计算得到CNNE的相对生物利用度是Cur的763.49%。
根据 AIC(Akaike’s information criterion)最小和R2拟合度越接近1的原则判断CNNE和Cur的房室模型,结果表明,CNNE与Cur均符合二室模型。由表5房室模型参数看出,CNNE口服灌胃后在大鼠体内的Tmax约为5 h,是游离药物Cur的约5倍,血药质量浓度Cmax约为180.42 μg/L,是游离药物Cur的大约2.5倍,t1/2约10h,是游离药物Cur的大约1.7倍,CNNE与Cur的AUC0-∞分别为(3 439.27±180.63) (μg·h)/L 和(482.07±42.14) (μg·h)/L,CNNE的相对生物利用度是Cur的713.44%。
采用房室模型与非房室模型计算得到的主要药代参数基本一致,结果表明,将Cur制备成CNNE后促进了Cur的口服吸收,增大了血药质量浓度,延长了药物的达峰时间和生物半衰期,提高了Cur的生物利用度。
2.4 CNNE的生物等效性分析
CNNE的 AUC0-t和AUC0-∞经对数转换后 [1-2α]90%置信区间分别为129.3% ~131.3%、129.9%~132.1%,均不在等效标准80%~125%范围内;CNNE的Cmax对数转换后 [1-2α]90%置信区间为130.6%~154.1%,不在等效标准70%~143%范围内;采用Tmax实际测定值,进行Wilcoxon检验,检验结果表明,CNNE和 Cur的 Tmax有统计学差异 (P=0.001<0.05)。因此,按照生物等效性标准判定,CNNE与Cur不具有生物等效性。
3 结语
本研究建立了HPLC法测定CNNE大鼠血浆中Cur的含量,血浆中基质与溶剂均对血浆样品的测定均无干扰,该方法专属性强,准确度高,能够满足体内样品分析的要求。多数文献[12-14]中的色谱条件采用乙腈作为有机相,醋酸水溶液作为水相,醋酸含量0.5%~5%,本文中选用甲醇作为有机相,且用量少,从而降低了实验成本,水相中的甲酸用量少,且减少了色谱峰拖尾现象,从而改善了峰型,且制剂和血浆中的其他成分不影响Cur的测定。
本研究首次将磷脂与羟丙基-β-环糊精同时作为辅料,与Cur在一定条件下复合形成固体复合物。磷脂结构中的氮原子有较强的失电子倾向,在一定条件下,与具有给电子能力的Cur中的羟基分子间作用力形成复合物,其中磷脂两端的脂肪链不参与复合,脂肪链自发移动包裹磷脂的极性基团部位,形成具有亲脂性的脂肪链表面,当多个磷脂复合物分子按照此方式有序排列,从而最终形成具有疏水性的球状物[15],羟丙基-β环糊精分子的空腔内部具有疏水性[16],能够将Cur与磷脂形成的疏水性分子包入其空腔内,通过疏水性作用力、范德华力、氢键等分子间作用力形成稳定的包合物,再制备成由水相、油相、乳化剂及助乳化剂按一定比例形成的热力学和动力学均稳定的澄明纳米乳——CNNE,使得CNNE的理化性质和生物特性较Cur均有不同程度的改变。
本实验药代数据采用DAS2.1.1软件与统计矩法所得,房室模型与非房室模型的主要药代参数基本一致,房室模型与非房室模型的相对生物利用度分别为 713.44%、763.49%,罗见春等[10]将 Cur制成磷脂复合物生物利用度提高了约5倍,杨梅等[17]制成去甲氧基姜黄素纳米乳生物利用度提高了约4倍,结果表明将Cur制成CNNE生物利用提高得更明显,提高了约7倍,生物等效性分析结果表明CNNE与Cur不具有生物等效性。综上所述,CNNE促进了Cur的口服吸收,提高了Cur的生物利用度,具有重要的临床意义。
参考文献:
[1]ZHAO Xiaoxia,TIAN Feng,XU Yun.The RP-HPLC determination of curcumin in curcuma[J].Journal of Chinese Materia Medica,2003,28(8):782-783.(in Chinese)
[2]ZHOU M,FAN C,TIAN N.Effects of curcumin on the gene expression profile of L-02 cells[J].Biomed Rep, 2015,3(4):519-526.
[3]SHIRI S,ALIZADEH A M,BARADARAN B,et al.Dendrosomal curcumin suppresses metastatic breast cancer in mice by changing m1/m2 macrophage balance in the tumor microenvironment[J].Asian Pac J Cancer Prev, 2015,16(9):3917-3922.
[4]VALLIANOU N G,EVANGELOPOULOS A,SCHIZAS N,et al.Potential anticancer properties and mechanisms of action of curcumin[J].Anticancer Res, 2015,35(2):645-665.
[5]LAO C D,RUFFIN M T,NORMOLLE D,et al.Dose escalation of acurcuminoid formulation[J].BMC Complement Altern Med,2006,6(4):10-17.
[6]GAO Zhenshen,WANG Lan.Preparation of curcumine-hydroxypropyl-β-cyclodextrin inclusion complex and its properties[J].Chinese Traditional and Herbal Drugs,2012,43(10):1951-1956.(in Chinese)
[7]DING Dongmei,ZHANG Zhenhai,JIANG Yanriong,et al.Advance in studies on phospholipid compound of traditional Chinese medicines[J].China Journal of Chinese Materia Medica,2013,38(13):2046-2050.(in Chinese)
[8]TANG Qin,GU Yong,LI Na,et al.In vivo pharmacokinetics of curcumin-phospholipid complex-chitosan microspheres in rats[J].Chinese Traditional and Herbal Drugs,2013,44(13):1939-1943.(in Chinese)
[9]LUO Jianchun,HE Dan,YIN Huafeng,et al.Pharmacok inetics evaluation of curcumin-phospholipid complex[J].Academic Journal of Second Military Medical University,2014,35(7):754-757.(in Chinese)
[10]LUO Jianchun,HU Xueyuan,WU Jianyong,et al.Pharmacokinetics study on curcumin hydroxypropyl-β-cyclodextrin phospholipid complex in rats[J].Journal of Chinese Medicinal Materials,2015,38(3):572-575.(in Chinese)
[11]LIYanping,ZHANGZhirong.Theresearchprogressofnanoemulsionanditsapplication[J].West China Journal of Pharmaceutical Sciences,2010,24(5):485-488.(in Chinese)
[12]LI Ming,ZHOU Xin,ZHAO Chao,et al.Simultaneous HPLC determination of three main components in Curcuma longa L[J].Chinese Journal of Pharmaceutical Analysis,2008,28(11):1810-1814.(in Chinese)
[13]ZHANG Congcong,JIN Ruomin.Determination of curcumin in plasma and pharmacokinetic properties of curcumin in rats[J].Chinese Journal of New Drugs,2014,23(15):1829-1832.(in Chinese)
[14]WAN Kun,SUN Lili,HU Xueyuan,et al.Pharmacokinetics of curcumin nanostructured lipid carries in rats’ plasma[J].Chinese Traditional Patent Medicine,2014,36(12):2503-2507.(in Chinese)
[15]VERMA P,RAM A,JHA A K,et al.Phosphatidylcholine:A revolution in drug delivery technology[J].Int J Pharm Sci Res,2010,1(2):1-2.
[16]GU Fugen,GAO Yongliang,CUI Fude.Advances in studies of cycldoextrin inclusion ccomplex[J].Chinese Journal of New Drugs,2005,14(6):686-693.(in Chinese)
[17]YANG Mei,ZHANG Jingqing,LI Na,et al.Pharmacokinetic study of demethoxycurcumin nanoemulsion in rats[J].Journal of Third Military Medical University,2015,37(4):346-350.(in Chinese)
