燕麦全麦粉中淀粉消化性的研究
2018-04-20张根义
张 洁, 张根义
(江南大学 食品学院 ,江苏 无锡 214122)
淀粉作为人类最重要的能量来源,其消化性与人体健康密切相关。正常人体摄入含淀粉类食物后,淀粉的种类、食物营养成分以及淀粉的加工处理方法等因素都可影响餐后血糖反应。淀粉消化从口腔中唾液淀粉酶作用下开始,经食管到达胃部,在胃的蠕动和强酸环境下(pH 1.5),食物结构发生改变,变成糊状物,在胃动力作用下进入十二指肠,而后开始消化。胰淀粉酶作用于淀粉分子的α-1,4糖苷键,使淀粉降解为α-极限糊精、麦芽三糖和麦芽糖,再经小肠粘膜上皮细胞刷状缘的异麦芽糖酶、麦芽糖酶、葡萄糖淀粉酶进一步水解为葡萄糖,而后小肠粘膜上皮微绒毛用主动运输的方式吸收葡萄糖进入血液循环系统[1],完成淀粉的消化和吸收。目前,淀粉消化性的测定方法主要分体外消化和体内消化,其中Englyst法[2]模仿了人体的胃肠道环境,是评估淀粉的消化特性的常用方法。
燕麦是公认的有益全麦谷物,被推荐为日常饮食的重要组成部分,其淀粉含量在50%~65%,是重要能源物质,燕麦含有可溶性膳食纤维和不溶性膳食纤维,其中β-葡聚糖是可溶性膳食纤维的主要组成部分,也是燕麦降血糖作用的基础。
虽然β-葡聚糖也被报道具有调节餐后血糖的功能,Wang等[3]研究指出β-葡聚糖的浓度和相对分子质量决定β-葡聚糖在胃肠道的溶解度,从而影响餐后血糖;Hooda等[4]通过动物实验发现,膳食中添加6%的β-葡聚糖可使血糖浓度降低,并且增加短链脂肪酸的含量;Brockman等[5]指出,糖尿病肥胖鼠长期摄入β-葡聚糖可改善血糖的调控,并且可以有效降低脂肪肝。
更有研究指出,燕麦β-葡聚糖并无降血糖的功能。Zhu等[6]发现,高胆固醇病人摄入一定量的β-葡聚糖时,可以有效降低总胆固醇和低密度脂蛋白-胆固醇的含量,却不能有效降低甘油三酯,高密度脂蛋白-胆固醇和血糖的含量。Belobrajdic[7]等研究发现β-葡聚糖可减少进食量,但并没有降低餐后血糖及提高胰岛素敏感性。Panahi[8]等报道β-葡聚糖添加到小麦粉中,人体摄入后,血糖并没有下降;把燕麦麸皮添加到面包中后,人体每天通过面包摄入5.9 g的β-葡聚糖,人体血液生化指标没有明显的改善。
由此可见,目前绝大部分研究都是集中在提取的具有一定纯度的燕麦β-葡聚糖,然而以燕麦粉作为研究对象,探究其中3种主要成分,对共同发挥燕麦全谷物粉对人体益处相互影响的研究报道甚少。本实验,通过将燕麦磨粉,过筛分级成为同时包含淀粉,蛋白质,葡聚糖等主要成分的不同颗粒大小的燕麦粉,探究燕麦粉中固有的β-葡聚糖对燕麦粉消化的影响。研究结果可为制备以燕麦为原料的功能食品提供理论基础。
1 材料与方法
1.1 材料与仪器
燕麦,产自黑龙江。燕麦β-葡聚糖:张家口市一康生物科技有限公司产品。万能粉碎机;水浴锅;磁力搅拌器;电子天平;马福炉;微量凯氏定氮蒸馏装置器;电热恒温鼓风干燥箱;RVA-4C快速黏度分析仪;UV2000型分光光度计;RJ-LD-ⅡB离心机;酶标仪;pH计;涡旋振荡器;激光粒径分析仪,激光共聚焦显微镜。
1.2 实验方法
1.2.1不同颗粒大小燕麦粉以及燕麦淀粉的制备将燕麦磨粉,分别用60目、80目、100目筛子过筛,得到4种不同级别颗粒大小的燕麦粉,命名为A、B、C、D颗粒,其中A颗粒最大,D颗粒最小,并用激光粒径分布仪器测定粒径分布。分析不同颗粒大小燕麦粉中蛋白质(GB/T 5009.5-2003),脂肪(GB/T 5009.6-2003),水分(GB/T 5009.3-2003),灰分(GB/T 5009.4-2003)的质量分数。采用总淀粉试剂盒(爱尔兰,Megazyme)测定淀粉的质量分数。采用刚果红法,测定β-葡聚糖(O-glu)的质量分数。
燕麦颗粒磨粉过60目筛,按固液比1∶4(g/mL)进行乙醇脱脂4 h,然后1 500 r/min,离心5 min。通风干燥沉淀,得到脱脂粉。按固液比1∶6(g/mL)将脱脂粉与0.01 mol/L NaOH混合,调pH至11,30℃搅2 h。混合液过80目筛,除去筛上物,滤液3 500 r/min,离心15 min。去除上清液以及褐色沉淀层,收集下层白色沉淀。加水分散白色沉淀,再次离心,重复至上清液澄清,无褐色沉淀。50℃,干燥白色沉淀。粉碎过筛80目,即为燕麦纯淀粉(OS)[9]。采用氧化酶法测定葡萄糖浓度,转化为淀粉含量,即可得淀粉纯度。
1.2.2β-葡聚糖对燕麦粉消化的影响称取A、B、C、D级别的燕麦粉(总淀粉)各50 mg,加入5 mL pH 5.2的醋酸缓冲液,加入一颗磁力搅拌珠,95℃水浴中糊化20 min。冷却至37℃后,加入已预热至37 ℃的 5 mL (2 900 U/mL,150 U/mL)α-淀粉酶与淀粉葡萄糖苷酶的混合液中,37℃震荡酶解,在反应 20、40、60、80、100 min 和 120 min 时取 样 200 μL加入到 800 μL无水乙醇中灭酶[10-11]。经 10 000 r/min离心3 min,采用氧化酶法测定上清液中葡萄糖浓度。
称取称取A,D级别的燕麦粉 (总淀粉)各50 mg,加入5 mL pH 5.2含有不同浓度的β-葡聚糖酶的醋酸缓冲溶液,其余水解测定方法同上。
称取纯燕麦淀粉 50 mg,加入不同质量分数(0,5%,10%,15%)的 β-葡聚糖,其余水解测定方法同上。
1.2.3蛋白质对燕麦粉消化影响称取A,D级别的燕麦粉(淀粉50 mg),加入4 mL pH 2.5含有不同胃蛋白酶的醋酸缓冲溶液,37℃震荡酶解1 h。然后,95℃水浴糊化20 min,冷却至37℃后,调节pH到5.2。加入已预热至37℃的5 mL(2 900 U/mL,150 U/mL)α-淀粉酶与淀粉葡萄糖苷酶的混合液中,37 ℃震荡酶解, 在反应 20、40、60、80、100 min和 120 min时取样200 μL加入到 800 μL无水乙醇中灭酶。经10 000 r/min离心3 min,采用己糖激酶法测定上清液中葡萄糖浓度。
1.2.4燕麦淀粉糊化曲线特征按照AACC(1995,61-02)要求,取 A、B、C、D 级别的燕麦粉(淀粉基重1.00 g),加入蒸馏水25 mL。测定过程如下:从50℃开始以每分钟增加12℃至95℃,然后在95℃保温2.5 min,冷却过程是从95℃开始以每分钟降低12℃至50℃,然后在50℃保温2 min。搅拌器10 s内转速为960 r/min,之后维持在160 r/min。快速黏度分析仪(RVA)特征值主要用峰值黏度、崩解值、最终黏度和消减值等表示。
称取纯燕麦淀粉1 g,分别添加质量分数为0,5%,10%,15%的β-葡聚糖,加入蒸馏水25 mL,糊化过程同上。
称取A、D级别的燕麦粉 (淀粉基重1.00 g)加入25 mL pH 7.5含有蛋白酶K(15 U/g蛋白酶K/蛋白质底物)的磷酸缓冲溶液,37℃震荡酶解1 h。对照组为A,D级别燕麦粉(淀粉基重1.00 g)为加25 mL pH 7.5,37℃的磷酸缓冲溶液,37℃震荡1 h,糊化过程同上。
1.2.5不同颗粒大小燕麦粉激光共聚焦显微镜观测将A、D级别燕麦粉加到pH 7磷酸缓冲溶液中,避光染色标记。用FITC I标记蛋白(最大吸收光波长为490~495 nm,最大发射光波长为525~530 nm);采用荧光染色剂(Fluorescent Brightener 28)标记β-葡聚糖 (吸收波长500 nm,最大发射波长400~410 nm)呈蓝色;采用罗丹明B标记淀粉(最大吸收波长552 nm,激光峰值波长610 nm)。避光标记1 h,经 3 000 r/min离心3 min,除去多余染料。采用激光共聚焦显微镜观察。
1.2.6不同颗粒大小燕麦粉餐后血糖曲线小鼠禁食12 h,测完空腹血糖之后,将冷却至 37℃的A、D 级别颗粒燕麦糊(0.5 g/(kg·bw)) 的剂量对小鼠进行灌胃,并在灌胃后的 15、30、45、60、90 min 和120 min时于尾静脉取血,采用血糖测试仪测定血液中葡萄糖的浓度(mmol/L)。
2 结果与分析
2.1 不同颗粒大小燕麦粉粒径分布
燕麦粒磨粉,分别过60目、80目、100目筛,成A、D、C、D 4种级别颗粒大小的燕麦粉。通过激光粒径分布仪器检测粒径,按面积计算得到A、D、C、D平均粒径(Ma)分别为 349.9,126.2,36.8,26.9 μm,各尺寸之间具有显著差异。
2.2 基本成分的测定
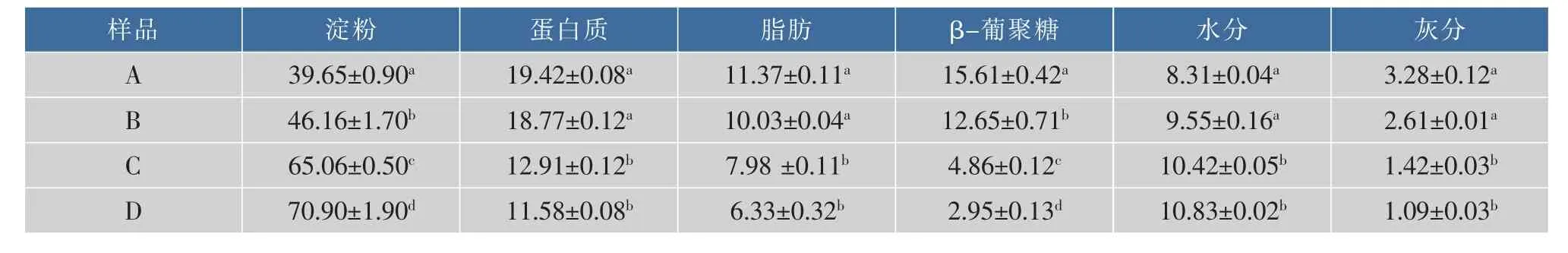
表1 不同颗粒大小燕麦粉成分质量分数分析Table 1 Composition of the different particle of oat flour(x±SD) %
提取的燕麦粉纯度为 99.9%,A、D、C、D 4种级别颗粒大小的燕麦粉基本成分分析如表1。其中蛋白质和β-葡聚糖质量分数都具有显著差异,可以检测燕麦粉中固有的β-葡聚糖对燕麦粉中淀粉消化的影响。
2.3 β-葡聚糖对燕麦淀粉消化性的影响
2.3.1不同颗粒大小燕麦粉体外消化实验A、B、C、D不同级别颗粒大小的燕麦粉,体外模拟消化结果如图1所示。从图可以看出颗粒越细,淀粉消化速度越快。水解20 min,A和B颗粒燕麦粉水解后葡萄糖浓度为2.3,3.3 mmol/L,水解速率不存在显著差异;C和D颗粒燕麦粉水解后葡萄糖浓度为6.0,6.3 mmol/L,水解速度不存在显著差异,A(B)和C(D)颗粒燕麦水解存在显著差异。水解120 min时,同样存在显著差异。一方面可能是由于颗粒越粗,β-葡聚糖以及蛋白质对淀粉的包裹严密,糊化过程中淀粉溶出率少,α-淀粉酶接触淀粉越慢,导致消化越慢;另外一方面由于A、B、C、D含有的β-葡聚糖质量分数约 15.6%、12.7%、4.9%、2.9%,β-葡聚糖质量分数越高,越延缓淀粉消化,可能是从理化性质上造成这一影响;同时A、B、C、D蛋白质质量分数约为19.4%、18.8%、12.9%、11.6%,蛋白质的质量分数在一定程度上也可能会延缓燕麦淀粉的消化。
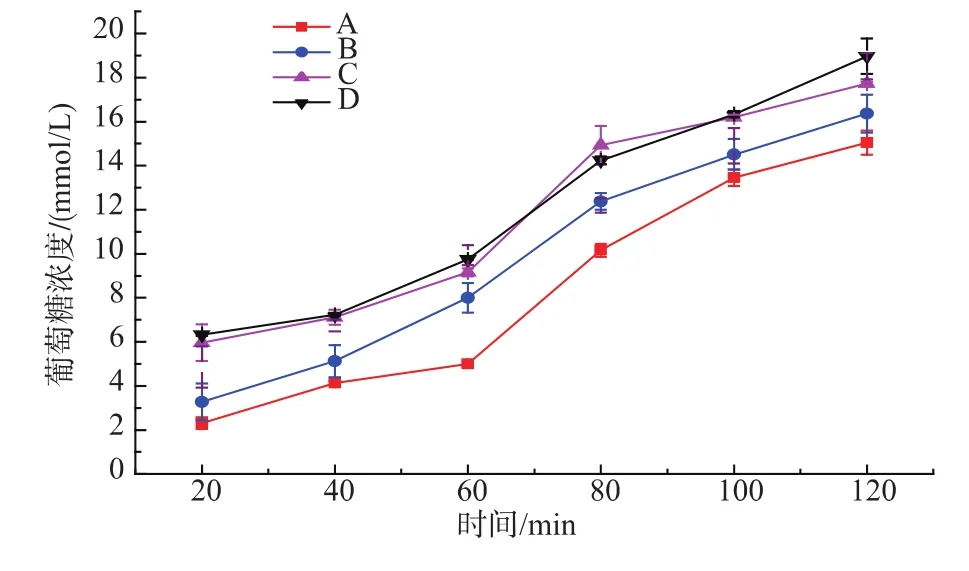
图1 不同颗粒大小燕麦粉体外消化Fig.1 In vitro digestion of different particle oat flours
2.3.2不同级别颗粒燕麦粉添加β-葡聚糖酶后体外消化实验由于A、D级别颗粒燕麦粉含有β-葡聚糖以及蛋白质质量分数具有极显著差异,故选择A、D颗粒燕麦粉作为研究对象,添加葡聚糖酶以后,测定淀粉水解速度,结果如图2所示。A颗粒,加入不同浓度的β-葡聚糖酶水解β-葡聚糖后,从体外消化结果来看,在水解20 min时,A颗粒燕麦粉水解后葡萄糖浓度为2.3 mmol/L,当加入0.02 mg/mL的葡聚糖酶以后,葡萄糖浓度为4.8 mmol/L,与原A颗粒差异极显著,当加入0.002 mg/mL的葡聚糖酶以后,葡萄糖浓度为3.0 mmol/L,与A颗粒差异亦显著;在水解120 min时,3组样品中葡萄糖浓度差异都极为显著。说明β-葡聚糖会延缓燕麦淀粉的消化,并且这与β-葡聚糖的质量分数有关,质量分数越大,淀粉消化越慢。当选取D颗粒时,上述结果也得到了验证。
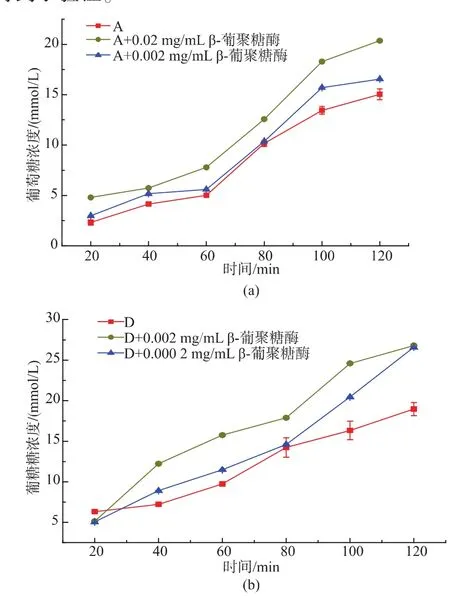
图2 β-葡聚糖对燕麦粉消化性影响Fig.2 Effect of oat-glu on oat flours Digestion
2.3.3燕麦淀粉添加β-葡聚糖体外消化实验提取纯燕麦淀粉,加入不同质量分数的β-葡聚糖(≤15%,干重),体外消化结果图3所示,在一定质量分数范围内,添加β-葡聚糖以后,体外水解速度并无显著下降。说明外加的β-葡聚糖并不能有效降低燕麦粉中淀粉的消化,而燕麦粉中固有的β-葡聚糖才具有延缓淀粉消化的功能。
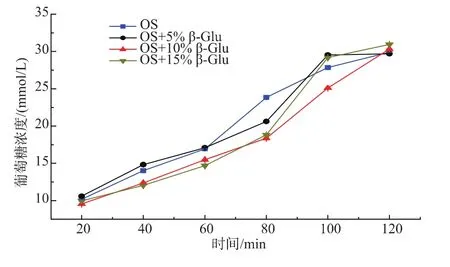
图3 β-葡聚糖对燕麦淀粉消化性影响Fig.3 Effect of oat-glu on oat starch digestion
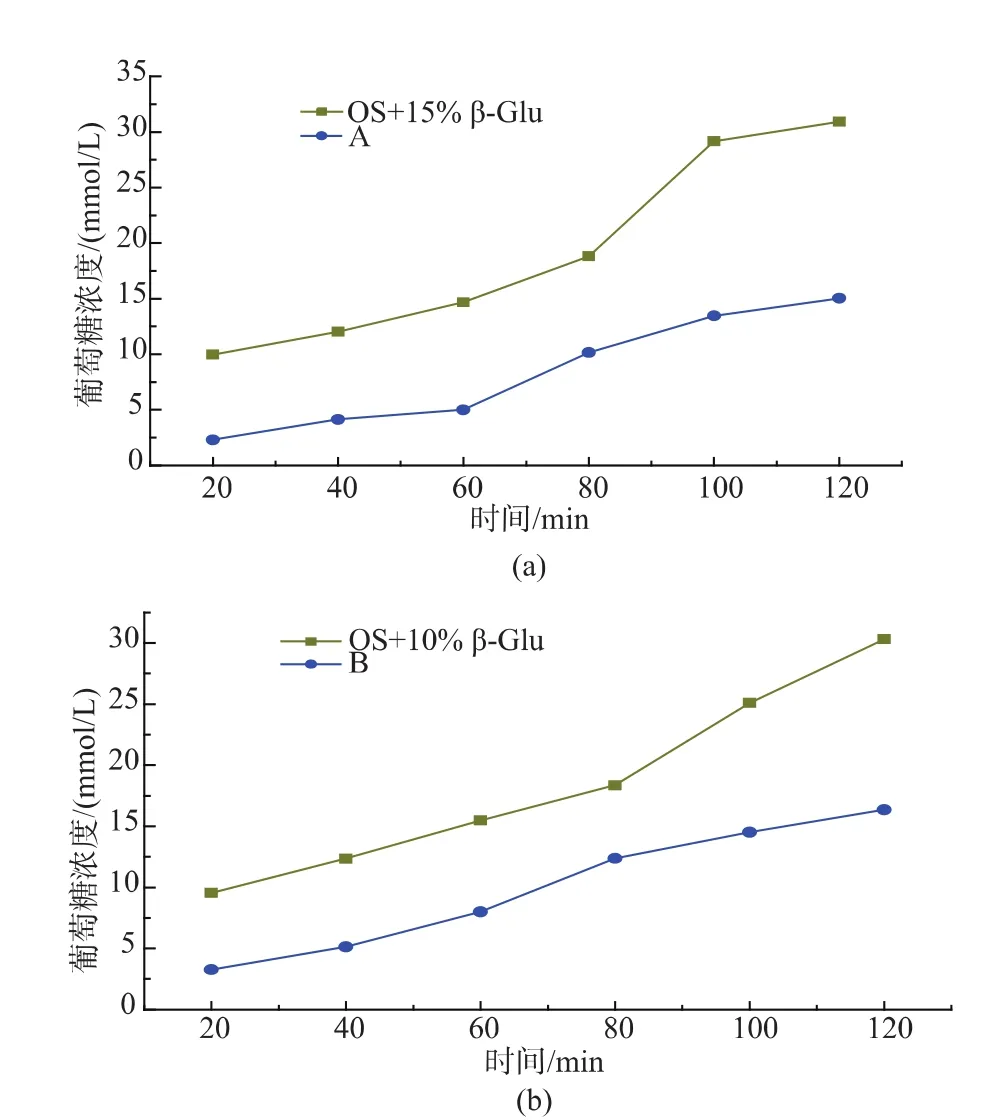
图4 β-葡聚糖存在形式对燕麦淀粉消化性影响Fig.4 Effect of oat-glu form on oat starch digestion
由于A颗粒燕麦粉含有β-葡聚糖质量分数约为15.6%,当纯燕麦淀粉(OS)加入质量分数15%的β-葡聚糖以后,水解速度如图4(a)所示。2组样品含有等量的β-葡聚糖,水解速度却有极为显著的差异,A颗粒燕麦粉的水解速度,显著低于纯燕麦淀粉加β-葡聚糖组,再次验证燕麦粉中固有的β-葡聚糖具有延缓燕麦淀粉消化的作用。
2.4 蛋白质对燕麦粉消化影响
将A、D颗粒燕麦中的蛋白质水解后,模拟淀粉体外消化。A颗粒燕麦粉蛋白质质量分数为19.5%,水解掉蛋白质后消化速度和A颗粒燕麦粉相比,极显著提高(P<0.01)。而D颗粒中的蛋白质质量分数为11.6%,水解蛋白质后消化速度显著增加 (P<0.05)。说明燕麦粉中本身存在的蛋白质在一定程度上也会延缓淀粉消化,且与蛋白质质量分数有关。
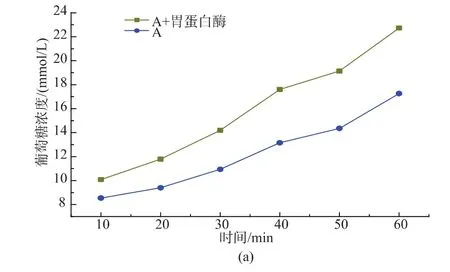
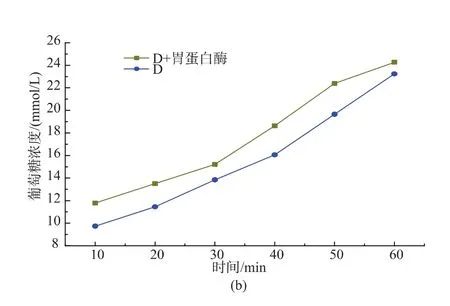
图5 蛋白质对燕麦粉消化性影响Fig.5 Effect of protein on oat flour digestion
2.5 燕麦淀粉糊化曲线特征
2.5.1不同颗粒大小燕麦粉糊化曲线燕麦粉淀粉质量分数最多,因而主要决定淀粉糊化粘度,这与直链淀粉和支链淀粉的比例以及分支链长分布有关[12],支链淀粉导致淀粉颗粒的膨胀和粘性,而直链淀粉抑制膨胀。而Liu等指出在燕麦粉整个糊化体系中,葡聚糖影响最大,淀粉次之,再次之就是蛋白质[13-14]。不同颗粒大小的燕麦粉(淀粉基重1 g)糊化特征曲线如图6所示,颗粒越大,β-葡聚糖和蛋白质含量越大,最终糊化粘度越大,说明β-葡聚糖和蛋白质对粘度有影响,且他们的联合作用大于淀粉的单独作用。燕麦粉糊化后,粘度增大,粘度越大,淀粉消化越慢。
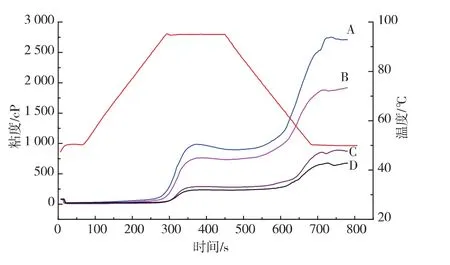
图6 不同颗粒大小燕麦粉糊化曲线Fig.6 Pasting properties of different particle oat flours
A、B、C、D本身含有的燕麦淀粉类型不存在差异,而从表2中可以看出,燕麦颗粒越小,衰减值越小,其中A颗粒燕麦衰减值最大,为92 cP。在溶胀期间,A颗粒燕麦粉溶胀,不断破裂,热糊相对不太稳定,而D颗粒达到峰值以后,热糊粘度较为稳定。说明A,D颗粒燕麦粉中的β-葡聚糖和蛋白质对淀粉的包裹也存在差异,并且在糊化过程中,空间结构可能会再次改变,从而影响淀粉的消化速度。
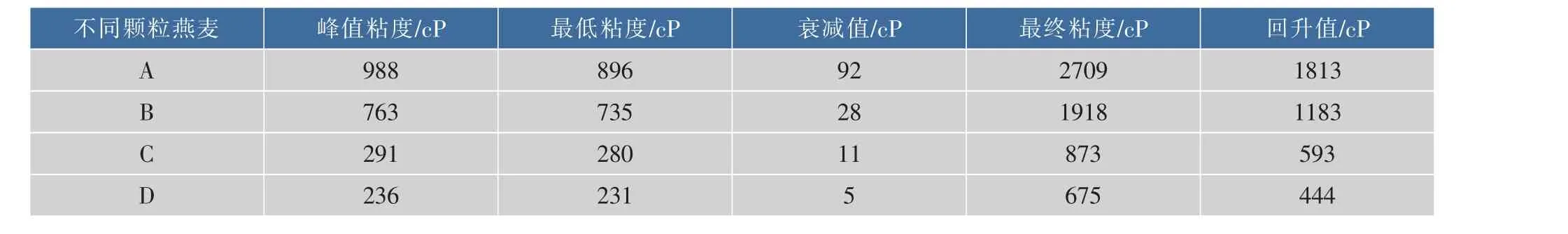
表2 不同颗粒大小燕麦粉的糊化特性Table 2 Pasting characteristics of different particle of oat flour
2.5.2β-葡聚糖对燕麦淀粉糊化的影响燕麦β-葡聚糖具有降低胆固醇、促进胰岛素分泌和调控血糖作用,这些生理活性与燕麦β-葡聚糖能够增加肠道内消化物粘度相关[15]。β-葡聚糖的相对分子质量和质量浓度影响β-葡聚糖的粘度[16],但当低相对分子质量β-葡聚糖和高相对分子质量β-葡聚糖溶液混合时,低相对分子质量β-葡聚糖的聚合链能与高相对分子质量β-葡聚糖聚合链之间发生交缠作用,也能够快速网络化形成凝胶[17]。然而这一研究,都是针对提取的,具有一定纯度的β-葡聚糖的研究。实验发现,β-葡聚糖本身不具有糊化特征,β-葡聚糖的质量浓度为6 mg/mL时,粘度在11~14 cP,纯燕麦淀粉分别添加质量分数5%,10%,15%的β-葡聚糖(淀粉基重1 g)时,对淀粉本身终粘度并无著影响。
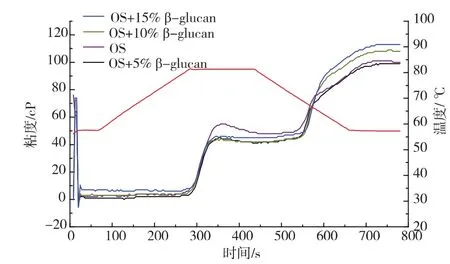
图7 β-葡聚糖对燕麦淀粉糊化影响Fig.7 Effect of oat-glu on oat starch pasting
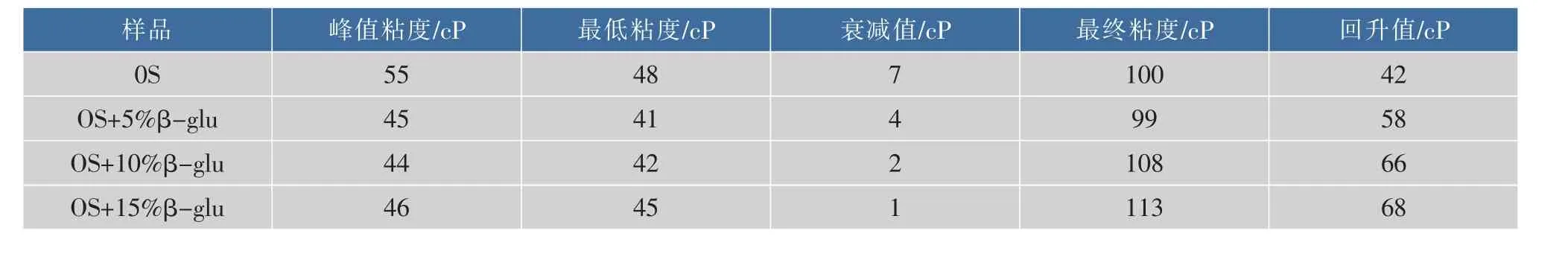
表3 β-葡聚糖对燕麦淀粉糊化曲线的影响Table 3 Effect of oat-glu on oat starch pasting characteristics
虽然β-葡聚糖在一定程度影响衰减值,但是表3和表2相比可以看出,额外添加β-葡聚糖后,燕麦淀粉糊化最终粘度是小于A、B、C、D颗粒燕麦粉的糊化粘度,衰减值也更小。在一定范围以内,额外添加的β-葡聚糖,对燕麦淀粉糊化终粘度无显著影响,说明燕麦粉颗粒中固有的β-葡聚糖对燕麦糊化后的粘度有重要影响,燕麦粉糊化后,粘度越大,消化越慢。
2.5.3蛋白质对燕麦粉糊化的影响A、D燕麦颗粒粉中添加蛋白酶K以后,对于A颗粒燕麦粉来说,最终粘度无显著差异,而D颗粒燕麦粉最终粘度具有显著差异,见图8。一方面,是由于A颗粒燕麦中本身含有的β-葡聚糖较多,蛋白质水解后,对最终粘度影响不太;而D颗粒燕麦粉中β-葡聚糖质量分数较少,蛋白质水解以后最终粘度发生显著变化,说明葡聚糖对淀粉粘度的作用远远大于蛋白质,而蛋白质延缓淀粉消化,主要不是从粘度上影响,可能还会存在其他机理。
2.6 不同颗粒大小级别燕麦粉激光共聚焦显微镜观测
A和D颗粒燕麦粉中,β-葡聚糖和蛋白质以及淀粉存在一定的交联,通过图9可以看出,A颗粒中,β-葡聚糖以及蛋白质质量分数较多,交联密度大于D颗粒,说明交联密度越大,越延缓淀粉的消化。这种交联结构可能包括空间物理结构,也可能存在化学结构交联。这种交联结构对燕麦淀粉消化可能具有重要影响。
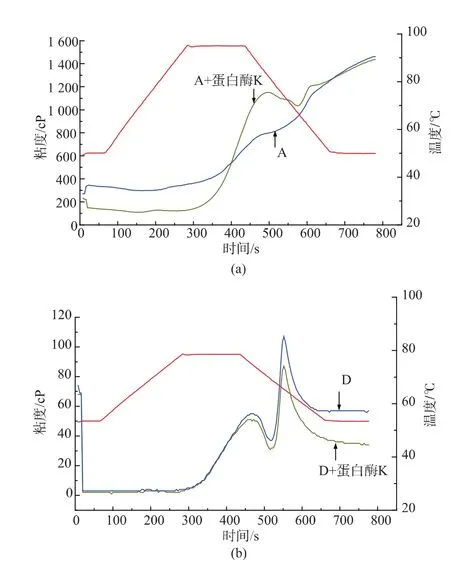
图8 蛋白质对燕麦粉消化性影响Fig.8 Effect of protein on oat flour pasting
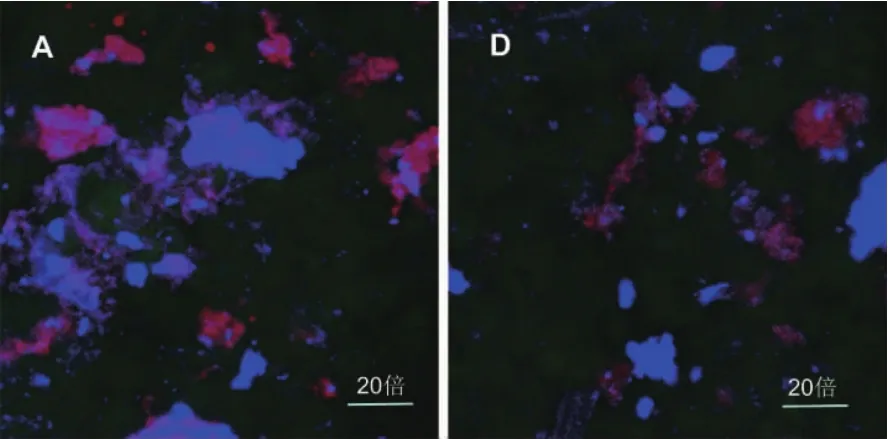
图9 不同级别颗粒燕麦粉共聚焦显微镜图Fig.9 CLSM images of different particle oat flour
2.7 不同颗粒大小燕麦粉餐后血糖曲线
餐后血糖的动态变化既反映外源性受试物的消化吸收状况,又反映食物对血糖的影响。从图10可以看出A和D颗粒燕麦粉的餐后血糖曲线不同。45 min时,A颗粒餐后血糖值较D颗粒燕麦粉餐后血糖峰值低,且有显著差异。说明燕麦粉颗粒越大,即固有β-葡聚糖和蛋白质质量分数越大,燕麦粉在体内消化速度越慢。Chanrashekar[18]研究表明蛋白质对淀粉具有包埋作用,从而抑制直链淀粉的回生,不利于抗性淀粉的生成。而淀粉消化速度减慢,说明燕麦粉中β-葡聚糖可能与蛋白质有一定的交联,这种交联结构在一定程度上延缓燕麦淀粉的消化。
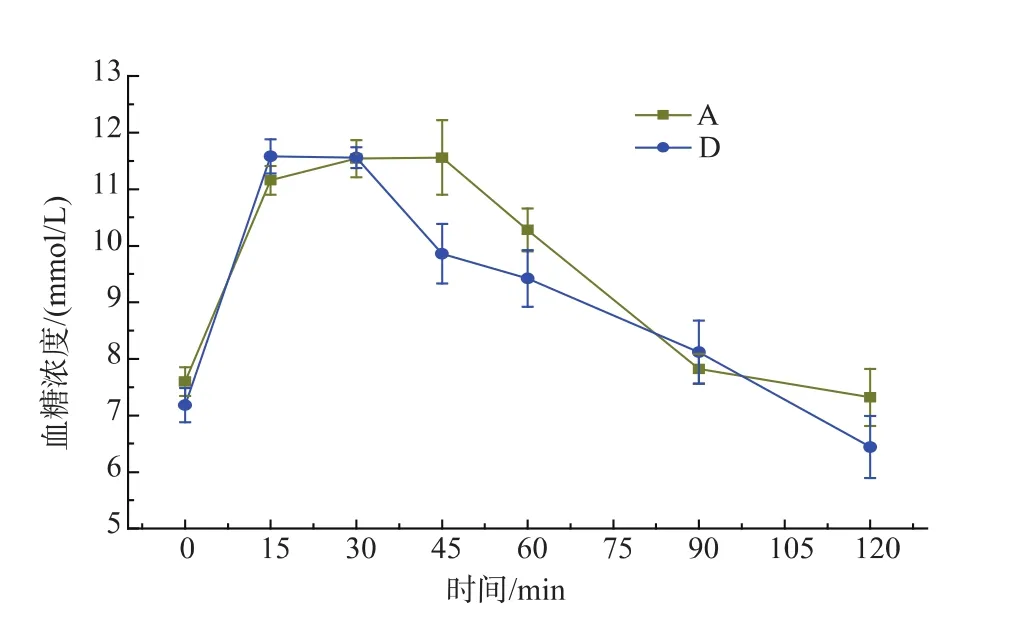
图10 A、D颗粒燕麦粉餐后血糖曲线Fig.10 Postprandial glucose curve of A,D oat flour
3 结 语
本文作者通过将燕麦颗粒磨粉,过筛分级成不同颗粒大小的燕麦粉,模拟燕麦粉体外消化,探究β-葡聚糖对燕麦淀粉消化的影响。结果显示燕麦粉中,固有的β-葡聚糖和蛋白质的存在会延缓燕麦淀粉的消化;而额外添加β-葡聚糖到纯燕麦淀粉中,β-葡聚糖并不会延缓燕麦淀粉消化。说明,燕麦粉中β-葡聚糖本身存在一定的空间结构,并且与蛋白质有一定的交联,这种空间结构,在一定程度上延缓燕麦淀粉的消化。通过对这一结构的进一步研究,可以更好地理解β-葡聚糖的结构与其影响淀粉消化的关系,为以燕麦为基础的功能食品的加工提供一定的理论基础。
参考文献:
[1]QUEZADA CR.Luminal substrate"brake"on mucosal maltase-glucoamylase activity regulates total rate of starch digestion to glucose[J].Journal of Pediatric Gastroenterology and Nutrition,2007,45(1):32-43.
[2]ENGLYST H N,CUMMINGS J H.Non-starch polysaccharides(dietary fiber) and resistant starch[J].Advances in Experimental Medicine and Biology,1990,270:205-215.
[3]WANG Q,ELLIS P R.Oat beta-glucan:physico-chemical characteristics in relation to its blood-glucose and cholesterol-lowering properties[J].The British Journal of Nutrition,2014, 112(2):S4-S13.
[4]HOODA S.Dietary oat beta-glucan reduces peak net glucose flux and insulin production and modulates plasma incretin in portal-vein catheterized grower pigs[J].Journal of Nutrition,2010,140(9):1564-1569.
[5]BROCKMAN D A,CHEN X,GALLAHER D D.Consumption of a high beta-glucan barley flour improves glucose control and fatty liver and increases muscle acylcarnitines in the Zucker diabetic fatty rat[J].European Journal of Nutrition,2013.52(7):1743-1753.
[6]ZHU X.Quantitative assessment of the effects of beta-glucan consumption on serum lipid profile and glucose level in hypercholesterolemic subjects[J].Nutrition Metabolism and Cardiovascular Diseases,2015,25(8):714-723.
[7]BELOBRAJDIC D P.Wholegrain barley beta-glucan fermentation does not improve glucose tolerance in rats fed a high-fat diet.Nutrition Research,2015,35(2):162-168.
[8]PANAHI S.Glycemic effect of oat and barley beta-glucan when incorporated into a snack bar:a dose escalation study[J].Journal of the American College of Nutrition,2014,33(6):442-449.
[9]LIU Gang,LIU Ying.On extract ion and purification of oat starch[J].Deep Processing of Oil and Food,2007(1):11-13.(in Chinese)
[10]SINGH J,DARTOISA,KAUR L.Starch digestibilityin food matrix:a review[J].Trends in Food Science&Technology,2010,21(4):168-180.
[11]ZHANG G,YAO Z,ZHAMAKER B R.Slow digestion property of native cereal starches[J].Biomacromolecules,2006,7(11):3252-3258.
[12]KAMAL E A,LAERKE H N,KNUDSEN K E B,et al.Physical,microscopic and chemical characterisation of industrial rye and wheat brans from the Nordic countries[J].Food Nutr Res,2009,53:1-11.
[13]LIU Y,BAILEY T B,WHITE P J.Individual and interactional effects of beta-glucan,starch,and protein on pasting properties of oat flours[J].Journal of Agricultural and Food Chemistry,2010,58(16):9198-9203.
[14]CHENG Ke,CHEN Jiwang.The studies of rice starch physicochemical properties and pasting characteristics[J].Journal of the Chinese Cereals and Oils Association,2006,21(6):4-8.(in Chinese)
[15]ANDERSSON A A,BRJESDOTTER D.Effects of environment and variety on content and molecular weight of β-glucan in oats[J].Journal of Cereal Science,2011,54(1):122-128.
[16]DONGOWSKI G,DRZIKOVA B,SENGE B,et al.Rheological behaviour of β-glucan preparations from oat products[J].Food Chemistry,2005,93(2):279-291.
[17]KWONG M G,WOLEVER T M,BRUMMER Y,et al.Attenuation of glycemic responses by oat β-glucan solutions and viscoelastic gels is dependent on molecular weight distribution[J].Food&Function,2013,4(3):401-409.
[18]CHANDRASHEKAR A,KIRLEIS A W.Influence of protein on starchgelatinization in sorghum[J].Cereal Chemistry,1998,65(6):457-462.
