外源赤霉素对盐胁迫下水稻种子萌发及幼苗生长的缓释效应
2018-04-18张丽丽倪善君张战赵一洲李鑫毛艇刘研刘福才
张丽丽 倪善君 张战 赵一洲 李鑫 毛艇 刘研 刘福才
(辽宁省盐碱地利用研究所,辽宁盘锦124010)
土壤盐渍化是影响土地生产力的重要障碍因子,严重制约了粮食生产和农业的可持续发展。据估计,至2050年将有过半的耕地盐渍化[1]。水稻是我国第一大粮食作物,盐渍土占水稻栽培总面积的约1/5,且有日益扩大和蔓延的趋势。因此,如何在当前人口不断增加、耕地面积日趋减少及水资源日益匮乏的情况下,合理开发、有效利用盐渍土资源,培育耐盐作物品种或者施加一些外源物质等措施缓解土壤盐渍化程度,增强作物耐盐性,己成为国内外科研工作者迫切解决的重大课题。
植物激素是植物自身产生的调节物质,是植物胁迫响应的信号转导的主要成员,参与了植物对盐渍生境的适应性调节过程。研究激素调控植物对环境适应的机制对提高作物耐盐性具有重要的现实意义[2]。赤霉素(GA)是一个较大的萜类化合物家族,在植物整个生命循环过程中起着重要的调控作用。前人关于GA3在植物伸长生长、细胞活性及蛋白质表达等方面作用做了大量研究,并取得了一些进展[3-5]。本文旨在研究外源赤霉素对盐胁迫下不同耐盐性水稻种子萌发及幼苗生长的缓释作用,探讨耐盐性不同水稻对外源赤霉素响应的差异,以期为进一步揭示激素缓释机理提供理论依据。
1 材料与方法
1.1 试验材料
本研究选用耐盐品种长白9号和盐敏感品种越光为试验材料。试验于2014年进行。
1.2 种子萌发试验
随机挑选饱满的种子,经3%H2O2消毒15 min,并用蒸馏水冲洗干净,再用赤霉素浸种24 h,赤霉素浓度分别为0、25 mg/L、50 mg/L和100 mg/L 3个梯度。先在直径为9 cm的培养皿中放2层滤纸并进行编号(Ⅰ-Ⅴ)除Ⅰ号培养皿中加入20 mL蒸馏水外其余4个加入20 mL 100 mM NaCl处理液,然后在每个培养皿中摆放40粒浸种24 h后的水稻种子,每个处理设3个重复,然后把所有处理都放在28℃恒温培养箱中发芽,每天换1次处理液。
1.3 幼苗培养和处理
前期试验结果表明,在100 mM NaCl胁迫下,供试材料幼苗生长受到显著抑制,可以作为研究赤霉素缓解盐害的胁迫浓度。
种子经消毒后,用去离子水洗净,25℃浸种48 h,后28℃条件下催芽24 h,然后置于人工气候箱中沙培,1周后用1/2木村营养液[6]水培,温度25℃,光/暗时间为14 h/10 h。培养至1叶1心期转移至装有1/2木村B营养液的塑料箱中,1周后换成全木村B营养液。幼苗用海绵固定在有孔的苯板上,外部用遮光纸遮光,培养室光/暗温度28℃/20℃,光/暗时间为14 h/10 h。培养至3叶1心时,加入NaCl并喷施赤霉素物质进行处理。每种材料设5个处理,分别为对照(CK,0 mM Na-Cl+0 mg/L GA3)、G0(100 mM NaCl+0 mg/L GA3)、G1(100 mM NaCl+25 mg/L GA3)、G2(100 mM NaCl+50 mg/L GA3)和G3(100 mM NaCl+100 mg/L GA3),胁迫7 d后取样进行各指标测定。
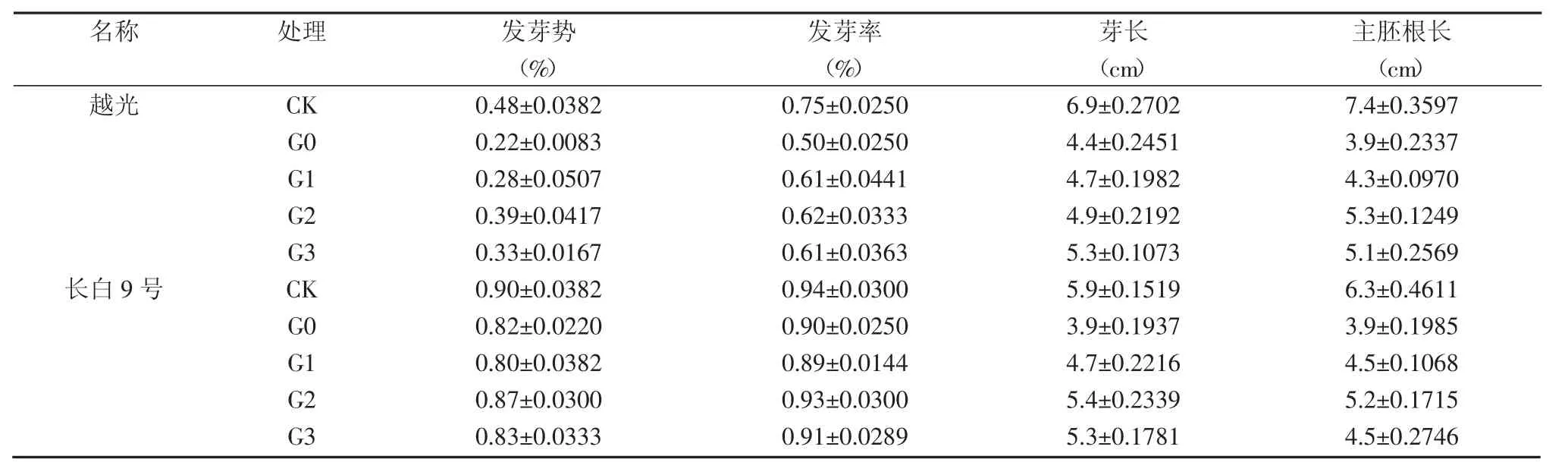
表1 赤霉素对NaCl胁迫下种子发芽的缓解效应
1.4 测定指标及方法
1.4.1 发芽率、发芽势、芽长和主胚根长
以芽长超过1/2种子长度且根长超过种子长度为发芽标准,每天统计发芽数,连续统计7 d。第4 d和第7 d记录发芽数,计算发芽率、发芽势。发芽率(%)=(发芽终期全部正常发芽的种子数/供试种子数)×100,发芽势(%)=(发芽前4 d全部正常发芽的种子数/供试种子数)×100。10 d后随机取10粒种子测定主胚根长和芽长。
1.4.2 叶绿素含量
参照张宪政[7]的方法测定叶绿素含量(包括叶绿素总量、叶绿素a和叶绿素b)。
1.4.3 膜脂过氧化
参照张宪政[7]的方法测定叶片丙二醛含量、相对电导率和O2-含量。
1.4.4 数据分析
采用DPS软件和Excel软件进行统计分析。
2 结果与分析
2.1 外源赤霉素对盐胁迫下水稻种子发芽的影响
从表1可见,盐胁迫使供试品种种子发芽率降低,不同品种间受影响程度不同。越光在G0处理下发芽率与CK相比降低了33.3%,长白9号仅降低了3.6%。外源赤霉素处理提高了盐胁迫下参试品种的发芽率。越光发芽率在G1、G2和G3处理下均高于G0处理;赤霉素对盐胁迫下长白9号发芽率的影响不大,G2处理略高。
盐胁迫对耐盐性不同品种种子发芽势的抑制程度有所不同。在G0处理下,越光和长白9号发芽势均低于CK,分别比CK降低了54.4%和8.9%。赤霉素处理能缓解盐胁迫对参试品种发芽势的抑制程度,特别是对盐敏感品种越光的缓解作用更明显,与G0处理相比,G1、G2和G3处理发芽势分别提高了30.7%、80.8%和53.8%。赤霉素对盐胁迫下长白9号的种子发芽略有缓解作用。
盐胁迫下,水稻种子芽长和主胚根长生长受到明显抑制。赤霉素对盐胁迫下芽长和主胚根长生长存在一定促进作用。G1、G2和G3处理与G0处理相比,长白9号和越光的芽长和主胚根长均有不同程度的提高,且G2处理的效果要好于其他处理。表明外源赤霉素能有效缓解盐胁迫对幼芽和根长的抑制作用。
2.2 外源赤霉素对盐胁迫下水稻幼苗叶片叶绿素含量的影响
由图1所示,参试品种在盐胁迫下叶绿素总量、叶绿素a含量和叶绿素b含量均不同程度降低。叶面喷施赤霉素后,各参试品种的叶绿素总量和叶绿素a含量不同程度增加,而叶绿素b含量呈降低趋势。
长白9号叶绿素总量G0处理与CK相比降低了16.4%,G1、G2和G3处理与CK相比分别降低了3.9%、15.7%和11.1%;长白9号叶绿素a含量G0处理与CK相比降低了17.8%,G1、G2和G3处理与CK相比分别降低了6.0%、10.6%和8.9%;叶绿素b含量G0处理与CK相比降低了14.9%,G1、G2和G3处理与CK相比分别降低了21.0%、30.9%和20.4%,以G2处理下降最明显。
越光叶绿素总含量G0处理与CK相比降低了18.3%,G1、G2和G3处理与CK相比分别降低了8.4%、12.4%和23.3%,G1、G2处理与G0处理间差异达极显著(P<0.01)。叶绿素a含量变化趋势与叶绿素总量基本一致,G0处理与CK相比降低了18.1%,而G1、G2、G3与CK相比分别降低了0.3%、0.5%和14.5%,G1、G2处理与G0处理间差异达极显著(P<0.01)。越光叶绿素b含量G0处理与CK相比降低了18.5%,G1、G2和G3处理与CK相比分别降低了28.5%、30.1%和47.4%,以G3处理下降最明显。
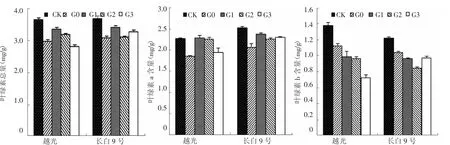
图1 外源赤霉素对盐胁迫下水稻叶片叶绿素含量的缓解效应
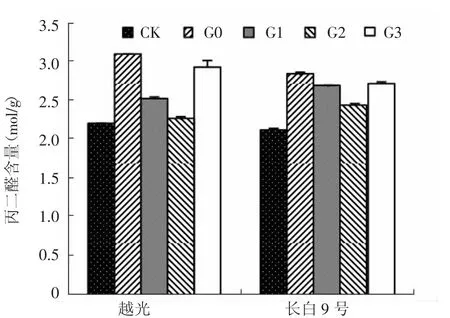
图2 赤霉素对盐胁迫下水稻幼苗叶片丙二醛含量的影响
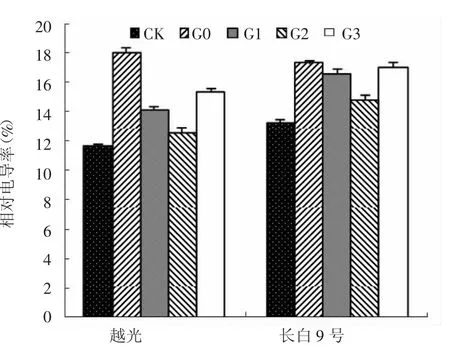
图3 赤霉素对盐胁迫下水稻幼苗叶片相对电导率的影响
2.3 外源赤霉素对盐胁迫下水稻幼苗叶片膜脂过氧化的影响
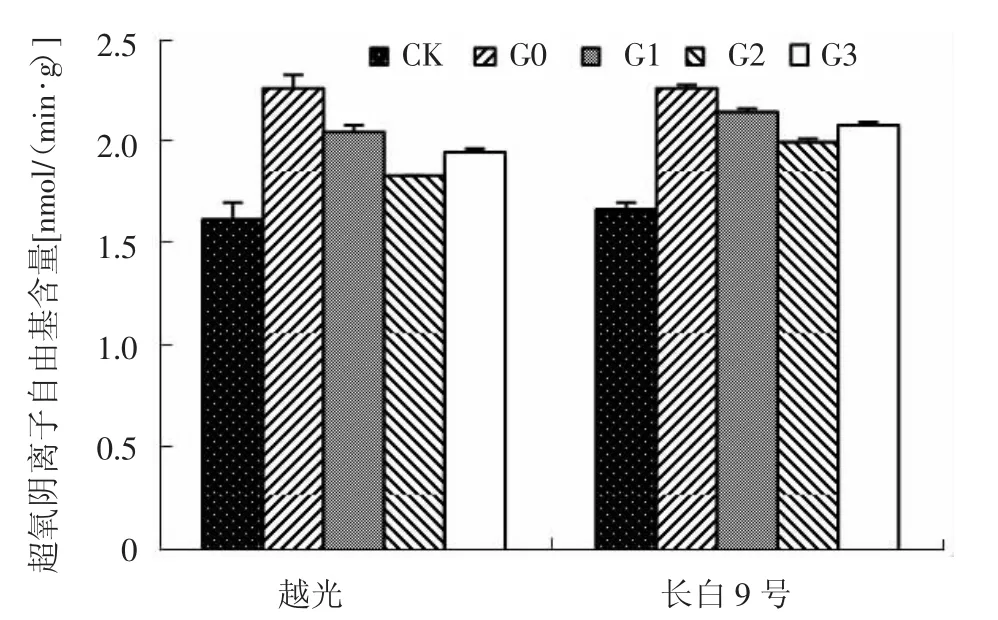
图4 赤霉素对盐胁迫下水稻幼苗叶片超氧阴离子自由基含量的影响
丙二醛(MDA)是膜脂过氧化作用的主要产物之一,其含量是反映细胞膜脂过氧化作用强弱的重要指标。如图2所示,G0处理使耐盐性不同的2个水稻品种叶片MDA含量均极显著增加,分别比CK升高41.5%和33.6%。叶面喷施赤霉素后,长白9号和越光叶片MDA含量明显降低,且二者变化趋势一致。与G0处理相比,G1、G2和G3处理长白9号叶片MDA含量分别降低了5.2%、14.2%和4.2%,越光则分别降低了18.3%、27.2%和5.4%。表明盐胁迫下喷施赤霉素具有降低膜脂过氧化作用,减轻了对植物细胞的伤害。
如图3所示,G0处理下,2个水稻品种叶片相对电导率与CK相比均极显著增加,分别比CK升高了55.2%和30.6%。外源赤霉素处理可明显降低叶片相对电导率。与G0处理相比,G1、G2和G3处理长白9号相对电导率分别降低了4.2%、14.3%和1.7%,G2处理与G0处理之间差异极显著(P<0.01)。越光叶片相对电导率变化趋势与长白9号基本一致,与G0处理相比,G1、G2和G3处理分别降低了21.9%、30.2%和15.0%。
如图4所示,未经盐胁迫处理,参试品种叶片中O2-的产生速率较低;G0处理导致2个水稻品种叶片O2-的产生速率均极显著增加,分别比CK升高39.4%和35.9%。喷施外源赤霉素后参试品种叶片中O2-的产生速率显著降低。与G0处理相比,G1、G2和G3处理长白9号叶片中O2-的产生速率分别降低了5.0%、11.4%和7.8%,越光分别降低了9.2%、19.1%和13.7%。表明G2处理效果要好于G1、G3处理,越光降低幅度大于长白9号。
3 讨论
赤霉素是指具有赤霉烷骨架,并能刺激细胞分裂和伸长的一类化合物的总称,其最显著的生理效应就是促进植物的生长,主要是促进细胞伸长[8]。一定浓度赤霉素可以促进多种作物种子萌发和幼苗生长[9-10]。前人研究结果表明,10 μmol/L GA3处理能显著缓解一定浓度范围内的盐胁迫对水稻种子发芽及幼苗生长的抑制作用[11]。本研究结果表明,本试验中不同浓度赤霉素均提高了盐胁迫下水稻种子发芽率,并可以显著地恢复盐胁迫下种苗根和芽的伸长生长。其中以G2处理效果最佳。这可能是盐胁迫使植物的内源赤霉素活性下降,导致植物生长受抑制,而外源赤霉素可以部分抵消这种影响,进而提高水稻耐盐性,这与前人研究结果一致[2]。也有研究认为,这是由于赤霉素能促进细胞对Ca2+的吸收,提高细胞质中的Ca2+浓度,并活化ER上的Ca2+-ATPase活性,促进Ca2+向ER中运输,提高ER活性,从而促进种子萌发[12]。
叶绿体是植物细胞中对盐分最敏感的细胞器,易受到盐胁迫的伤害。当植物遭受盐胁迫时,叶绿体在叶肉细胞中的排列呈现紊乱,基粒间连接松驰,类囊体内腔膨大,叶绿体双层被膜部分出现损坏,脂质小球增多[13]。本研究结果表明,盐胁迫下耐盐性不同的2个水稻品种叶绿素含量均显著降低,喷施25~100 mg/L外源赤霉素均可以提高盐胁迫下水稻叶片中叶绿素总量和叶绿素a含量,其中以50 mg/L效果最为明显。表明外源赤霉素可以有效地抑制水稻叶片中叶绿素降解,这与徐锴等[14]研究结果一致。本试验中盐胁迫下外施赤霉素导致叶片中叶绿素b含量继续下降,其原因有待进一步明确。
逆境胁迫可诱发植物细胞内产生过量的活性氧,活性氧积累会造成膜、蛋白质和DNA分子结构等损伤[15],活性氧代谢失调是逆境下需氧生物受害的普遍表现,也是逆境损伤的重要原因之一[16],过多的活性氧还可导致膜脂过氧化,并进一步引起DNA断裂,导致基因突变[17],可以引起膜透性增大,外渗液中离子浓度升高,相对电导率增大,相对电导率是标志膜受损伤即植物受胁迫伤害程度的指标[18],而MDA是活性氧启动膜脂氧化过程中产生的主要产物之一,其含量是衡量植物在逆境胁迫下活性氧伤害程度大小的常用指标[19]。本试验结果表明,在盐胁迫条件下耐盐性不同的2个品种幼苗叶片的MDA、超氧阴离子自由基含量和相对电导率均显著增加,而喷施25~100 mg/L外源赤霉素后,叶片MDA含量、超氧阴离子自由基含量和相对电导率均明显下降,其中以50 mg/L的处理效果最为明显。由此可见,外源赤霉素可以缓解盐胁迫对水稻植株的损害,降低叶片的膜脂过氧化作用,减少活性氧的积累和产生,从而提高植物耐盐能力,这可能是外源赤霉素处理提高水稻耐盐性的原因之一。
综上所述,外源赤霉素在一定浓度范围内能有效缓解盐胁迫对水稻种子萌发和幼苗生长的伤害,其中以50 mg/L的浓度缓解效果最为明显。而耐盐性不同水稻品种长白9号与越光对赤霉素响应不同,缓解机制也不尽相同,有待进一步明确。
[1] Ashraf M.Breeding for salinity tolerance in plants[J].Crit Rev Plant Sci,1994,13:17-42.
[2] 温福平,张檀,张超晖,等.赤霉素对盐胁迫抑制水稻种子萌发的缓解作用的蛋白质组分析[J].作物学报,2009,35(3):483-489.
[3] Konishi H,Yamane H,Maeshima M,et al.Characterization of fructose-bisphosphate aldolase regulated by gibberellin in roots of rice seedling[J].Plant Mol Biol,2004,56:839-848.
[4] Komatsu S,Konishi H.Proteome analysis of rice root proteins regulated by gibberellin[J].Genomics Proteomics Bioinformatics,2005,3(3):132-142.
[5] Komatsu S,Zang X,Tanaka N.Comparison of two proteomics techniques used to identify proteins regulated by gibberellin in rice[J].J Proteome Res,2006,5(2):270-276.
[6] 许明学,朴昌浩,金滢完.水稻在不同营养液中生育情况的研究[J].延边农学院学报,1984,5(1):14-20.
[7] 张宪政.作物生理研究法[M].北京:农业出版社,1990.
[8] 蔡永萍.植物生理学[M].北京:中国农业大学出版社,2008:117-181.
[9] 刘晓冰,曾寒冰.植物生长调节物质对春小麦种子萌发的效应[J].东北农学院学报,1991,22(3):220-224.
[10] Jhorar B S.Effect of gibberellic acid on seedling emergence and early growth of cotton Indian[J].J Plant Physiol,1982,25:423-426.
[11] 尹昌喜,汪献芳,金莉,等.赤霉素对盐胁迫下水稻种子发芽及幼苗生长的影响[J].安徽农业科学,2009,37(14):6 389-6 390.
[12] 侯振安,李品芳,龚元石.激素对植物耐盐性影响的研究现状与展望[J].石河子大学学报,2000,4(3):239-245.
[13] Barhoumi Z,Djebali W,Abdelly C,et al.Salt impact on photosynthesis and leaf ultrastructure of Aeluropus littoralis[J].J Plant Res,2007,120(4):529-537.
[14] 徐锴,金芳.外源激素对盐胁迫下草莓光合性能的影响[J].甘肃农业大学学报,2006,41(2):31-34.
[15] 梁慧敏,夏阳,王太明.植物抗寒冻、抗旱、耐盐基因工程研究进展[J].草业学报,2003,12(3):1-7.
[16] 陈洁,林栖凤.植物耐盐生理及耐盐机理研究进展[J].海南大学学报:自然科学版,2003,21(2):177-188.
[17] 刘晓麒,曹恩华.脂质过氧化引起DNA损伤研究进展[J].生物化学与生物物理进展,1994,21(3):218-222.
[18] 阎秀峰,孙国荣,那守海,等.盐胁迫下星星草幼苗的生理Ⅱ--盐胁迫对星星草幼苗膜透性的影响[J].黑龙江畜牧兽医,1994(4):1-3.
[19] 李合生.植物生理生化试验原理和技术[M].北京:高等教育出版社,2000.
