过氧化氢降解水不溶性条斑紫菜多糖
2018-04-12王灵昭史辰娟汪维喜苏琳王纪丰邱春江舒留泉姚兴存
王灵昭,史辰娟,汪维喜,苏琳,王纪丰,邱春江,舒留泉,姚兴存
1 (淮海工学院 江苏省海洋生物技术重点实验室/海洋生命与水产学院, 江苏 连云港, 222005) 2 (连云港西墅物产有限责任公司, 江苏 连云港, 222042)
多糖降解产物具有增强免疫、抗肿瘤、降血糖、降血压、增强机体免疫等生理作用[1],尤其是其分子质量小这一优点能够克服大分子多糖溶解性差、生物利用率低的不足[2]。干紫菜含25%~50%的蛋白质(藻胆蛋白占紫菜干重的4%左右),20%~40%的糖类[3-4]。因此,紫菜的高值化利用应重点关注藻胆蛋白和多糖。王灵昭等[5]提出了一种以鲜紫菜为原料,同时制备藻胆蛋白和多糖的新技术,但该技术体系产生大量水不溶性紫菜多糖。氧化剂的活性基团能夺取多糖β-1,4糖苷键1位或4位上的质子,使糖苷键发生非酶氧化断裂而产生水溶性多糖,其中过氧化氢是常用的氧化剂[6]。因此,本文探究前述水不溶性紫菜多糖的过氧化氢降解,期望为高值化开发条斑紫菜过程中产生的水不溶性多糖的高值化利用提供研究基础。
1 材料与方法
1.1 材料与试剂
条斑紫菜(Porphyrayezoensis):由连云港西墅物产有限责任公司提供。试剂纯度为分析级或更高级。
1.2 仪器与设备
PS100型平板式离心机,张家港市乐余润捷机械厂;MTK 662型斩拌机,马多(北京)机械制造有限公司;CMD2000/4高剪切研磨分散机,切可(上海)机械设备有限公司;MS1001L2K高压均质机,意大利GEA Nliro Soavi公司;CR-22N流体离心机,日本日立仪器有限公司;多用途台式高速冷冻离心机,赛多利斯科学仪器(北京)有限公司;Agileng1200高效液液相色谱仪,安捷伦科技有有限公司;Alltech3300蒸发光散射检测器,美国格瑞斯公司;Nexus-870傅立叶变换红外光谱仪,美国NICOLET公司;769YP-15A压片机,北京天创尚邦仪器有限公司;Lambda35紫外/可见分光光度计,美国Perkin Elmer公司。
1.3 实验方法
1.3.1水不溶性条斑紫菜多糖的制备
参照王灵昭等[5]的前期研究,制备水不溶性条斑紫菜多糖的技术路线如图1所示。

图1 制备藻胆蛋白和多糖的技术路线Fig.1 Technical route for preparing phycobiliproteinsand polysaccharides
将采收的紫菜离心脱水后于-20 ℃下冻藏备用。将冻藏紫菜斩拌,加入pH 8.0的KH2PO4-NaOH缓冲液(缓冲液与紫菜质量比为1∶1)于40 ℃下溶胀9 h,用高剪切研磨分散机超微粉碎后加水稀释(物料与水质量比为1∶1),然后于80 MPa下高压均质。将均质后的物料用流体离心机离心,获得的沉淀物即为水不溶性紫菜多糖,用于过氧化氢降解研究。
1.3.2过氧化氢降解紫菜多糖的影响因素研究
1.3.2.1过氧化氢浓度对多糖降解的影响
加水分散水不溶性紫菜多糖,使其干物质含量至2%,然后加入体积分数30%的双氧水使体系的过氧化氢质量分数分别达到1.2%、1.5%、1.8%、2.1%和2.4%。密闭反应容器使体系在60 ℃下反应6 h,冷却至室温,离心得上清液,分析上清液中的总糖含量。
1.3.2.2温度对多糖降解的影响
加水分散水不溶性紫菜多糖,使其干物质含量至2%,然后加入30%的双氧水使体系的过氧化氢质量分数达到1.8%。体系分别在40、50、60、70和80 ℃下反应6 h,冷却至室温,离心得上清液,分析上清液中的总糖含量。
1.3.2.3时间对多糖降解的影响
加水分散水不溶性紫菜多糖,使其干物质含量至2%,然后加入30%的双氧水使体系的过氧化氢质量分数达到1.8%。体系在60 ℃下分别反应4、5、6、7和8 h,冷却至室温,离心得上清液,分析上清液中的总糖含量。
以溶出率为指标衡量水不溶性紫菜多糖的过氧化氢降解,其定义为上清液中总糖含量占所消耗的水不溶性紫菜多糖中干物质含量的百分比。
1.3.3产物中低聚糖组分分析
将上清液样品真空旋转蒸发至原体积的1/5,用4倍体积的体积分数95%乙醇醇沉12 h,离心处理去除上清液。添加少量丙酮摇匀后重复上述操作,再加无水乙醇重复上述操作。然后,样品置通风橱中通风30 min,于45~55 ℃下干燥后将粉状样品置于干燥器中备用。
称取0.5~2 g粉状样品(精确至0.000 1 g),加入超纯水至15 mL后充分混匀,然后加入等体积的质量分数1.5%磺基水杨酸以沉淀蛋白,混匀后静置、离心,上清液经0.45 μm微孔膜过滤后用于粉状样品中的单糖及低聚糖分析。参考张媛媛等[7]的研究,采用高效液相色谱-蒸发光散射法分析粉状样品中的单糖及低聚糖。取葡萄糖、麦芽糖和乳糖作为对照品,色谱条件做如下修改:ZORBAX NH2色谱柱,柱温30 ℃;进样量10 μL;流动相为V(乙腈)∶V(水)=70∶30,流速1 mL/min; 蒸发光散射器参数:漂移管温度80 ℃,N2流速2.0 L/min。
1.3.4产物的红外光谱分析
1.3.3中所述的粉状样品的红外光谱分析采用KBr压片法,将薄片进行4 000~400 cm-1范围的扫描。
1.3.5产物的紫外光谱、蛋白质含量及总糖含量分析
将1.3.3中所述的粉状样品配成0.05 g/L样液,然后进行200~400 nm的紫外扫描仪扫描。采用Bradford法测定粉状样品的蛋白质含量,并分析其总糖含量。
1.3.6化学及统计分析

2 结果与讨论
2.1 过氧化氢降解紫菜多糖的影响因素研究
2.2.1过氧化氢体积分数对多糖降解的影响
由图2可知,过氧化氢质量分数1.8%时溶出率显著地(p<0.05)高于其他浓度下的溶出率。随着过氧化氢质量分数的增加,溶出率在1.8%时增至最大而后减小,这种过氧化氢质量分数对多糖溶出的影响趋势与PIERCE等的报道类似。不同糖单体及其构成的糖苷键对过氧化氢处理的敏感性不同,过氧化氢质量分数的增加会导致化学强度高的糖苷键断裂,但也会引起敏感单体的降解,因此过氧化氢降解多糖时存在最适的过过氧化氢质量分数[6]。图2表明,最适的为1.8%。

图2 过氧化氢质量分数对多糖降解的影响Fig.2 Effect of hydrogen peroxide concentration onpolysaccharide degradation注:标有不同字母的指标值具有显著性差异(p<0.05)。图3、图4同。
2.2.2温度对多糖降解的影响
由图3可知,不超过60 ℃时,溶出率随着温度的增加而显著增加(p<0.05);70 ℃的溶出率与60、80 ℃的溶出率比较,分别呈不显著增加(p>0.05)和显著增加(p<0.05)。过氧化氢作用下的温度过高会导致多糖过度降解,产生非糖类产物,通过降低总糖测定值而降低溶出率。综合考虑,最适温度为60 ℃。不同多糖过氧化氢降解的最适温度不同,本研究的最适温度与WU等[8]报道的凝胶多糖过氧化氢降解的最适温度相同。

图3 温度对多糖降解的影响Fig.3 Effect of temperature on polysaccharide degradation
2.2.3时间对多糖降解的影响
由图4可知,随着时间的增加,溶出率先增加后降低,在6 h时达到最大值;6 h的溶出率显著大于(p>0.05)其他时间下的溶出率。时间过长,降解液中产生一些非糖类化合物而降低溶出率。综合考虑,最适时间为6 h。

图4 时间对多糖降解的影响Fig.4 Effect of time on polysaccharide degradation
2.2 产物中低聚糖组分分析
如图5所示,图5-A、5-B和5-C分别是对照品(葡萄糖、麦芽糖)、对照品(乳糖)和降解物样品的色谱图。由图5-A、图5-B可知,葡萄糖、麦芽糖、乳糖的保留时间分别为10.597、12.874和13.773 min;由图5-C可知,降解物样品在13.857、16.883和18.028 min处出峰。本研究采用磺基水杨酸法对粉状样品进行了除蛋白预处理,因此图5-C中的组分应是糖类物质。氨基柱已成功用于低分子质量糖分析,乙睛-水作为流动相时,出峰顺序为单糖、双糖和较高聚合度的低聚糖[7]。由图5可知,产物中保留时间13.857 min的组分可能为双糖衍生物,而保留时间16.883、18.028 min的2种低聚糖组分在聚合度上不低于3,有关结构信息需深入研究。王灵昭等[9]已报道紫菜多糖的酸水解,比较可知,紫菜多糖酸水解产物组分单一[9],而过氧化氢降解产物组分多、分子质量大。

图5 对照品(A和B)和降解物样品(C)的高效液相色谱Fig.5 High performance liquid chromatography of controlsamples (A and B) and hydrolysate sample (B)
2.3 产物的红外光谱分析


图6 红外光谱Fig.6 Infrared spectrum
2.4 产物的紫外光谱、蛋白质含量及总糖含量分析
由图7可知,在260~280 nm有明显吸收峰,说明样品含有蛋白质。采用Bradford法测定样品的蛋白质含量,结果表明粉状样品含有蛋白质(2.12±0.06)%。该结果验证了红外光谱1 657 cm-1处是肽键上酰胺羰基吸收峰,样品含有蛋白质,且蛋白质含量低于紫菜多糖酸水解的样品蛋白质含量(6.88±0.07)%[9]。此外,粉状样品含有总糖(93.66±0.51)%。
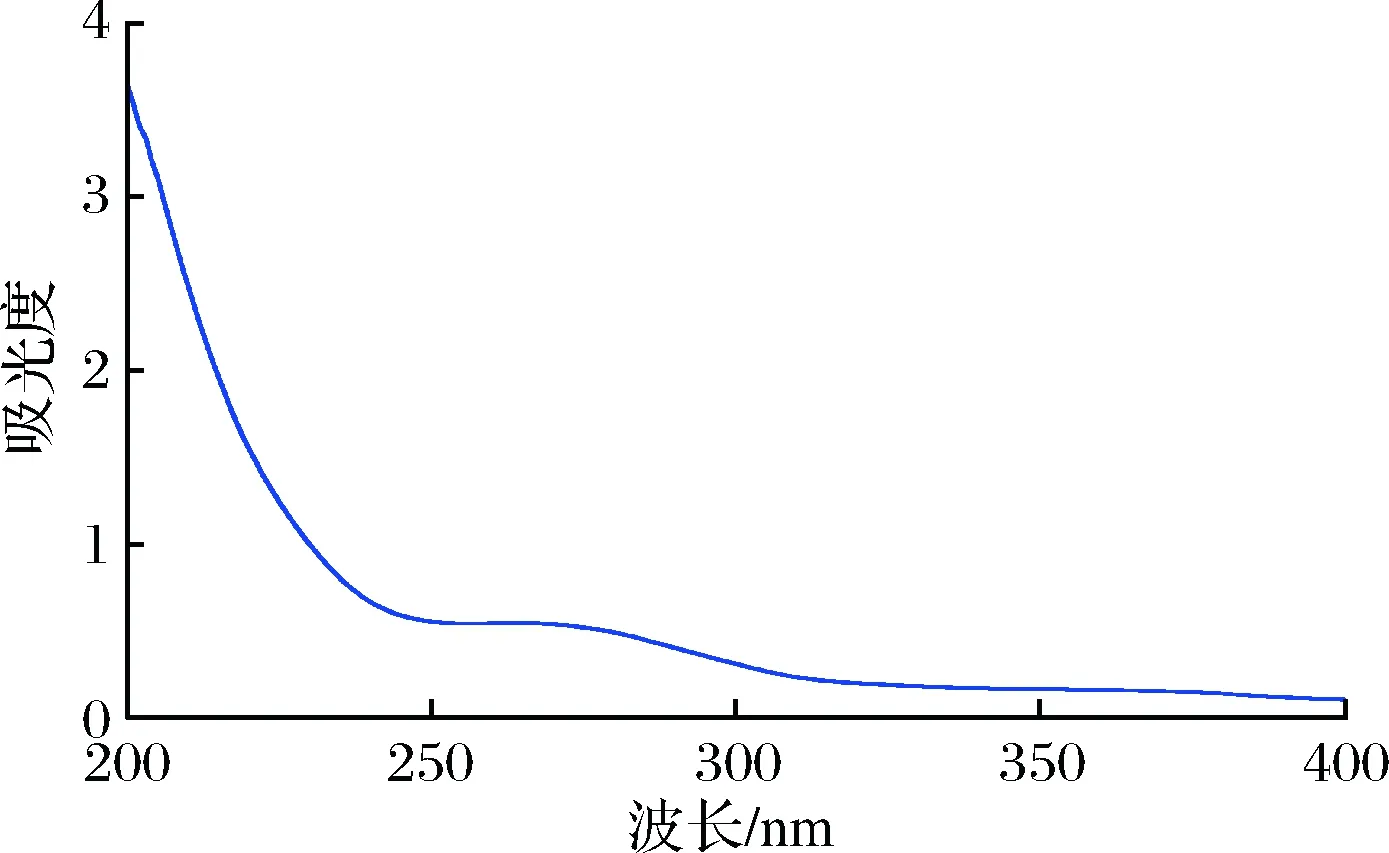
图7 紫外光谱Fig.7 Ultraviolet spectrum
3 结论
研究了过氧化氢降解水不溶性紫菜多糖的影响因素,以及产物的低聚糖组成、红外光谱、紫外光谱、蛋白质含量和总糖含量。结果表明,多糖降解的最适条件为:过氧化氢质量分数1.8%,温度60 ℃,时间6.0 h。液相色谱分析表明产物包含3种低聚糖组分,可能为双糖、双糖衍生物或聚合度不低于3的低聚糖。红外光谱分析表明产物主要是β-糖苷键连接的吡喃型低聚糖,具有硫酸基和3,6-内醚半乳糖结构。紫外光谱分析表明产物含有蛋白质,进一步分析表明产物含有蛋白质2.12%、总糖93.66%。研究结果对水不溶性条斑紫菜多糖的高值化利用具有重要指导价值。
[1]缪月秋, 顾龚平, 吴国荣. 植物多糖水解及其产物的研究进展[J]. 中国野生植物资源, 2005, 24(2): 4-7.
[2]HIRAYAMA M. Novel physiological functions of oligosaccharides [J]. Pure and Applied Chemistry, 2002, 74(7): 1 271-1 279.
[3]张全斌, 赵婷婷, 綦慧敏, 等. 紫菜的营养价值研究概况[J]. 海洋科学, 2005, 29(2): 69-72.
[4]姚兴存, 邱春江, 穆春林. 条斑紫菜营养成分与季节变化研究[J]. 水产养殖, 2002(5): 34-35.
[5]王灵昭, 苏琳, 姚兴存, 等. 一种利用条斑紫菜制备粗藻胆蛋白及粗多糖的方法[P]. 中国105111278A. 2015-12-02.
[6]PIERCE B C, WICHMANN J, TRAN T H, et al. Formation of water-soluble soybean polysaccharides from spent flakes by hydrogen peroxide treatment [J]. Carbohydrate Polymers, 2016, 144: 504-513.
[7]张媛媛, 聂少平, 万成, 等. 高效液相色谱—蒸发光散射检测法同时测定单糖、双糖及低聚果糖[J]. 食品科学, 2009, 30(18): 237-239.
[8]WU Sheng-jun, CAI Rui-zhen, SUN Yu-ying. Degradation of curdlan using hydrogen peroxide [J]. Food Chemistry, 2012, 135(4): 2 436-2 438.
[9]王灵昭, 周晓婉, 汪维喜, 等. 水不溶性条斑紫菜多糖酸水解的研究[J/OL]. 食品与发酵工业,2017,43(9):92-96.
[10]孙健. 荔枝壳多糖的组成及抗氧化性分析[J]. 粮油食品科技, 2006, 14(5): 44-45.
[11]赖婷. 块菌多糖的提取纯化、结构鉴定及其羧甲基改性研究[D]. 广州:华南理工大学, 2016.
[12]吴凡. 鼎湖鳞伞菌胞外多糖的理化特性与抗氧化活性研究[D]. 南京:南京农业大学, 2015.
[13]王飞运. 大豆皮多糖提取及干法接枝改性研究[D]. 郑州:河南工业大学, 2016.
[14]邵双双. 中国被毛孢胞内多糖(HSIPS2)分离纯化、抗氧化活性及结构研究[D]. 杭州:浙江大学, 2016.
[15]周正辉, 焦连庆, 于敏, 等. 锦灯笼根茎均一多糖PⅠ、PⅡ的制备及其结构研究[J]. 吉林农业大学学报, 2012, 34(3): 289-293.
[16]邓利玲, 钟耕, 刘倍毓, 等. 半干法酶解制备的魔芋葡甘低聚糖性质[J]. 食品科学, 2013, 34(15): 115-119.
[17]穆凯峰, 吴永沛. 坛紫菜多糖的分离纯化及其组成分析[J]. 中国食品学报, 2011, 11(1): 159-164.
[18]孟庆勇, 王亚飞, 揭新明, 等. 粗江蓠多糖的提取及光谱分析[J]. 光谱学与光谱分析, 2006, 26(10): 1 903-1 906.
[19]李莉莉. 生物多糖功能化碳纳米管载体制备及固定化酶应用的研究[D]. 北京:北京化工大学, 2012.
