苦参素对肝癌细胞增殖、侵袭和迁移能力的影响及机制
2018-04-11邓通元黄桂柳黄赞松周喜汉胡高裕覃月秋
邓通元,黄桂柳,黄赞松,周喜汉,胡高裕,覃月秋
(右江民族医学院附属医院,广西百色533000)
原发性肝癌以肝细胞癌(简称肝癌)为主,是常见的恶性肿瘤,患者预后差,其5年生存率不超过30%[1]。肝癌的发生常缺乏典型的临床表现,多数患者确诊时已出现肿瘤的远处侵袭和转移,是导致患者治疗效果欠佳、预后不良的重要原因。研究显示,肝癌的转移与某些基因的改变与表达有关。钙黏蛋白(E-cadherin)和免疫球蛋白类黏附因子CD44在肝癌的侵袭与转移过程中起重要作用。研究[2,3]表明,在肝癌细胞及手术切除的伴有转移的肝癌组织中可检测到E-cadherin和CD44表达异常,其与肝癌的侵袭转移密切相关。新近研究[4]发现,中药在抗肿瘤治疗中具有一定的疗效。苦参素为苦参、苦豆子、广豆根等中药活性成分的提取物,具有抗肝癌的作用。我们的前期研究[5~7]发现,苦参素具有抑制肝癌细胞增殖、增强顺铂抗肝癌细胞及肝癌移植瘤的作用。2015~2016年,我们在前期实验的基础上,进一步观察不同浓度苦参素对肝癌细胞增殖、侵袭和迁移能力的影响,并检测细胞中E-cadherin和CD44表达的变化,探讨苦参素抗肝癌作用的分子机制。
1 材料与方法
1.1 材料
肝癌HepG2细胞株购自中科院上海细胞库;青霉素、链霉素、胰蛋白酶、PVDF膜购自北京索莱宝科技有限公司;DMEM培养液、PBS缓冲液、小牛血清购自北京赛默飞世尔生物化学制品有限公司;总RNA提取试剂盒、逆转录试剂盒、SYBR Green ERTM qPCR Super Mix试剂盒及E-cadherin和CD44引物购自TaKaRa生物公司;Transwell小室购于美国康宁公司,Matrigel基质胶购自BD公司;一抗、二抗及抗体稀释液购自武汉博士德公司。
1.2 细胞培养与分组
将HepG2细胞加入DEPE培养液(含10%小牛血清和青、链霉素各100 μg/mL),置于培养箱内培养24 h后换液,待细胞生长至贴壁状态,细胞融合接近90%传代。取对数生长期细胞,分为阴性对照组和苦参素低、中、高浓度组,阴性对照组加入细胞培养液,苦参素低、中、高浓度组分别加入终浓度为1.0、2.0、4.0 mg/mL的苦参素和细胞培养液。每组设5个复孔。
1.3 细胞增殖抑制率测算
采用MTT法。将细胞按5×104/mL接种于96孔板。待细胞贴壁后,按1.2方法进行分组处理。另设空白对照组,仅加入细胞培养液。培养24、48、72 h后,分别加入5 mg/mL MTT,继续孵育4 h。吸净上清液后加入DMSO,置恒温振荡箱中,37 ℃振荡10 min。在全自动酶标仪上,于490 nm波长处测定各孔光密度OD值,计算各组细胞增殖抑制率。细胞增殖抑制率=[1-(实验组OD值-空白对照组OD值)/(阴性对照组OD值-空白对照组OD值)]×100%。
1.4 细胞侵袭能力观察
采用Transwell细胞侵袭实验。取40 μL稀释好的Matrigel基质胶加入预冷的Transwell小室中,37 ℃孵育2 h使其凝固。取各组细胞制成悬液,调整细胞密度为1×105/mL。分别在Transwell小室上室加入含0.1%胎牛血清的DMEM高糖培养液稀释的细胞悬液200 μL,下室加入500 μL含20%胎牛血清的DMEM高糖完全培养基。37 ℃继续培养24 h后,甲醇固定,0.1%结晶紫室温下染色,倒置显微镜拍照,显微镜下观察穿膜细胞数,计数中间及四周5个高倍镜下视野细胞数,计算平均数。
1.5 细胞迁移能力观察
除在Transwell小室内未加入Matrigel外,其他步骤与侵袭实验相同。
1.6 细胞中E-cadherin、CD44 mRNA表达检测
采用Real-time PCR方法。取各组作用48 h后的细胞制成悬液,调整细胞密度为1×106/mL,采用TaKaRa试剂盒提取细胞总RNA,按逆转录试剂盒说明制备cDNA。以cDNA为模板,GAPDH为内参进行扩增。引物序列:E-cadherin上游5′-GAGTGCCAACTG-GACCATTCAGTA-3′,下游5′-CACAGTCACACACGC-TGACCTCTA-3′,扩增片段长度164 bp;CD44上游5′-CAGGGCTGGGCTTAGACAGA-3′,下游5′-CTGGCCAATGATGTTCACAGA-3′,扩增片段长度178 bp;GAPDH上游5′-GCACCGTCAAGGCTGAGAAC-3′,下游5′-TGGTGAAGACGCCAGTGGA-3′,扩增片段长度138 bp。反应体系:2×Super Real Premix Plus 10 μL,上、下游引物各0.8 μL,cDNA 2 μL,50×ROX Reference Dye 1 μL, RNase Free dH2O 6.4 μL,总体系20 μL。反应条件:预变性95 ℃、30 s;变性95 ℃、10 s,退火60 ℃、34 s,共40个循环;延伸55~95 ℃、30 s,共81个循环。PCR扩增结束后,分析仪即显示标准曲线、扩增曲线、熔解曲线和CT值。用2-ΔΔCt法计算mRNA的相对表达量。
1.7 细胞中E-cadherin、CD44蛋白表达检测
采用Western blotting法。取各组作用48 h后的细胞,加入细胞裂解液提取细胞总蛋白,BCA法测定蛋白浓度。取总蛋白20 μg制备蛋白样品变性上样,于8%~10% SDS-PAGE胶上电泳,PVDF转膜,膜封闭1.5 h后,在孵育盒中加一抗(小鼠源抗CD44抗体、小鼠源抗E-cadherin抗体,小鼠源抗β-actin抗体)4 ℃孵育过夜。TBST洗膜,加二抗(HRP标记的羊抗鼠抗体),室温孵育1.5 h。TBST洗膜,用化学发光法曝光显影,胶片扫描后,用Image J软件行灰度值分析。以E-cadherin和CD44蛋白与内参β-actin蛋白灰度值的比值表示蛋白的相对表达量。
1.8 统计学方法
2 结果
2.1 各组细胞增殖抑制率比较
苦参素高浓度组细胞增殖抑制率较中、低浓度组升高,中浓度组较低浓度组升高(P均<0.05);苦参素中、高浓度组细胞增殖抑制率在72 h高于48 h和24 h,48 h高于24 h(P均<0.05)。见表1。
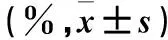
表1 各组细胞增殖抑制率比较
注:与苦参素低浓度组比较,aP<0.05,与苦参素中浓度组比较,bP<0.05;与同组24 h比较,cP<0.05;与同组48 h比较,dP<0.05。
2.2 各组细胞侵袭和迁移能力比较
细胞侵袭实验显示,苦参素低、中、高浓度组的穿膜细胞数分别为(97.73±9.43)、(69.73±8.93)、(42.87±5.02)个,均少于阴性对照组的(124.07±11.61)个(P均<0.05);苦参素低浓度组多于中、高浓度组,中浓度组多于高浓度组(P均<0.05)。细胞迁移实验显示,苦参素低、中、高浓度组穿膜细胞数分别为(111.20±9.56)、(78.60±5.17)、(43.87±1.60)个,均少于对照组的(145.67±12.87)个(P均<0.05)。苦参素低浓度组多于中、高浓度组,中浓度组多于高浓度组(P均<0.05)。
2.3 各组细胞E-cadherin、CD44 mRNA表达比较
苦参素低、中、高浓度组E-cadherin mRNA相对表达量均较阴性对照组升高(P均<0.05);中浓度组高于低、高浓度组(P均<0.05),低、高浓度组之间比较差异无统计学意义(P>0.05)。苦参素组低、中、高浓度组CD44 mRNA相对表达量均较阴性对照组降低(P均<0.05),苦参素不同浓度组间比较差异无统计学意义(P均>0.05)。见表2。
2.4 各组细胞E-cadherin、CD44蛋白表达水平比较
苦参素低、中、高浓度组E-cadherin蛋白表达水平均较阴性对照组升高(P均<0.05),苦参素不同浓度组间比较差异无统计学意义(P均>0.05);苦参素中、高浓度组CD44蛋白表达水平较阴性对照组降低,其中低浓度组较中、高浓度组升高(P均<0.05),中、高浓度组间比较差异无统计学意义(P>0.05)。见表3。
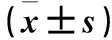
表2 各组细胞E-cadherin、CD44 mRNA表达比较
注:与阴性对照组比较,*P<0.05;与苦参素中浓度组比较,#P<0.05。
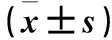
表3 各组细胞E-cadherin、CD44蛋白表达水平比较
注:与阴性对照组比较,*P<0.05;与苦参素低浓度组比较,#P<0.05。
3 讨论
肝癌的复发和转移是一个多步骤、多因素相互作用的复杂过程,包括细胞外基质降解、肿瘤细胞脱落、黏附、细胞迁移、细胞增殖及肿瘤血管形成等。目前关于肝癌侵袭、转移的相关因子有黏附分子、基质金属蛋白酶、趋化因子、细胞因子、血管内皮生长因子(VEGF)、上皮-间充质转变相关因子、整合素、细胞角蛋白等。在肝癌的侵袭、转移过程中,存在多种细胞黏附分子的异常表达,其中以钙黏素、连接素和CD44最为重要[8]。我们的前期研究发现,苦参素具有抑制肝癌细胞增殖和增强顺铂抗肝癌细胞株及肝癌小鼠与裸鼠移植瘤作用。肝细胞癌治疗效果差的主要原因是其早期易发生侵袭、转移,寻找抗肝癌侵袭、转移作用的药物具有重要意义。本研究在先前实验的基础上,测定了苦参素对HepG2细胞增殖的影响,苦参素对HepG2细胞的增殖抑制作用在高浓度组较中、低浓度组升高,中浓度组较低浓度组升高;72 h高于48 h和24 h,48 h高于24 h。表明苦参素对HepG2细胞增殖具有抑制作用。王涌等[9]报道,苦参碱能够从细胞黏附、运动、降解等多环节抑制SMMC-7721细胞的侵袭转移。本研究显示,在细胞侵袭及迁移实验中,苦参素不同浓度组的穿膜细胞数均少于阴性对照组,其中苦参素低浓度组多于中、高浓度组,中浓度组多于高浓度组。表明苦参素对HepG2细胞具有抗侵袭转移作用,1、2、4 mg/mL组苦参素均可以抑制HepG2细胞的侵袭和迁移能力。
为探讨苦参素抗肿瘤侵袭、转移作用的分子机制,我们从基因和蛋白表达水平验证了苦参素对HepG2细胞中E-cadherin和CD44表达的影响。E-cadherin和CD44作为介导细胞黏附作用的细胞黏附分子,在维持细胞黏附过程中具有重要作用,其功能或表达异常都会造成细胞间黏附能力下降,导致肿瘤细胞脱离癌灶,启动肿瘤细胞的侵袭和转移。
E-cadherin是钙黏素家族成员,是一种钙离子依赖性细胞表面跨膜糖蛋白,它主要分布于上皮细胞中,通过细胞质连环素与细胞骨架蛋白相连,介导细胞之间以及细胞与细胞外基质黏附,维持细胞结构和形态的稳定,E-cadherin表达降低有利于肿瘤细胞脱离原发灶而发生转移。在食管癌、胃癌、大肠癌等消化道恶性肿瘤相关报道研究中,可以观察到E-cadherin表达异常,表现为不表达或表达下降,其表达强度与肿瘤组织分化、分级等呈负相关[10~12]。研究表明,E-cadherin是与肝癌侵袭和转移关系最密切的钙黏素。Chen等[13]对2 439例患者临床资料的Meta分析显示,E-cadherin表达水平下降可以降低肝癌患者1、3、5年的总体生存率,与肝细胞癌患者的不良预后有关。因此,E-cadherin表达降低可以作为肝细胞癌患者预后的一个潜在预测指标。
CD44是一种具有高度异质性跨膜细胞黏附分子,按编码细胞外区域部分外显子的可变拼接性,主要分为标准型(CD44s)和变异型(CD44v)两个亚型;在功能上,初步鉴定为CD44的细胞外基质成分,透明质酸的受体,并参与多种生理和病理过程,如癌症的发展、血管生成、细胞黏附、伤口愈合和炎症[14]。标准型几乎在淋巴细胞、成纤维细胞和增生的上皮细胞等正常细胞可检测到,而变异型则与肿瘤的发生及转移相关。大量研究表明,在肿瘤细胞中CD44一般表现为高表达,与肝癌、胃癌、大肠癌、宫颈癌、肺癌、喉癌等多种肿瘤的侵袭与转移有着密切的关联。刘伟等[15]检测了39例肝癌手术标本,发现CD44v6的阳性率为69.2%,其表达率和表达程度与肝癌的包膜有无、分化程度、临床分期和有否转移有密切关系,在CD44v6呈中高度表达的肝癌中,多伴有肿瘤包膜的缺如、门静脉癌栓及肝内转移等侵袭转移。本研究结果显示,苦参素不同浓度组E-cadherin mRNA相对表达量均较阴性对照组升高,CD44 mRNA相对表达量均较阴性对照组降低。表明苦参素作用HepG2细胞后,细胞中E-cadherin表达升高,CD44表达降低,推测苦参素抑制肝癌侵袭转移的作用可能通过调节E-cadherin和CD44表达而起作用。
综上所述,苦参素对HepG2细胞具有抑制细胞增殖、侵袭和迁移能力的作用,其机制可能与上调E-cadherin表达和下调CD44表达有关。
参考文献:
[1] Zhang YC, Xu Z, Zhang TF, et al. Circulating microRNAs as diagnostic and prognostic tools for hepatocellular carcinoma[J]. World J Gastroenterol, 2015,21(34):9853-9862.
[2] Chen D, Wang Y , Zhang K,et al. Antisense oligonucleotide against clusterin regulates human hepatocellular carcinoma invasion through transcriptional regulation of matrix metalloproteinase-2 and E-cadherin[J]. Int J Mol Sci, 2012,13(8):10594-10607.
[3] Gao Y, Ruan B, Liu W, et al. Knockdown of CD44 inhibits the invasion and metastasis of hepatocellular carcinoma both in vitro and in vivo by reversing epithelial-mesenchymal transition[J]. Oncotarget, 2015,6(10):7828-7837.
[4] 向发良,黄赞松.苦参素抗肝癌作用研究[J].医学综述,2011,17(19):2992-2995.
[5] 韦星,黄赞松,黄岑汉,等.苦参素注射液联合顺铂对肝癌SMMC-7721细胞增殖抑制作用及其机制[J].中国现代医学杂志,2012,22(31):36-40.
[6] 黄赞松,向发良,周喜汉,等.苦参素对肝癌细胞HepG2细胞增殖和MicroRNA-122、MicroRNA-21表达的影响[J].中国老年学杂志,2014,34(11):3079-3081.
[7] 黄宏思,黄赞松,黄卫彤,等.苦参碱与顺铂合用对小鼠肝癌移植瘤的影响[J].时珍国医国药,2008,19(9):2102-2103.
[8] Bae JS, Noh SJ, Jang KY, et al. Expression and role of epithelial cell adhesion molecule in dysplastic nodule and hepatocellular carcinoma[J]. Int J Oncol, 2012,41(6):2150-2158.
[9] 王涌,彭承宏,张国平,等.苦参碱诱导SMMC-7721细胞分化过程中侵袭转移相关指标的实验研究[J].中药材,2003,26(8):566-569.
[10] Nakagawa Y, Ohira M, Kubo N, et al. Tumor budding and E-cadherin expression are useful predictors of nodal involvement in T1 esophageal squamous cell carcinoma[J]. Anticancer Res, 2013,33(11):5023-5029.
[11] Li Y, Chen CQ, He YL, et al. Abnormal expression of E-cadherin in tumor cells is associated with poor prognosis of gastric carcinoma[J]. J Surg Oncol, 2012,106(3):304-310.
[12] Jang TJ. Differential membranous E-cadherin expression, cell proliferation and O-GlcNAcylation between primary and metastatic nodal lesion in colorectal cancer[J]. Pathol Res Pract, 2016,212(2):113-119.
[13] Chen J, Zhao J, Ma R, et al. Prognostic significance of E-cadherin expression in hepatocellular carcinoma: a meta-analysis[J]. PLoS One, 2014,9(8):e103952.
[14] Jang BI, Li Y, Graham DY, et al. The Role of CD44 in the Pathogenesis, Diagnosis, and Therapy of Gastric Cancer[J]. Gut Liver, 2011,5(4):397-405.
[15] 刘伟,王遵义,白希永,等.FN和CD44v6在肝细胞癌中的表达及临床意义[J].中国肿瘤临床,2009,36(18):1057-1058.
