苦参素通过p38/JNK信号途径对海马神经元凋亡的影响
2017-03-28蔡艳蒋伟周爱玲赵敏徐玲
蔡艳+蒋伟+周爱玲+赵敏+徐玲

[摘要] 探讨苦参素(oxymatrine,OMT)对海马神经元凋亡的影响及其机制。采用MTT法测定OMT对海马神经元存活率的影响;生物化学法测定OMT对LPS诱导的海马神经元乳酸脱氢酶(lactate dehydrogenase,LDH)释放率的影响;Hochest 33342染色观察海马神经元凋亡形态;实时定量PCR(Real-time quantitative PCR,RT-qPCR)方法检测海马神经元中Bax,Bcl-2,Caspase-3 mRNA的表达;蛋白免疫印迹法(Western blot,WB)检测海马神经元中p38,p-p38,JNK,p-JNK,Bax,Bcl-2和Caspase-3的表达。结果发现,不同剂量的OMT(0.37~6.0 g·L-1)和海马神经元共培养24 h,海马神经元生长状态良好;LPS刺激后,海马神经元LDH释放率增加(P<0.01),JNK和p38的磷酸化水平明显增加(P<0.01),Bax/Bcl-2的比例及Caspase-3的表达上调(P<0.01),海马神经元凋亡增加。OMT预处理后,能明显降低海马神经元经LPS刺激后的LDH释放(P<0.05或P<0.01),减少p38和JNK磷酸化水平,降低Bax/Bcl-2的比例及Caspase-3的表达(P<0.01),海马神经元凋亡减少。综上,OMT能降低经LPS激活的p38和JNK磷酸化水平,下调Bax/Bcl-2的比例和Caspase-3的表达,从而抑制海马神经元凋亡。OMT通过p38/JNK信号途径抑制海马神经元的凋亡。
[关键词] 苦参素; 海马神经元; 细胞凋亡; p38/JNK
[Abstract] To investigate the effect and mechanism of oxymatrine(OMT) on hippocampal neurons apoptosis. Effect of OMT on survival of hippocampal neurons was measured by MTT.Effect of OMT on LPS-induced lactate dehydrogenase(LDH) release rate in hippocampal neurons was measured by biochemical methods. Hoechst 33342 staining was used to observe the apoptotic morphology of hippocampal neurons.The mRNA expression levels of Bax, Bcl-2, and Caspase-3 were detected by Real-time quantitative PCR(RT-qPCR), and the protein expression levels of p38, p-p38, JNK, p-JNK, Bax, Bcl-2 and Caspase-3 were detected by Western blot.The results showed that, hippocampal neurons all grew well after treatment by different doses (0.37-6.0 g·L-1) of OMT for 24 h. Stimulation from LPS increased the release of LDH(P<0.01), improved the JNK and p38 phosphorylation levels(P<0.01), increased the proportion of Bax/Bcl-2 and the expression of Caspase-3(P<0.01), and promoted the apoptosis of hippocampal neurons. OMT pretreatment could significantly reduce the release of LDH induced by LPS stimulation(P<0.05 or P<0.01), reduce the p38 and JNK phosphorylation, decrease the expression of Caspase-3 and Bax/Bcl-2(P<0.01), and diminish the apoptosis of hippocampal neurons.In conclusion, OMT could reduce the LPS-induced phosphorylation of p38 and JNK, down-regulate the Bax/Bcl-2 ratio and expression of Caspase-3, thus inhibiting apoptosis of hippocampal neurons. The mechanism may be associated with p38/JNK signaling pathway.
[Key words] oxymatrine; hippocampal neurons; apoptosis; p38/JNK
神經退行性疾病(neurodegenerative disease,ND)是一类慢性、进行性神经系统疾病,神经细胞退行性病变是它们的共同特点。在大多数ND中,尤其是阿尔茨海默病(Alzheimer′s disease,AD) 特征性病理变化之一是脑内神经元数目明显减少,以海马区和基底前脑受累最为严重,神经元减少平均可达47%。近年来认为细胞凋亡(apoptosis)是引起AD神经元数目减少的重要原因[1-3]。
然而,目前尚无有效的药物阻止或抑制AD脑组织中神经元的凋亡。苦参素(oxymatrine,OMT)是从苦参、苦豆子及广豆根中分离提纯出来的生物碱,具有四环的喹嗪啶结构,药理和临床试验证明,OMT可减少多种炎症因子的活化,具有抗凋亡的药理作用[4]。本课题组前期研究发现,OMT 能明显抑制由LPS诱导的大鼠脑内炎症反应,保护神经元[5]。但对神经退行性疾病如AD神经元凋亡的影响及其机制未见报道。
本项目以非甾体抗炎药阿司匹林(aspirin/acetylsalicylic acid,ASA)为阳性药对照[6],应用不同剂量的OMT分别预处理海马神经元,再用LPS刺激海马神经元,运用实时定量PCR(Real-time quantitative PCR,RT-qPCR)和蛋白免疫印迹法(Western blot,WB)等方法探讨OMT通过p38/JNK信号途径对海马神经元凋亡的影响及其可能机制。通过上述研究,期望在理论上为OMT在抑制海马神经元凋亡作用方面提供更多的实验依据。
1 材料
1.1 动物 新生1 d的SD大鼠,SPF级,由南通大学实验动物中心提供,许可证号SYXK(苏)2012-0031。
1.2 仪器 细胞培养板(Corning 公司,美国);细胞培养箱(Jouan公司,法国);超净工作台(苏州华宏净化技术有限公司);各种型号的移液器(Eppendorf公司,德国);XDS-1B倒置生物显微镜(重庆光电仪器有限公司);PTC-100 PCR仪(美国Bio-Rad公司);Eppendorf核酸蛋白分析仪(德国Eppendorf公司);Elx800全自动酶标仪(美国宝特仪器有限公司);Mini protein-3电泳装置(美国Bio-Rad公司);DK-8D型电热恒温水槽(上海一恒科技有限公司);电热恒温干燥箱(上海华联环境实验设备公司恒温仪器厂);电热恒温水槽(上海华联环境实验设备公司恒温仪器厂);PB-10 pH计(北京塞多利斯公司);TY-80S脱色摇床(南京新校园生物技术研究所)。
1.3 药品与试剂 苦参素(宝鸡市方晟生物开发有限公司,批号F20110322),MTT(Fluka公司),LPS(Sigma,USA),BCA蛋白浓度测定试剂盒(增强型)(海门碧云天生物技术研究所,编号P0010S),十二烷基硫酸钠(sodium dodecylsulphate,SDS)(国药集团化学试剂有限公司,批号F20080521),聚偏二氟乙烯(polyvinylidene difluoride,PVDF)膜(MILLIPORE),预染蛋白质标准(Fermentas,批号00067755),SDS-PAGE蛋白上样缓冲液(Fermentas,批號00066150),GENMED 乳酸脱氢酶(LDH)试剂盒 (GENMED SCIENTIFICS INC.U.S.A,编号GMS10073v.A),兔抗Caspase-3多克隆抗体(rabbit anti-Caspase-3 polyclonal antibody,Santa Cruz,USA),兔抗Bax多克隆抗体(rabbit anti-Bax polyclonal antibody,Santa Cruz,USA),兔抗Bcl-2多克隆抗体(rabbit anti-Bcl-2 polyclonal antibody,Santa Cruz,USA),鼠抗β-actin单克隆抗体(mouse anti-β-actin monoclonal antibody,Santa Cruz,编号sc-81178),JNK Rabbit Monoclonal Antibody (Epitomics,3496-1),JNK Phospho Rabbit Monoclonal Antibody (Epitomics,2155-1),p38 MAPK Rabbit Monoclonal Antibody (Epitomics,1544-1),p38 MAPK Phospho Rabbit Monoclonal Antibody (Epitomics,1229-1),Trizol reagent(Invitrogen),PCR引物由上海睿强生物科技有限公司设计和合成(表1)。
2 方法
2.1 OMT对海马神经元存活率的影响 原代培养大鼠海马神经元悬液,调整细胞密度为1×104个/mL,接种于96孔培养板中培养7 d左右,分为正常对照组和不同质量浓度的OMT(0.37,0.75,1.5,3.0,6.0 g·L-1)[7]组。吸去各组的培养基,不同浓度的OMT组:为含有相应浓度OMT的培养基,正常对照组换为等体积的培养基,孵育24 h,用MTT法检测各组海马神经元的存活率。
实验步骤:吸去96孔板的细胞原培养液,每个孔加入25 μL MTT,37 ℃孵育4 h后弃去上清液,每孔加入100 μL 20%SDS溶液,37 ℃孵育24 h,570 nm波长处测定其吸光度。以正常对照组的细胞活力为100%,计算各实验组细胞的存活百分率。细胞存活率=(给药组的细胞活力÷正常对照组的细胞活力)×100%。实验重复6次。
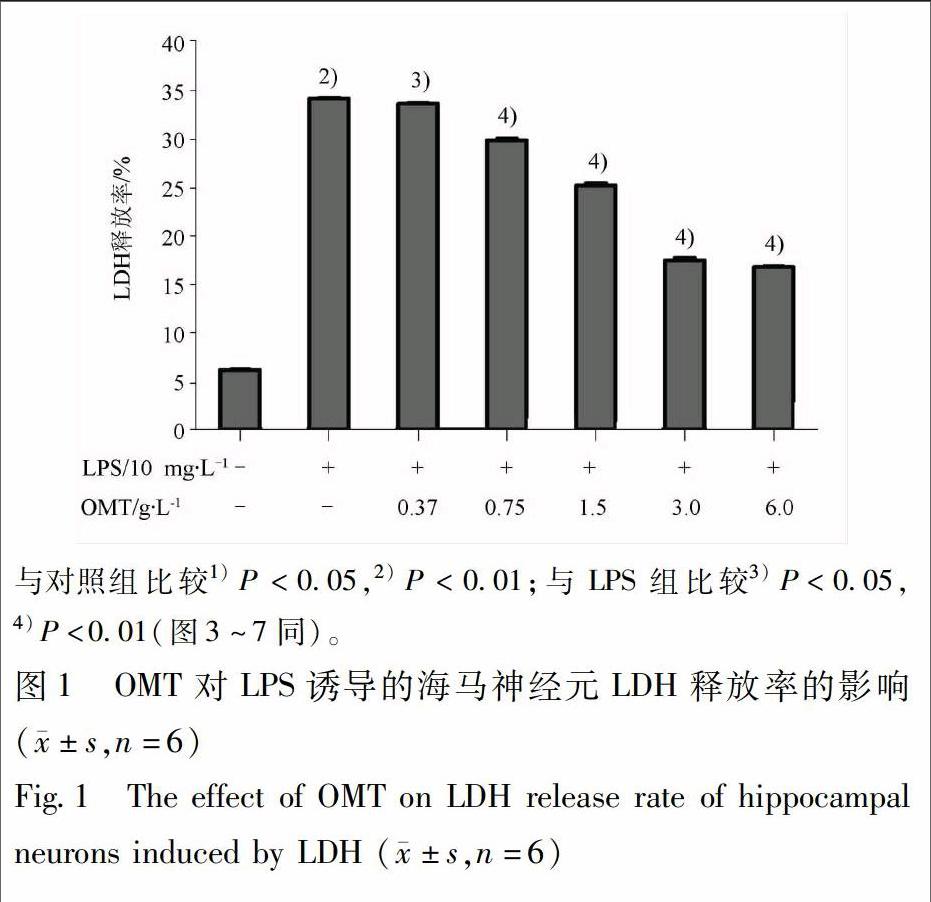
2.2 不同浓度OMT预处理对LPS诱导的海马神经元LDH释放率的影响 把海马神经元接种于96孔培养板培养7 d左右,分为正常对照组和不同浓度的OMT(0,0.37,0.75,1.5,3.0,6.0 g·L-1)预处理组。不同浓度的OMT预处理组:根据前期研究结果及参考文献方法[7-8],采用含有相应浓度OMT的培养基孵育3 h后,再加入终质量浓度为10 mg·L-1的 LPS作用24 h,正常对照组加入等体积的培养基,用乳酸脱氢酶(LDH)试剂盒测定各组海马神经元的LDH的释放量。具体步骤参考LDH试剂盒说明书,实验重复6次。
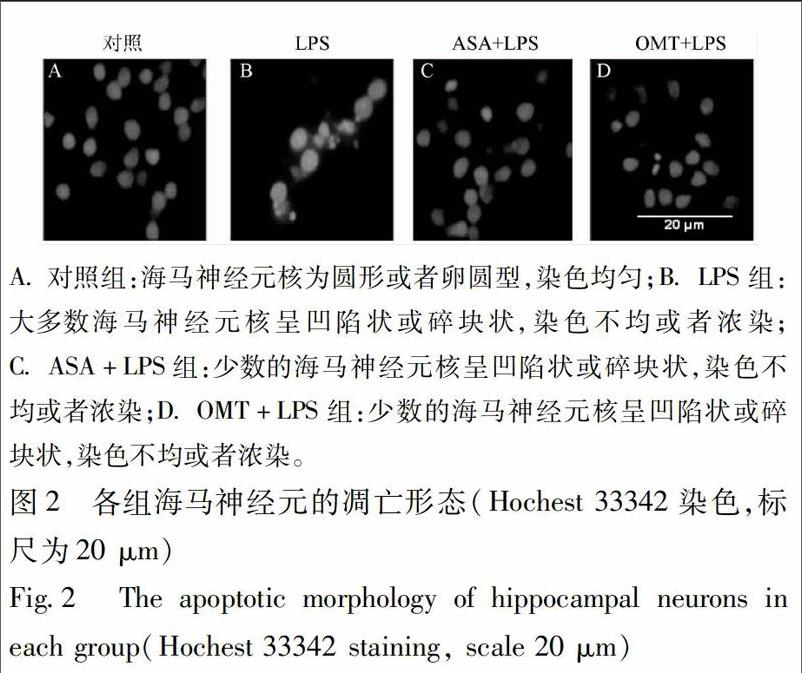
2.3 Hochest 33342染色观察海马神经元凋亡形态 实验分组:①正常对照组(仅加入培养基);②LPS组(10 mg·L-1);③ASA(5.0 mmol·L-1)[9]+LPS(10 mg·L-1)组(阳性药对照组);④OMT中剂量(1.5 g·L-1)+LPS(10 mg·L-1)组。具体步骤如下:于玻片上将培养7 d的海马神经细胞,采用OMT预处理3 h 后,加入终浓度为10 mg·L-1的LPS,作用24 h。取出玻片进行免疫荧光化学染色,进行冲洗。4%多聚甲醛4 ℃固定。10%山羊血清室温封闭1 h弃血清,再次冲洗。Hoechst 33342(1∶1 000稀释)室温15 min,ddH2O冲洗。用抗荧光淬灭封片液封片,荧光显微镜下观察细胞核形态学的变化,进行凋亡核计数并随机拍照。
2.4 RT-qPCR法检测OMT预处理对LPS诱导的海马神经元Bax,Bcl-2,Caspase-3 mRNA的表达变化 原代培养大鼠海马神经元,实验分成7组:①正常对照组(Normal组,仅加入培养基);②脂多糖组(LPS组,10 mg·L-1);③阿司匹林+脂多糖组(ASA+LPS组,5.0 mmol·L-1+10 mg·L-1);④苦参素组(OMT,1.5 g·L-1);⑤苦参素低剂量+脂多糖组(OMT-L+LPS组,0.75 g·L-1+10 mg·L-1);⑥苦参素中剂量+脂多糖组(OMT-M+LPS组,1.5 g·L-1+10 mg·L-1);⑦苦参素高剂量+脂多糖组(OMT-H+LPS组,3.0 g·L-1+10 mg·L-1),提取细胞总RNA用于Bax,Bcl-2,Caspase-3 mRNA测定。按照文献方法操作[10]。
2.5 Western blot 法检测OMT预处理对LPS诱导的海马神经元p38,p-p38,JNK,p-JNK,Bax,Bcl-2及Caspase-3的表达变化 取原代培养7 d的细胞,换成无血清培养基,实验分组同RT-qPCR法,蛋白质浓度用BCA法检测,蛋白印迹结果重复3次,用ImageJ软件进行灰度分析,GraphPad Prism 5软件分析统计各组特异性蛋白质表达量(均以β-actin为内参)。
2.6 数据处理与统计分析 实验数据用±s表示,用GraphPad Prism 5统计软件进行方差分析和两两比较,对数据进行统计学分析,以P<0.05为有统计学意义。
3 结果
3.1 OMT对海马神经元存活率的影响 以对照组细胞活力为100%,按公式计算出各组细胞存活率。结果可见,与对照组相比,不同浓度的OMT各给药组之间没有明显统计学差异。结果显示不同浓度的OMT(0.37~6.0 g·L-1)和海马神经元共培养24 h,海马神经元生长状态比较好。
3.2 不同浓度OMT预处理对LPS诱导的海马神经元LDH释放率的影响 观察不同浓度的OMT对LPS诱导的海马神经元的毒性(LDH释放率)作用。结果可见,与对照组相比,LPS组的海马神经元的LDH释放率明显增大(P<0.01)。与LPS组相比,不同浓度的OMT能够明显降低LPS诱导的海马神经元的LDH释放率(P<0.05或P<0.01),且在一定浓度范围内随着OMT浓度的增大,降低LDH释放率的作用呈增大趋势。但OMT在低质量浓度0.37 g·L-1减少LPS诱导LDH释放率相对较弱,而OMT在3.0,6.0 g·L-1时LDH释放率没有明显统计学差异。因此,本实验选择OMT为0.75,1.5,3.0 g·L-1进行后续实验,见图1。
3.3 Hochest 33342 染色观察各组海马神经元凋亡形态 各组海马神经元Hoechst 33342染色,结果显示正常的海马神经元核为圆形或者卵圆型,染色均匀。而一部分神经元核呈凹陷状或碎块状,染色不均或者浓染,可能为凋亡细胞。与正常对照组相比,LPS组凋亡细胞相对较多。与LPS组相比,ASA+LPS组和OMT+LPS组凋亡细胞显著减少,见图2。
3.4 Western blot法检测各组海马神经元p-38及p-p38蛋白的表达 对照组海马神经元中p38磷酸化蛋白表达相对较少。与对照组相比,LPS组p38磷酸化蛋白的表达明显上调(P<0.01)。与LPS组相比,ASA+LPS组能够明显降低LPS诱导的p38磷酸化蛋白表达的增高(P<0.01);各剂量OMT+LPS组能减弱LPS诱导的p38磷酸化蛋白表达的作用,且在一定的剂量范围内随OMT的剂量增大,作用增强(P<0.05或P<0.01),见图3。
3.5 Western blot法检测各组海马神经元JNK及p-JNK蛋白的表达 对照组海马神经元中JNK磷酸化蛋白表达相对较少。与对照组相比,LPS组JNK磷酸化蛋白的表达明显上调(P<0.01);OMT组与对照组相比,JNK磷酸化蛋白表達没有显著统计学意义。与LPS组相比,ASA+LPS组JNK磷酸化蛋白表达明显下调(P<0.01);各剂量OMT+LPS组能够明显降低LPS诱导的JNK磷酸化蛋白表达的增高(P<0.05或P<0.01),且在一定剂量范围内随着OMT剂量增大,JNK磷酸化蛋白的表达逐渐减少,见图4
3.6 RT-qPCR检测各组海马神经元中Bax,Bcl-2mRNA的表达变化 与对照组相比,LPS组Bax/Bcl-2 mRNA的比例明显增高(P<0.01)。与LPS组相比,ASA+LPS组Bax/Bcl-2 mRNA的比例明显降低(P<0.01);各剂量OMT+LPS组Bax/Bcl-2 mRNA的比例显著低于LPS组(P<0.01),见图5。
OMT+LPS组在一定的剂量范围内随OMT剂量的增大,Bax/Bcl-2比例和Caspase-3蛋白的表达呈递减趋势,具有统计学意义(P<0.01),见图7。
3.7 RT-qPCR检测各组海马神经元中Caspase-3 mRNA的表达变化 对照组海马神经元中Caspase-3 mRNA的表达相对较少。与对照组相比,LPS组Caspase-3 mRNA表达明显增多(P<0.01)。与LPS组相比,ASA+LPS组能够明显降低LPS诱导的Caspase-3 mRNA的表达增多,且具有统计学意义(P<0.01);各剂量OMT+LPS组在一定剂量范围内随着OMT剂量的增大,其降低LPS诱导的海马神经元中Caspase-3 mRNA表达增多的效果也逐渐增强。(P<0.05或 P<0.01),见图6。
3.8 Western blot法检测各组海马神经元中Bax,Bcl-2及Caspase-3蛋白的表达 对照组中,Bax/Bcl-2比例和Caspase-3蛋白的表达比较少。与对照组相比,LPS组Bax/Bcl-2比例和Caspase-3蛋白的表达明显上调(P<0.01);OMT组Bax/Bcl-2比例和 Caspase-3蛋白的表达没有明显统计学差异。与LPS组相比,ASA+LPS组能够明显下调Bax/Bcl-2比例和Caspase-3蛋白的表達(P<0.01);各剂量OMT+LPS组在一定的剂量范围内随OMT剂量的增大,Bax/Bcl-2比例和Caspase-3蛋白的表达呈递减趋势,具有统计学意义(P<0.01),见图7。
4 讨论
阿尔茨海默病(AD)、肌萎缩性脊髓侧索硬化(amyotrophic lateral sclerosis,ALS)和帕金森综合征(Parkinson′s syndrome,PD)等神经退行性疾病,在海马区和基底前脑等脑组织的神经元发生了凋亡。但目前尚无有效药物阻抑神经元的凋亡。OMT具有抗炎、抗氧化、抗病毒、抗肿瘤、抗过敏等药理作用[11] ,可抑制核因子κB(nuclear factor κB,NF-κB),降低多种炎症因子的活化,具有抗凋亡的药理作用。
然而,OMT对海马神经元凋亡的影响及其机制尚不清楚。
4.1 OMT能降低海马神经元LDH 释放率抑制细胞凋亡 OMT预处理对LPS诱导的海马神经元LDH释放率结果显示,LPS对海马神经细胞膜有毒性作用,OMT在适当的剂量范围内,能明显减少LPS诱导的LDH释放率,对海马神经细胞膜有保护作用。Hochest染色法结果可见,LPS刺激后对海马神经元的毒性作用引起了细胞凋亡;OMT预处理可以明显抑制LPS诱导的海马神经元凋亡。
4.2 OMT能降低LPS诱导的海马神经元JNK和p38磷酸化水平 丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)是一类丝/苏氨酸残基的蛋白激酶。MAPK的作用是将信号从细胞表面转导到细胞核内的十分重要传递者。MAPK信号转导通路中主要有,p38通路、c-Jim氨基末端激酶(c-Jun N-terminal kinase,JNK)通路、细胞外信号调节蛋白激酶(extracellular signal-regulated protein kinases,ERK) 通路。p38已经被证实在PC12和小脑颗粒细胞的凋亡调控的过程中有着非常重要的作用,而且p38在被胰岛素预处理过培养的新生神经细胞中将会失活[12-13]。p38被磷酸化,表明了p38激活。JNK途径的激活参与了不同刺激所致凋亡的启动。JNK激活不仅参与了药物诱导的凋亡,而且参与了一些DNA损伤刺激引起的凋亡[14]。JNK的磷酸化产物p-JNK标志着JNK激活。ERK 信号通路在神经细胞凋亡中具有双重作用,即既有抗凋亡作用,也有促进凋亡作用,因其作用的复杂性,故本实验采用了LPS剌激海马神经元,Western blot检测p38,JNK及其磷酸化蛋白的表达变化。LPS能明显上调p38和JNK磷酸化蛋白的表达,p38和JNK被激活,从而促进海马神经元的凋亡。各剂量OMT预处理能够明显降低LPS诱导的海马神经元JNK和p38磷酸化水平,从而抑制海马神经元凋亡。OMT抑制LPS诱导的海马神经元凋亡与降低p-JNK,p-p38有关。
4.3 OMT预处理能降低海马神经元Bax/Bcl-2的比例及Caspase-3的表达 OMT能降低p-JNK与p-p38的表达,然后又通过何种机制抑制LPS诱导的海马神经元凋亡?近年来研究发现,JNK能介导多种细胞外刺激引起细胞凋亡,参与了多种细胞凋亡的发生[15]。活化后的JNK有一部分存在于细胞质内,可以通过磷酸化作用直接调节Bcl-2家族成员(Bim,Bax,Bcl-2等)的活性,从而诱导线粒体途径的细胞凋亡[16] 。在Bcl-2家族成员中,Bax在线粒体细胞凋亡途径中发挥着主要作用。活化的JNK一方面能够磷酸化激活Bax,Bim等,同时又可以抑制Bcl-2等抗凋亡蛋白。活化的Bax移位至线粒体外膜,使线粒体膜通透性增高释放Cyt C,Smac/DIABLO及凋亡诱导因子等促进凋亡的线粒体蛋白[17]。释放到细胞质中的Cyt C与凋亡酶激活因子-1(Apaf-1)等结合形成凋亡复合体,从而诱导Caspase依赖的线粒体途径的细胞凋亡。激活后的p38能够活化Caspase-3, 启动细胞凋亡信号通路,活化的Caspase-3又进一步切割不同的底物,使蛋白酶级联反应不断放大,促使细胞凋亡。Liu等研究发现磷酸化的p38还能够上调Fas/FasL,引起Caspase-3活化,认为p38在细胞凋亡过程中发挥了双重作用,但细胞的凋亡最终都是通过活化Caspase-3完成的[18]。
Bcl-2基因家族包括两大类:一类是凋亡抑制基因:Bcl-2,Bcl-x1等;另一类是促凋亡基因:Bax,Bak等,Bax蛋白具有对抗Bcl-2蛋白抑制凋亡的作用,Bax与Bcl-2在体内通过结合形成二聚体而发挥作用。当Bax与Bcl-2表达相平衡时,细胞的存活期正常;当Bcl-2高表达,而Bax的表达未相应增多时,Bax与Bcl-2形成异型二聚体发挥作用,抑制凋亡的发生,细胞的存活期延长;当Bax高表达,而Bcl-2形成同型二聚体,启动Caspase酶系级联反应促进细胞凋亡。因此,Bax/Bcl-2比值的变化较单一的Bax或者Bcl-2的表达更可靠和敏感,更可以作为检测细胞是否发生凋亡的指标之一。
综上所述,LPS通过上调海马神经元p38和JNK磷酸化蛋白水平,p38和JNK被激活,使Bax/Bcl-2的比例和Caspase-3表达增加,从而促进海马神经元的凋亡。各剂量OMT预处理能够明显降低LPS诱导的海马神经元JNK和p38磷酸化水平,使Bax/Bcl-2的比例和Caspase-3表达减少,从而抑制海马神经元凋亡。
[参考文献]
[1] Blennow K, Hampel H, Weiner M, et al. Cerebrospinal fluid and plasma biomarkers in Alzheimer disease[J]. Nat Rev Neurol, 2010, 6(3): 131.
[2] McDonald J M, Cairns N J, Taylor-Reinwald L, et al. The levels of water-soluble and triton-soluble Abeta are increased in Alzheimer′s disease brain[J]. Brain Res, 2012, 1450: 138.
[3] Kazmierczak A, Czapski G A, Adamczyk A, et al. A novel mechanism of non-Abeta component of Alzheimer′s disease amyloid (NAC) neurotoxicity. Interplay between p53 protein and cyclin-dependent kinase 5 (Cdk5)[J]. Neurochem Int, 2011, 58(2): 206.
[4] 王剛, 董晓巧, 杜权, 等. 氧化苦参碱抗大鼠脑外伤后神经细胞凋亡及机制研究[J]. 中国现代应用药学,2012, 29(4): 289.
[5] Mao J H, Hu Y, Zhou A L, et al. Oxymatrine reduces neuroinflammation in rat brain A signaling pathway[J]. Neural Regeneration Res, 2012, 7(30): 2333.
[6] 方曲,郝君,何凡,等. 阿司匹林对大鼠脑缺血后解偶联蛋白-4和ATPase-6表达的影响[J]. 中国临床神经科学,2012, 20(3): 258.
[7] 朱道立,王康乐,陈佩林,等. 氧化苦参碱对H2O2诱导的L6成肌细胞凋亡的影响[J]. 生物化学与生物物理进展,2012, 39(7): 662.
[8] He Y, Zhou A L, Jiang W. Toll-like receptor 4-mediated signaling participates in apoptosis of hippocampal neurons[J]. Neural Regeneration Res, 2013, 8(29): 2744.
[9] M H, kisaalita W S. Comparative evaluation of the susceptibility of neuronal (N1E-115) and non-neuronal (HeLa) cells to acetylsalicylic acid (ASA)cytotoxicity by confocal microscopy[J]. Toxicol In Vitro, 1996, 10: 447.
[10] 何筑,况时祥,张树森,等.脑通汤对缺氧/复氧大鼠海马神经云Bcl-2/Bax和Caspase-3表达的影响[J].中国老年学杂志,2015,24(35):6973.
[11] Tang L, Dong L N, Peng X J, et al. Pharmacokinetic characterization of oxymatrine and matrine in rats after oral administration of radix sophorae tonkinensis extract and oxymatrine by sensitive and robust UPLC-MS/MS method[J]. J Pharm Biomed Anal, 2013, 83: 179.
[12] Di Benedetto B, Kallnik M, Weisenhorn D M, et al. Activation of ERK/MAPK in the lateral amygdala of the mouse is required for acquisition of a fear-potentiated startle response[J]. Neuropsychopharmacology, 2009, 34(2): 356.
[13] 黄浩,马增春,王宇光,等. 阿魏酸对脂多糖损伤的PC12细胞和大鼠海马神经元细胞的保护作用[J].中国药理学与毒理学杂志,2016,30(4):330.
[14] Taylor C A, Zheng Q, Liu Z, et al. Role of p38 and JNK MAPK signaling pathways and tumor suppressor p53 on induction of apoptosis in response to Ad-eIF5A1 in A549 lung cancer cells[J]. Mol Cancer, 2013, 12: 35.
[15] Yarza R, Vela S, Solas M, et al. c-Jun N-terminal kinase (JNK) signaling as a therapeutic target for Alzheimer′s disease[J]. Front Pharm, 2015, 6: 321.
[16] Ju J, Qi Z, Cai X, et al. Toosendanin induces apoptosis through suppression of JNK signaling pathway in HL-60 cells[J]. Toxicol In Vitro, 2013, 27: 232.
[17] Chen T C, Chien C C, Wu M S, et al. Evodiamine from Evodia rutaecarpa induces apoptosis via activation of JNK and PERK in human ovarian cancer cells[J]. Phytomedicin, 2016, 23: 68.
[18] Liu S X, Zhang Y J, Guo H F, et al. The regulatory effect of the p38 signaling pathway on valdecoxib-induced apoptosis of the Eca109 cell line[J]. Oncol Rep, 2009, 22: 313.
