拟南芥转录共激活子ANGUSTIFOLIA3(AN3)调控花的雄蕊的形成
2018-04-10徐梦珂蒋继宏孟来生
李 丹 徐梦珂 蒋继宏 孟来生
(江苏师范大学江苏省药食植物生物技术国家重点实验室培育点/生命科学学院,徐州 221116)
花是被子植物主要的繁殖器官,在繁育后代的过程中,发挥着极其重要的作用[1],而授粉是种子植物繁殖发育必经的过程,植物的雄蕊是种子植物产生花粉的器官,雌蕊是种子植物的雌性繁殖器官,雌蕊的柱头有粘液可以粘附花粉[2],花粉落到雌蕊的柱头上[3]就开始生长,穿过雌蕊到达子房与卵子结合,并发育形成种子。植物的花能否正常授粉直接影响到作物的产量和传种,其雄蕊和雌蕊的正常发育是重要因素,研究基因调控雄蕊发育对改良农作物育种及增加产量具有十分重要的意义。
拟南芥ANGUSTIFOLIA3(AN3)与编码人转录共激活因子和滑膜肉瘤易位蛋白(SYT)是同源基因[4]。AN3是拟南芥[3]中一个小基因家族的成员,有许多重要功能,如涉及调节叶原基中的细胞增殖,近远轴面的决定和建立子叶同一性[3~6]。AN3的表达仅限于叶肉细胞内,在叶片表皮细胞内未检测到[5]。AN3-MINI3基因级联可通过调控种子胚胎发育控制细胞分裂和细胞伸长[7]。AN3是涉及调节叶片和花瓣的生长以及形状的组成部分[8]。最近,我们的研究发现AN3转录共激活子在种子发育[7],花青素生物合成[9],根系统发育[10],干旱胁迫和水分利用[11]等方面都发挥着重要作用。AN3的这些功能表明它参与拟南芥生长发育,代谢和非生物胁迫等重要生理过程,是一个重要的遗传因子。然而AN3基因是否调控拟南芥花的雄蕊发育目前尚未研究。
本研究发现突变体an3-1和an3-4植株的雄蕊均比野生型短,而雌蕊却无明显变化。AN3的GUS染色实验表明,AN3基因在花器官中明显表达。综合以上结果,我们得出结论,AN3基因参与调控拟南芥花的雄蕊形成。
1 材料与方法
1.1 实验材料
1.1.1实验植物
本研究所用到的拟南芥材料均为哥伦比亚(Columbia)生态型背景,有拟南芥野生型Col-0、an3-4敲除突变体[由G.Horiguchi教授(日本丰岛市立兴大学)热情提供],an3-1(CS241)敲除突变体[购自拟南芥生物研究中心(ABRC)(俄亥俄州立大学,俄亥俄州哥伦布市)提供]。AN3基因敲除靶位点引物序列设计,AN3基因敲除所用的载体,构建的情况请参看[3]。
1.1.2实验试剂
UNIQ-10柱式Trizol总RNA抽提试剂盒;AMV第一链cDNA合成试剂盒;PCR(Taq)扩增试剂盒。以上试剂盒均购自生工生物工程(上海)股份有限公司。
1.2 实验方法
1.2.1拟南芥的培养
将野生型和突变体拟南芥的种子在4℃下进行处理3天后,以2.5%次氯酸钠消毒10 min后,用高温高压灭菌的去离子水荡洗4次,播种在含1%蔗糖和0.8%琼脂且pH5.8的MS培养基上,并在21±2℃,16 h/8 h光暗周期,光照强度6 000~8 000 lx,湿度75%的环境中培养,每天观察。待幼苗长出4片左右真叶后,便将其移栽到浸透MS营养液的灭菌的基质土中,同等温度、光照和湿度的条件下继续培养,每周浇一次MS营养液[12]。
1.2.2RT-PCR检测AN3基因的表达量
通过UNIQ-10柱式Trizol总RNA抽提试剂盒,利用孟[11~12]等人描述的方法,从待测样品叶片中提取总RNA,使用AMV第一链cDNA合成试剂盒对总RNA进行逆转录,产生的cDNA用作基于RT-PCR的基因表达分析的模板进行PCR扩增。使用的引物如下:
TUB4(F-GACGCTTCATCTCGTCC;R-GTAAACGTAGGTGAGTCCA);AN3(F-5′-GCCTCAGCCACCAAGTGTGCAT-3′ and R-5′-ACCGCCACCACCACTTCCCA-3′)。
1.2.3花的雄蕊和雌蕊长度测量方法
使用HIROX三维视频显微镜在相应放大倍率下拍摄花的雄蕊和雌蕊,通过扫描器官形成数字图像,然后使用Image J软件测量雄蕊和雌蕊的长度。
1.2.4AN3基因敲除靶位引物序列设计
AN3F-5′-GCC TCA GCC ACC AAG TGT GCA T-3′;R-5′-ACC GCC ACC ACC ACT TCC CA-3′。
1.2.5拟南芥AN3启动子GUS表达载体构建
通过启动子分析,插入2.0 kB的启动子片段构建拟南芥AN3(At5g28640)启动子-GUS表达载体,扩增引物为(P1-ggg gac aag ttt gta caa aaa agc agg ct TTT GTA AGC GTT TCA GAA TCC T,P2- ggg gac cac ttt gta caa gaa agc tgg gt TAA CTA TTG AAG ATG TGT ATC TC)。并将这些片段插入到pCB308R质粒中[11~12]。之后,浓杆菌转化拟南芥植物,抗生素卡纳霉素筛选转基因苗,从而获得Pro-AN3-GUS植株。
1.2.6GUS染色
β-葡糖苷酸酶(GUS),使用混合缓冲液(1 mmol·L-1X-gluc,60 mmol·L-1NaPO4缓冲液,0.4 mmol·L-1K3Fe(CN)6/K4Fe(CN)6和0.1%(v/v)Triton X-100),将样品(Pro-AN3-GUS)染色,然后在37℃下培养8个小时。GUS染色后,使用30%、50%、70%、90%和100%浓度梯度的乙醇约30分钟处理每个样品,使其除去叶绿素[12~13]。最后,使用HIROX三维视频显微镜在相关放大倍数下拍摄材料[14]。
2 结果与分析
2.1 野生型与突变体AN3基因的表达
以持家基因TUB4作为对照进行RT-PCR,扩增循环数为30。由图1可知,野生型拟南芥(WT)中明显扩增出了300 bp的片段,则表明WT中AN3基因正常表达;突变体an3-1中没有扩增条带,说明该突变体中AN3基因的表达缺失,则突变体an3-1中AN3基因已被敲除;同样的,突变体an3-4中也没有扩增条带,说明该突变体中AN3基因的表达缺失,突变体an3-4中AN3基因已被敲除。以上实验证明,我们已经获得了所需要的研究材料。
2.2 突变体表型分析
测量出具体的雄蕊和雌蕊的长度(图2)。拟南芥为自花授粉植物,自花授粉植物必然是兼有雄蕊和雌蕊的完全花,而且雌蕊雄蕊基本上同时成熟,授粉需将花粉从花药到柱头移动。从表型上观察发现野生型(Col-0)植株的雄蕊和雌蕊生长正常,即可正常授粉,正常繁殖发育;然而突变体an3-1和an3-4的雄蕊较野生型明显变短,突变体an3-1和an3-4的雌蕊也较野生型变短,但无明显变化。结果初步表明:AN3基因可能参与拟南芥的花的雄蕊发育的调控。

图1 用RT-PCR检测AN3在an3-1和an3-4中的表达情况 WT.野生型Col-0拟南芥;TUB4.持家基因,作为对照 以此检测AN3在野生型、突变体an3-1和突变体an3-4中的表达量。Fig.1 RT-PCR assays AN3 expression in an3-1 and an3-4 mutants WT. Wild-type Col-0 A.thaliana; TUB4.Housekeeping gene,as a control The expression levels of AN3 in wild-type,mutant an3-1 and mutant an3-4 were examined.
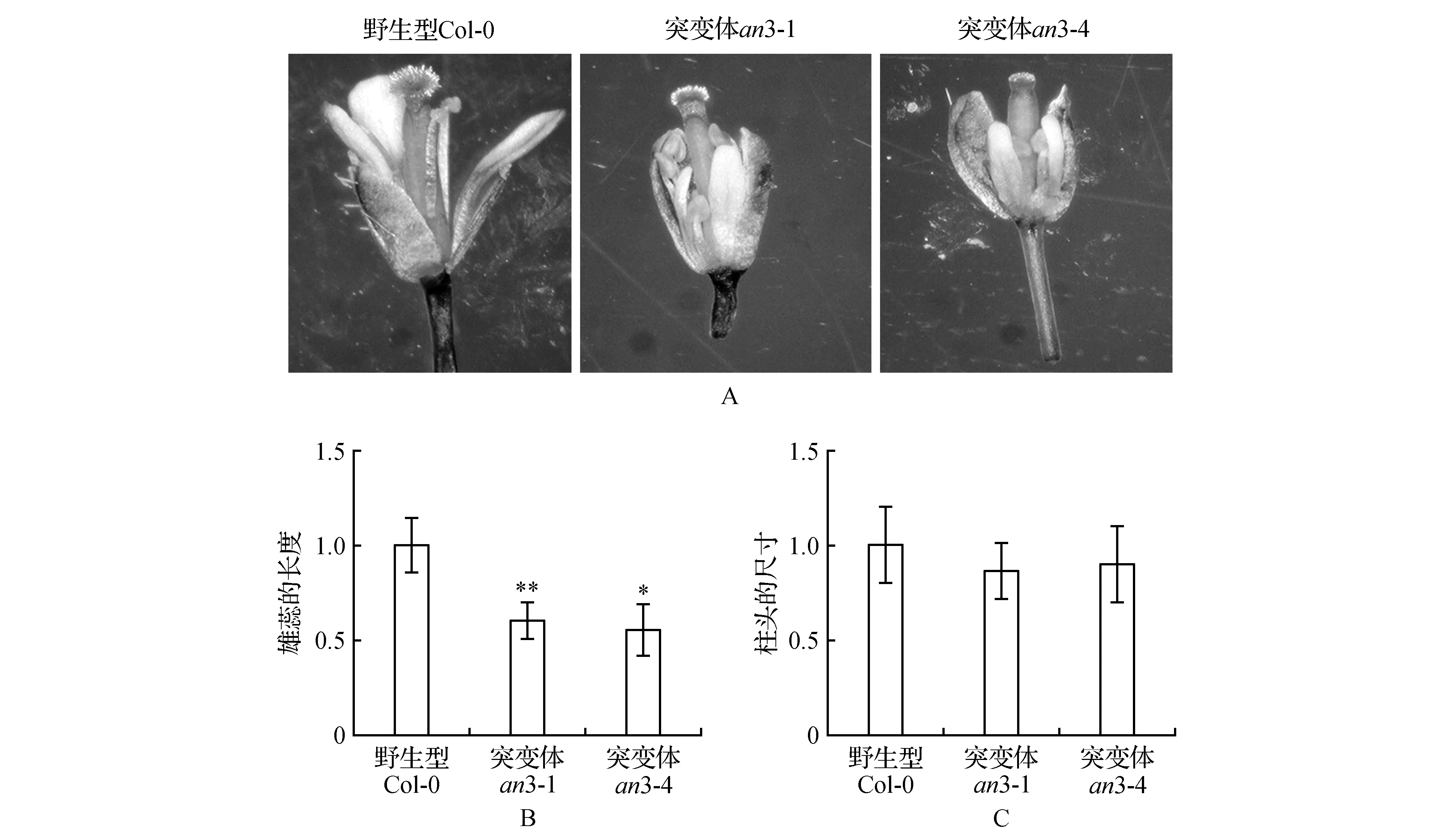
图2 突变体an3-1和an3-4的雄蕊和雌蕊表型特征 A.野生型和突变体雄蕊的生长状态;B.野生型和突变体雄蕊的长度(以野生型的雄蕊长度为1.0;n>12;**P<0.01);C.野生型和突变体雌蕊的长度(以野生型的雄蕊长度为1.0)Fig.2 AN3 phenotypic characteristics of stamens and pistils in an3-1 and an3-4 mutants A.The growth status of wild-type and mutant stamens; B.The length of wild-type and mutant stamens(Col-0 is set as 1.0;n>12;**P<0.01); C.The length of wild-type and mutant pistils(Col-0 is set as 1.0)
2.3 AN3基因在种子胚、柱头、成熟的花粉和花瓣均有表达(Pro-AN3-GUS)
以上实验证明AN3基因可能对花发育过程有调控作用,这必定要求AN3基因在花器官中表达。为明确AN3基因可能参与拟南芥的生殖发育的调控,本研究构建了AN3启动子GUS表达载体,GUS染色表明,拟南芥AN3基因在种子胚、柱头、成熟的花粉及花中都能表达(图3),这个结果与AN3基因的敲除突变体花器官的发育异常一致。这一结果暗示着该基因可能在整个雄蕊生长过程中发挥着重要的作用。
既然an3-1和an3-4的雄蕊变短,是否这个异常的表型影响果荚的形成。的确,这个发育异常的表型严重地影响了授粉,从而导致果荚变小,变短 (图4),单个果荚内种子数目变少(图5),甚至有的难以形成果荚。这将严重影响产量。

图3 GUS染色 A.拟南芥种子胚中AN3的表达;B.拟南芥柱头中AN3的表达;C.拟南芥成熟的花粉中AN3的表达;D.拟南芥花中AN3的表达Fig.3 GUS staining A. Expression of AN3 in A.thaliana seed embryo; B. Expression of AN3 in stigma of A.thaliana; C. Expression of AN3 in mature pollen of A.thaliana; D. Expression of AN3 in A.thaliana flower
3 讨论
已有研究表明,AN3对花青素的积累有正向调节作用[10],AN3基因仅在叶肉细胞内有表达,在表皮细胞内未检测到[5],并且AN3-MINI3基因级联可通过调控种子胚胎发育控制细胞分裂和细胞伸长[7]。而本研究发现AN3基因在种子胚、柱头、成熟的花粉和花瓣均有表达,证明了AN3基因很可能在调控花器官的发育过程中起一定作用。的确AN3缺失的突变体的花器官发育异常,主要表现在雄蕊长度较短。何卓娜[15]等人发现野生型Col-0比chalcll1cll2三突变体雄蕊的长度明显长,此外,突变体雄蕊的柱头上未看到有黄色成熟花粉的粘附。周鹊[16]等人发现ms1521突变体的花缺失部分花瓣,雄蕊比较短,花药肥大,部分雄蕊的花药成丝状。成志鹏[17]研究表明,突变体ems1227与野生型相比,ems1227突变体的长角果短小,不含种子。这些研究与本实验结果突变体较野生型雄蕊长度短小一致。另外,刘彩霞[1]等人发现,过量表达PI的转基因烟草在花器官中存在明显表型,与野生型相比主要表现为转基因植株花冠变小,雄蕊缩短,果实畸形。AN3基因的缺失导致拟南芥雄蕊发育的异常,即拟南芥转录共激活子AN3调控花的雄蕊的形成,这一结果可能会造成后期花的败育,减少种子数目,影响果荚发育,从而造成产量降低。因此,本研究结果对改良农作物育种及增加产量具有十分重要的意义,但是AN3作为转录共激活子调控雄蕊形成的下游靶标基因是什么,以及这个调控通路由什么信号所介导都是未知的,需要进一步深入研究。
1.刘彩霞,代丽娟,刘轶,等.拟南芥AtPI基因植物表达载体的构建及其在烟草中的遗传转化[J].植物研究,2016,36(3):388-394.
Liu C X,Dai L J,Liu Y,et al.Construction of plant expression vector and genetic transformation analysis ofArabidopsisthalianaAtPIgene in Nicotiana tabacum[J].Bulletin of Botanical Research,2016,36(3):388-394.
2.徐义流,张绍玲.花粉—雌蕊相互作用的分子基础[J].西北植物学报,2003,23(10):1800-1809.
Xu Y L,Zhang S L.Molecular basis of pollen-pistil interaction[J].Acta Botanica Boreali-Occidentalia Sinica,2003,23(10):1800-1809.
3.姜茜.糖与pH影响蚕豆花粉萌发率的实验[J].生物学通报,2001,36(4):43.
JIANG Xi.Effects of sugar and pH on germination rate ofViciafabaL.pollen[J].Bulletin of Biology,2001,36(4):43.
4.Horiguchi G,Kim G T,Tsukaya H.The transcription factorAtGRF5 and the transcription coactivator AN3 regulate cell proliferation in leaf primordia ofArabidopsisthaliana[J].The Plant Journal,2005,43(1):68-78.
5.Horiguchi G,Nakayama H,Ishikawa N,et al.ANGUSTIFOLIA3 plays roles in adaxial/abaxial patterning and growth in leaf morphogenesis[J].Plant Cell Physiology,2011,52(1):112-124.
6.Kanei M,Horiguchi G,Tsukaya H.Stable establishment of cotyledon identity during embryogenesis inArabidopsisby ANGUSTIFOLIA3 and HANABA TARANU[J].Development,2012,139(13):2436-2446.
7.Meng L S,Wang Y B,Loake G J,et al.Seed embryo development is regulated via anAN3-MINI3 gene cascade[J].Frontiers in Plant Science,2016,7:1645.
8.Kim J H,Kende H.A transcriptional coactivator,AtGIF1,is involved in regulating leaf growth and morphology inArabidopsis[J].Proceedings of the National Academy of Sciences of the United States of America,2004,101(36):13374-13379.
9.Meng L S,Li Y Q,Liu M Q,et al.TheArabidopsisANGUSTIFOLIA3-YODAgene cascade induces anthocyanin accumulation by regulating sucrose levels[J].Frontiers in Plant Science,2016,7:1728.
10.Meng L S.Transcription coactivatorArabidopsisANGUSTIFOLIA3 modulates anthocyanin accumulation and light-induced root elongation through transrepression of C onstitutive P hotomorphogenic1[J].Plant,Cell & Environment,2015,38(4):838-851.
11.Meng L S,Yao S Q.Transcription co-activatorArabidopsisANGUSTIFOLIA3(AN3) regulates water-use efficiency and drought tolerance by modulating stomatal density and improving root architecture by the transrepression ofYODA(YDA)[J].Plant Biotechnology Journal,2015,13(7):893-902.
12.高亢,马惠斌,吴立柱,等.拟南芥AtCCaP2基因缺失突变体的鉴定及表型观察[J].河北农业大学学报,2012,35(5):67-71.
Gao K,Ma H B,Wu L Z,et al.Identification and phenotype of T-DNA insertAtCCaP2 gene mutant inArabidopsisthaliana[J].Journal of Agricultural University of Hebei,2012,35(5):67-71.
13.Meng L S,Wang Y B,Yao S Q,et al.ArabidopsisAINTEGUMENTA mediates salt tolerance by trans-repressingSCABP8[J].Journal of Cell Science,2015,128(15):2919-2927.
14.Meng L S,Wang Z B,Yao S Q,et al.TheARF2-ANT-COR15Agene cascade regulates ABA signaling-mediated resistance of large seeds to drought inArabidopsis[J].Journal of cell science,2015,128(21):3922-3932.
15.何卓娜,王双双,马红,等.胞外多肽激素基因CHAL/CLL1/CLL2在拟南芥雄蕊发育过程中发挥重要作用[J].植物生理学报,2016,52(2):167-176.
He Z N,Wang S S,Ma H,et al.Peptide hormonesCHAL,CLL1 andCLL2 are important for stamen development inArabidopsis[J].Plant Physiology Journal,2016,52(2):167-176.
16.周鹊,贾琦石,杨仲南,等.拟南芥雄性不育突变体ms1521的基因定位[J].上海师范大学学报:自然科学版,2008,37(3):296-300.
Zhou Q,Jia Q S,Yang Z N,et al.Genetic mapping of anArabidopsisthalianamale sterile genems1521[J].Journal of Shanghai Normal University:Natural Sciences,2008,37(3):296-300.
17.成志鹏.拟南芥心皮发育基因MS1522的功能分析及雄性不育突变体ems1227的基因定位[D].上海:上海师范大学,2012.
Cheng Z P.Function analysis ofMS1522 gene involved inArabidopsiscarpel development and genetic mapping ofArabidopsismale sterile mutantems1227[D].Shanghai:Shanghai Normal University,2012.
