灵芝孢子粉多糖含量检测方法的优化*
2018-04-10杨伟君马诗经焦春伟杨咏善陈家明梁慧嘉李良秋谢意珍
杨伟君,马诗经,焦春伟,杨咏善,陈家明,梁慧嘉,李良秋,谢意珍,**
(1.广东粤微食用菌技术有限公司,广东 广州 510663;2.广东省微生物研究所,广东 广州 510070)
灵芝孢子(Ganoderma lucidumspore) 是灵芝成熟时从菌盖中弹射出来的极微小部分,是灵芝的生殖细胞,具有灵芝全部的遗传活性物质[1]。灵芝孢子粉含有多糖类、三萜类、核苷类、甾醇类等活性物质以及有机锗和硒等多种矿物元素(如K、Mg、Ca、Mn、Fe、Mo)[2],具有补气安神、健脾益肺作用,临床上用于调节免疫[3]、抗肿瘤[4]、调节血脂、降低血糖[5]、保护神经系统及心血管系统等[6]。近年来,灵芝栽培技术日趋成熟,灵芝孢子粉产量也逐步提高。国内学者不断深入研究灵芝孢子粉的活性成分和药理作用,并以其为原料开发具调节免疫力等功能的保健食品。
目前,行业内尚未制定灵芝孢子粉多糖含量检测方法的国家标准,文献报道测定灵芝孢子粉多糖含量的方法主要有苯酚-硫酸法和蒽酮-硫酸法,部分研究者对以上2种方法的适用性、局限性等进行一些研究[7-8],并发现苯酚-硫酸法在试验数据的稳定性方面要优于蒽酮-硫酸法[9-10],由于苯酚-硫酸法所采用苯酚和浓硫酸试剂具有一定危害性,加之苯酚和硫酸的用量与多糖的组成结构有关,过量的硫酸会造成显色物质的分解,影响测定结果[11-12]。因此,有必要对苯酚-硫酸法的检测条件进行优化。
本文在苯酚-硫酸法检测条件的基础上,通过单因素和正交试验优化了苯酚、浓硫酸用量,以及提取温度、提取时间、料液比、乙醇浓度6个检测条件对多糖含量的影响,确定了灵芝孢子粉多糖的最佳检测条件,并分析了优化后的检测方法与现行的农业标准《NY/T 1676-2008食用菌中粗多糖含量的测定》的差异,优化后的灵芝孢子粉多糖检测方法能有效减少检测试剂苯酚和浓硫酸的使用量,具有实际应用意义。
1 材料与方法
1.1 试剂与仪器
灵芝孢子粉,破壁处理,由广东粤微食用菌技术有限公司提供;无水葡萄糖、苯酚、浓硫酸、无水乙醇等,分析纯,购于广州化学试剂厂。
5840R离心机,Eppendorf公司;UV-1750紫外分光光度计,岛津公司;DK-8D恒温水浴锅,广东环凯微生物科技有限公司;DHG-9053A型电热恒温鼓风干燥箱,广东环凯微生物科技有限公司。
1.2 材料
1.2.1灵芝孢子粉多糖的制备
分别称取2份灵芝孢子粉40 g,加蒸馏水400 mL,浸润15 min,加热回流提取3 h,提取2次,过滤,合并滤液,减压浓缩至50 mL,经喷雾干燥即得灵芝孢子粉多糖提取物。另一份浓缩液加入3倍体积的无水乙醇溶液,于4℃冰箱中静置过夜,抽滤,依次用无水乙醇溶液、丙酮、乙醚洗涤沉淀2次~3次,60℃干燥,得灵芝孢子粉多糖。
1.2.2溶液的配制
葡萄糖标准溶液配制:精密称取105℃干燥恒重葡萄糖10mg,置于100 mL量瓶中,用纯化水溶解并定容至100 mL,摇匀即得0.1 mg·mL-1标准储备液,备用。
5%苯酚溶液配制:取苯酚150 g,加锌粉0.2 g和无水碳酸钠0.1 g,蒸馏收集182℃馏分,称取此馏分50.0 g置于1000 mL容量瓶中,加水溶解定容,摇匀后置于棕色瓶中,放入冰箱避光保存,备用。
1.3 灵芝孢子粉多糖检测方法的优化
1.3.1最大吸收波长的确定
分别吸取“1.2.2”中制备的葡萄糖标准液和“1.2.1”中制备的灵芝孢子粉多糖溶液各1.0mL,置于25 mL具塞试管中,分别加入5%苯酚溶液1.5 mL,摇匀后分别迅速加入浓硫酸7.0 mL,30℃水浴30 min,以相应试剂空白为参比,采用紫外可见分光光度计进行扫描,波长范围400 nm~600 nm,确定其最大吸收波长。
1.3.2分光光度法测定灵芝孢子粉多糖含量
分别称取“1.2.1”中制备的0.25 g灵芝孢子粉粗多糖提取物,按料液比1:40加入水,置于90℃水浴3 h,5000 r·min-1离心15min后取上清液,加5倍量无水乙醇,于4℃冰箱中静置过夜,沉淀物加水溶解至100 mL,即得灵芝孢子粉多糖溶液。取1.0 mL灵芝孢子粉多糖溶液于25mL具塞试管中,加入5%苯酚溶液0.5mL和浓硫酸溶液2.5mL,摇匀,沸水浴反应30 min,冷却后测其吸光度值,平行测定3次,在“1.3.1”项确定的检测波长处测定吸光度,多糖含量按文献[13]方法计算。
1.3.3单因素试验
(1)苯酚和浓硫酸用量的确定
分别取2份“1.3.2”中制备的灵芝孢子粉多糖溶液1.0mL于25 mL具塞试管中,加入1.5 mL 5%苯酚溶液、7.0 mL浓硫酸溶液为体系A,加入0.5 mL 5%苯酚溶液、2.5 mL浓硫酸溶液为体系B,摇匀,沸水浴反应30 min,冷却后测其吸光度值,平行测定3次,确定检测试剂苯酚和浓硫酸的使用量。
(2) 提取温度
称取3份灵芝孢子粉粗多糖提取物样品0.25 g,按“1.3.2”项中的方法提取多糖,固定提取时间为3 h,提取料液比为1:40,加入5倍量无水乙醇,0.5 mL 5%苯酚溶液,2.5 mL浓硫酸溶液,摇匀,沸水浴反应30 min,冷却后测其吸光度值。设置提取温度为80℃、90℃、100℃,考察不同提取温度对多糖检测的影响。
(3) 提取时间
称取3份灵芝孢子粉粗多糖提取物样品0.25 g,按“1.3.2”项中方法提取多糖,固定提取温度为90℃,提取料液比为1:40,加入5倍量无水乙醇,其余操作同1.3.3(2) 项。设置提取时间为1 h、2 h、3 h,考察不同提取时间对多糖检测的影响。
(4) 提取料液比
称取3份灵芝孢子粉粗多糖提取物样品0.25 g,按“1.3.2”项中方法提取多糖,固定提取温度为90℃,提取时间为3 h,加入5倍量无水乙醇,其余操作同1.3.3(2) 项。设置不同料液比1:20、1:40、1:60,考察不同料液比对多糖检测的影响。
(5) 乙醇浓度
称取3份灵芝孢子粉粗多糖提取物样品0.25 g,按“1.3.2”项中方法提取多糖,固定提取温度为90℃,料液比为1:40,提取时间为3 h,无水乙醇,其余操作同1.3.3(2) 项。设置加入5倍量浓度为75%、85%和无水乙醇,考察不同乙醇浓度对多糖检测的影响。
1.3.4正交试验
根据单因素试验,拟定对测定灵芝孢子粉多糖含量影响的3个因素,提取温度(a)、提取时间(b)、提取料液比(c) 为优选因素,进一步考察以上因素对灵芝孢子粉多糖含量的影响,优化检测方法。正交试验因素水平见表1。

表1 正交试验因素水平表Tab.1 Factors and levels of orthogonal test
1.3.5标准曲线的绘制
精密吸取葡萄糖标准液0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL,加水至1 mL,加入 0.5 mL 5%苯酚和2.5 mL浓硫酸,摇匀,沸水浴反应30 min,冷却后,以空白试剂作为参比,在由1.3.1项确定的最大吸收波长处测定其吸光度值。以葡萄糖质量浓度(C) 为横坐标,吸光度(A) 为纵坐标,绘制葡萄糖标准液浓度与吸光度的标准曲线。
1.3.6精密度试验
取适量“1.3.5”项中的葡萄糖标准液于试管中,加水至1 mL,按“1.3.5”项中方法测定吸光度,连续进样测定5次,计算RSD值。
1.3.7稳定性试验
取“1.3.2”项中制备的灵芝孢子粉多糖溶液适量,按照“1.3.5”项下方法显色,分别放置0、10 min、20 min、30 min、40 min、50 min、60 min 进样测定,记录吸光度。
1.3.8重复性试验
精密称取“1.3.2”项下同一批灵芝孢子粉多糖适量,共6份,按照“1.3.5”项下方法显色,进样测定,记录吸光度。
1.3.9加标回收率试验
取“1.2.1”中制备的已知灵芝孢子粉多糖含量的样品6份,每份约0.1 g,精密称取,分别加入葡萄糖储备液适量,按照“1.3.5”项下方法显色,测定吸光度,计算加标回收率[14]。
1.3.10不同检测方法对多糖含量的研究
目前尚未颁布关于多糖检测方法的国家标准,食用菌企业制定多糖类产品的质量标准时多采用食用菌农业标准《NY/T 1676-2008食用菌中粗多糖含量的测定》。因此,本文在确定灵芝孢子粉最优检测方法的基础上,与食用菌农业标准方法进行比较研究,进一步探讨不同检测方法对灵芝孢子粉多糖含量的影响。
2 结果与讨论
2.1 最大吸收波长的确定
葡萄糖和灵芝孢子粉多糖的最大吸收波长如图1所示。

图1 葡萄糖和灵芝孢子粉多糖的最大吸收波长Fig.1 Maximum absorption wavelength of glucose and Ganoderma lucidum spore powder polysaccharides
由图1结果可知,葡萄糖标准溶液和灵芝孢子粉多糖溶液均在489 nm附近处有最大吸收度,说明以葡萄糖为标品测定灵芝孢子粉多糖含量的方法可靠。故选取489 nm作为灵芝孢子粉多糖的检测波长。
2.2 苯酚和浓硫酸用量的确定
不同苯酚与浓硫酸用量的影响如表2所示。

表2苯酚与浓硫酸用量对灵芝孢子粉多糖含量的影响Tab.2 Effect of phenol and concentrated sulfuric acid on the contents of Ganoderma lucidum spore powder polysaccharides
表2结果表明,2个体系中苯酚与浓硫酸的添加量均能有效测定灵芝孢子粉多糖的含量,但体系B测得的灵芝孢子粉多糖含量高于体系A,说明苯酚和浓硫酸使用量越大时,灵芝孢子粉多糖含量呈下降趋势,可能是由于加入过多的浓硫酸会使得多糖碳化严重[15],同时大量使用浓硫酸存在安全隐患。因此,选择体系B作为后续检测的用量。
2.3 提取温度对多糖含量的影响
提取温度对灵芝孢子粉多糖含量的影响见图2。
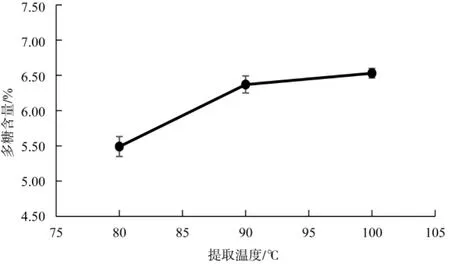
图2 提取温度对灵芝孢子粉多糖含量的影响Fig.2 Effectof extraction temperatures on the contents of Ganoderma lucidum spore powder polysaccharides
由图2结果可知,提取温度对灵芝孢子粉多糖检测的影响较大,多糖含量随温度升高而增加,提取温度为80℃时,灵芝孢子粉多糖含量较低,而温度从90℃升至100℃时,多糖含量的增幅较小。因此,选择90℃作为后续检测试验的提取温度。
2.4 提取时间对多糖含量的影响
提取时间对测定灵芝孢子粉多糖含量影响,见图3。
由图3结果可知,在提取温度90℃、料液比1:40条件下,延长提取时间,有利于增加灵芝孢子粉提取物中多糖的溶出,提取时间3 h时,多糖含量比提取时间2 h增加明显,因此,选择3 h为测定灵芝孢子粉多糖含量的提取时间。
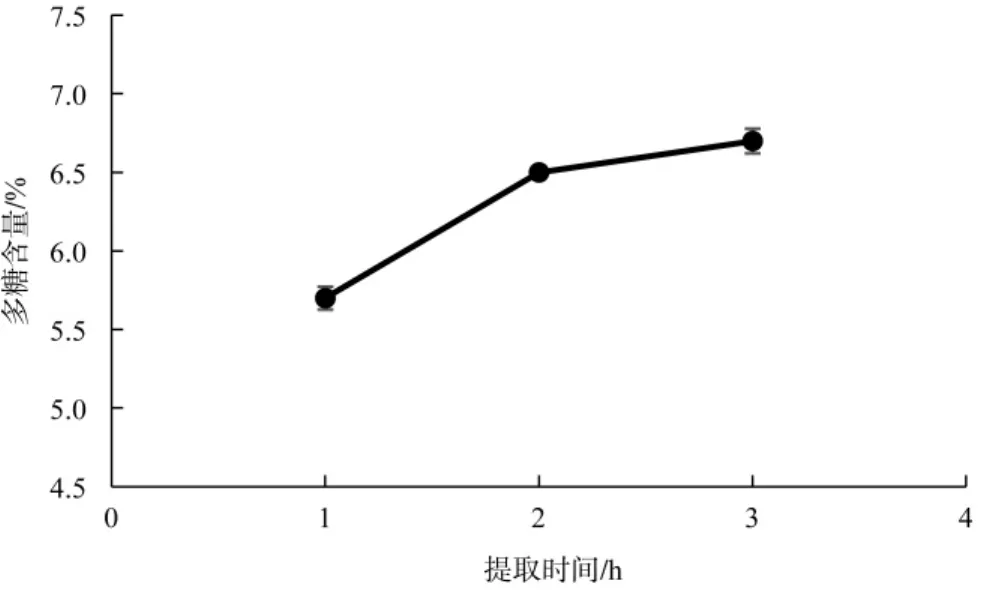
图3 提取时间对灵芝孢子粉多糖含量的影响Fig.3 Effectof extraction times on the contents of Ganoderma lucidum spore powder polysaccharides
2.5 提取料液比对多糖含量的影响
提取料液比对灵芝孢子粉多糖含量的影响,见图4。

图4 提取料液比对灵芝孢子粉多糖含量的影响Fig.4 Effectof extraction solid-liquid ratios on the contents of Ganoderma lucidum spore powder polysaccharides
由图4结果可知,随着提取料液比的增加,灵芝孢子粉多糖含量呈增加的趋势,说明增加水溶剂,能使更多的灵芝孢子粉提取物中多糖溶解,而料液比1:60较1:40增加不明显,即料液比为1:40时,灵芝孢子粉提取物中的多糖已基本提取完全。
2.6 乙醇浓度对多糖含量的影响
乙醇浓度对灵芝孢子粉多糖含量影响见图5。
由图5可知,随着乙醇浓度的增加,获得灵芝孢子粉多糖也随之增加。采用无水乙醇进行醇沉时,获得灵芝孢子粉多糖较乙醇浓度为75%、85%时量多,因此,选择无水乙醇作为多糖醇沉溶剂。
2.7 正交试验结果
正交试验及直观分析和方差分析结果,见表3、表4。
由表3、表4可知,影响因素主次顺序为提取时间>提取温度>提取料液比。其中a因素中以k2最大,b因素中以k3最大,c因素中以k2最大,故选择最佳检测条件为b2a3c2,即提取温度90℃,料液比注:F0.05(2,2) =19。Note:F0.05(2,2) =19.为1:40,提取时间3.0 h,采用无水乙醇沉淀灵芝孢子粉多糖。

图5 乙醇浓度对灵芝孢子粉多糖含量的影响Fig.5 Effectof ethanol concentrations on the contents of Ganoderma lucidum spore powder polysaccharides

表3 正交试验结果及其直观分析表Tab.3 The results of orthogonal testand intuitive analysis
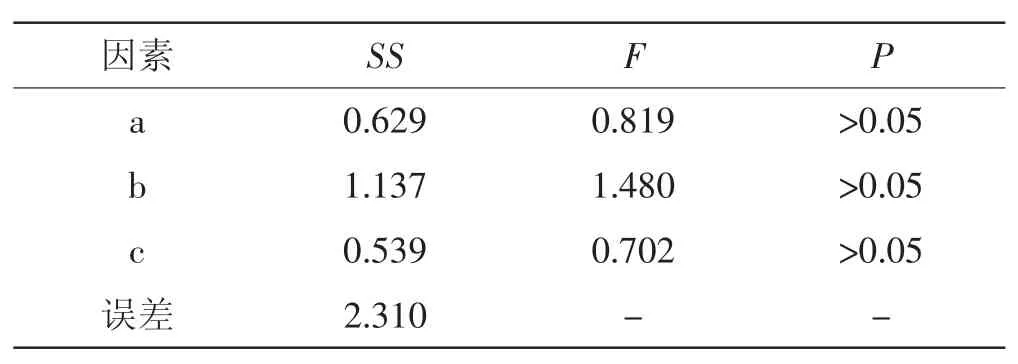
表4 方差分析结果Tab.4 Variance analysis results
2.8 标准曲线的绘制
以葡萄糖质量浓度为横坐标,吸光度A为纵坐标,绘制葡萄糖标准曲线见图6所示。由结果可知,葡萄糖浓度在 0.02mg·mL-1~0.1mg·mL-1的范围内有良好的线性关系。其回归方程为y=14.595x-0.0009,R2=0.9993。
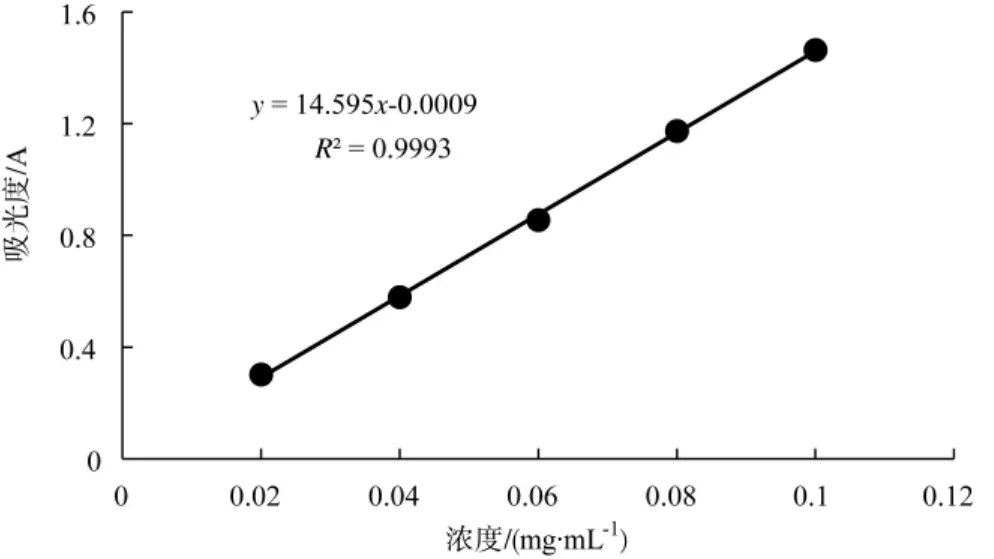
图6 葡萄糖标准曲线Fig.6 Standard curve of glucose
2.9 方法学试验结果
2.9.1精密度试验
精密度试验结果见表5。

表5 精密度试验结果Tab.5 Results of precision test
由表5结果可知,吸光度RSD值为0.74%,表明仪器精密度良好。
2.9.2稳定性试验
稳定性试验结果见表6。由表6可知,多糖含量的RSD值为0.38%,说明该方法在60min内稳定。

表6 稳定性试验结果Tab.6 Results of stability test
2.9.3重复性试验
重复性试验结果见表7。
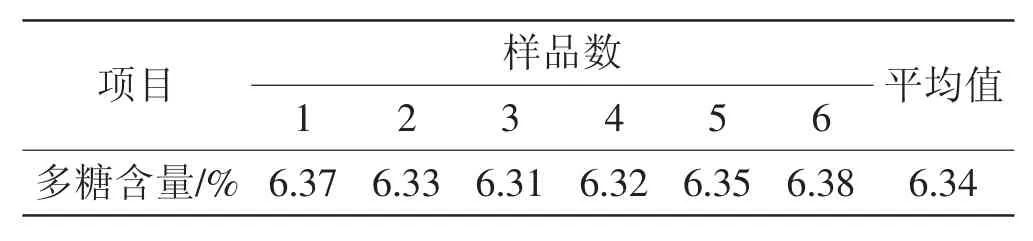
表7 重复性试验结果Tab.7 Results of repeatability test
由表7结果可知,多糖含量的RSD值为0.44%,表明优化后的方法重现性良好。
2.9.4加标回收试验
加标回收率试验结果见表8。
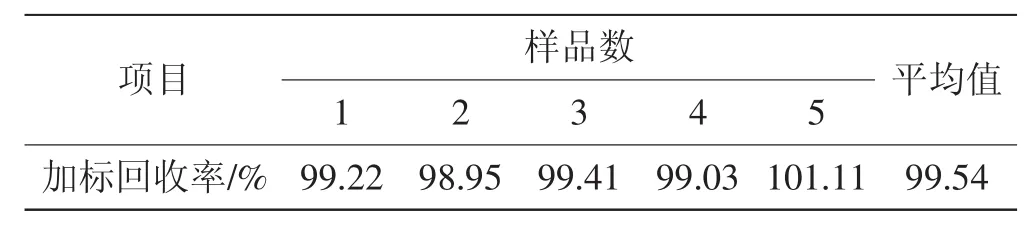
表8 加标回收率试验结果Tab.8 Sample recovery test for the determination
由表8结果可知,加标回收率为99.54%,RSD值为0.90%,表明优化后的方法准确性良好。
2.10 不同检测方法对灵芝孢子粉多糖含量的影响
不同检测方法对多糖含量的影响见表9。

表9 不同检测方法对灵芝孢子粉多糖含量的影响Tab.9 Effectof different detectionmethods on contentof Ganoderma lucidum spore powder polysaccharide
由表9结果可知,本文优化后的检测方法所测得的灵芝孢子粉多糖含量与农业标准《NY/T 1676-2008食用菌中粗多糖含量的测定》所规定的方法结果相差较小,说明减少检测试剂苯酚浓硫酸的使用量,仍能有效检测出灵芝孢子粉多糖,且不影响其含量测定结果。
3 结论
目前,国内大多数食用菌企业采用农业标准《NY/T 1676-2008食用菌中粗多糖含量的测定》中苯酚-硫酸法检测食用菌及其多糖含量,但苯酚-硫酸法在实际检测过程中检测试剂苯酚及浓硫酸的使用量过大,既不符合“绿色经济”的理念,也不利于检测操作安全。因此,本文采用单因素试验考察了苯酚浓硫酸用量、提取温度、提取时间、提取料液比以及乙醇浓度对测定灵芝孢子粉多糖含量的影响,并且在此基础上,利用正交试验优化了反应条件,进一步分析优化后的检测方法,与农业标准NY/T 1676-2008对测定灵芝孢子粉多糖含量的影响一致。
灵芝孢子粉多糖的最佳测定条件为:5%苯酚0.5 mL、浓硫酸2.5 mL,提取温度90℃,提取3 h,料液比为1:40。结果表明,经过优化后的苯酚-硫酸法测定灵芝孢子粉多糖准确可靠,稳定性和重复性较好,与农业标准《NY/T 1676-2008食用菌中粗多糖含量的测定》所规定的方法结果相差较小。然而后者方法中所使用苯酚与浓硫酸的量为前者的一倍,可见优化后的检测方法不仅能降低有危害性试剂(苯酚、浓硫酸)的使用量,同时也能够准确测定灵芝孢子粉中多糖含量,具有较好的应用价值。
参考文献:
[1]Li L,Guo HJ,Zhu LY,et al.A supercritical-CO2extract ofGanoderma lucidumspores inhibits cholangiocarcinoma cell migration by reversing the epithelial-mesenchymal transition[J].Phytomedicine,2016,23(5):491-497.
[2]Min BS,Gao JJ,Hattori M,et al.Anticomplement activity of terpenoids from the spores ofGanoderma lucidum[J].Planta Medica,2001,67(9):811-814.
[3]吴明忠,沈爱光.破壁灵芝孢子粉对小鼠免疫功能影响的初步研究[J].中国食用菌,2000,19(2):37-38.
[4]张馨,崔文明,刘泽钦,等.灵芝孢子粉抗突变和抑制肿瘤作用实验研究[J].中国公共卫生,2003,19(2):173-174.
[5]梁荣能,彭康.灵芝孢子粉提取物降血糖作用及机制的实验研究[J].中药药理与临床,1998(5):17-19.
[6]Guo L,Xie J,Ruan Y,et al.Characterization and immunostimulatory activity of a polysaccharide from the spores ofGanoderma lucidum[J].International Immunopharmacology,2009,9(10):1175-1182.
[7]张媛媛,张彬.苯酚-硫酸法与蒽酮-硫酸法测定绿茶茶多糖的比较研究[J].食品科学,2016,37(4):158-163.
[8]周勇,易延逵,杨晓敏,等.香菇中多糖含量测定方法的比较研究[J].食品研究与开发,2016,37(13):124-128.
[9]郑旭伟,黄占波,楚冬海,等.苯酚硫酸法与蒽酮硫酸法测定托盘根多糖含量的比较[J].安徽农业科学,2016,44(23):119-121.
[10]刘晓涵,陈永刚,林励,等.蒽酮硫酸法与苯酚硫酸法测定枸杞子中多糖含量的比较[J].食品科技,2009,34(9):270-272.
[11]王文洁,唐炜,俞玲娜,等.苯酚-硫酸法与蒽酮-硫酸法测定凉粉草多糖的比较[J].食品科技,2017,42(9):274-279.
[12]巴媛媛,王莹,朴美子.苯酚-硫酸法测定瓦尼木层孔菌菌丝体多糖含量的条件优化[J].食品工业科技,2011(5):389-391.
[13]胡斌杰,韩艳霞,姬红.正交实验法超声提取灵芝多糖最佳工艺研究[J].中药材,2008,31(1):142-143.
[14]陈战国,周利燕,李鹏程.苯酚-硫酸法测定太白泡沙参总多糖的含量[J].陕西师范大学学报:自科版,2009,37(4):48-51.
[15]池源,王丽波.苯酚-硫酸法测定南瓜籽多糖含量的条件优化[J].食品与机械,2014(1):89-92.
