风味蛋白酶水解大豆分离蛋白的抗原性及功能特性变化
2018-04-09王章存安广杰胡金强赵学伟袁路阳
王章存 王 佩 安广杰 胡金强 赵学伟 袁路阳
(郑州轻工业学院食品与生物工程学院,郑州 450002)
大豆蛋白具有良好的乳化性、发泡性、持水性等加工性能[1-2],在食品工业中广泛应用。但是大豆也是公认的八大过敏原食品之一[3],目前在大豆中发现38种蛋白具有致敏性(也称为抗原蛋白),其中主要抗原性蛋白成分是大豆11S球蛋白和和7S β-伴球蛋白,它们也是大豆中的主要蛋白质成分,其含量约占大豆总蛋白的80%;大豆抗原蛋白能够引起人和动物的不良反应,严重的甚至会危及生命,有些患者的过敏症状会持续一生[4-5]。因此,降低大豆蛋白的抗原性对食品安全具有十分重要的意义。
目前降低大豆蛋白抗原性的方法有热处理、酶解、超高压处理、化学处理和培育低抗原性大豆品种等[6]。酶解可改变大豆抗原蛋白空间结构,并且使部分化学键断裂,被认为是降低或消除大豆蛋白抗原性的有效方法[7],近年来国内外均给予较高的重视[8]。酶解过程也会导致大豆蛋白加工性能的变化[9-10]。文献中对酶解降低大豆蛋白抗原性的研究往往仅通过其酶解后蛋白质分子质量的变化来评价酶解效果,其可靠性远不如用抗原-抗体反应方法。而对酶解后抗原性变化和乳化、发泡等加工性能变化的综合性研究更少[11]。如何降低大豆蛋白的抗原性又改善或保持其功能特性值得深入研究。
本研究以大豆分离蛋白为原料,研究风味蛋白酶水解对其抗原性和功能特性的影响。通过对酶解过程中大豆分离蛋白分子成分、抗原性、乳化性和起泡性的分析,探讨大豆蛋白分子变化与抗原性之间的内在联系、抗原性变化和乳化等功能性变化规律等,为制备低抗原性和较好功能性质的大豆蛋白制品提供参考。
1 材料与方法
1.1 试验材料
大豆分离蛋白(SPI):郑州同创益生公司;11S大豆球蛋白和β-伴球蛋白酶联免疫分析(竞争法ELISA)试剂盒:上海纪宁公司;风味蛋白酶:丹麦诺维信公司;其他试剂均为分析纯。
1.2 仪器设备
DF-101S集热式磁力搅拌器:河南予华公司;冷冻干燥机FD-1A-50:北京博医康公司;DYY-7C 型电泳仪、DYCZ-24DN型电泳槽:北京六一仪器厂;UV-8100 B紫外可见分光光度计:北京莱伯泰科仪器公司;iMark酶标仪:美国Bio-Rad伯乐公司。
1.3 试验方法
1.3.1大豆分离蛋白的酶解
取大豆分离蛋白加水配置成10%溶液,加热至60 ℃,用HCl调至pH6.5,按照酶/底物为0.5%加入蛋白酶,反应开始并计时。整个反应过程中滴加碱维持体系pH稳定,并记录所消耗的碱的体积。反应到达一定时间后,沸水中煮沸10 min灭酶,之后冷冻干燥备用。
1.3.2蛋白质水解度的测定
本试验采用pH-Stat法[12]。水解度的计算公式为:
式中:B为消耗碱量/mL;N为NaOH溶液浓度/mol/L;α为大豆蛋白氨基的平均解离度;m为蛋白质的总质量/g;htot为蛋白质中的肽键总数(在大豆蛋白质中为7.8 mmol/g)。
1.3.3酶解蛋白质分子成分变化
采用SDS-PAGE法[13]。电泳条件:5%浓缩胶,电压为80 V;12%分离胶,电压为110 V。电泳结束后,用考马斯亮蓝R-250染色。
采用Gel-PRO ANALYZER软件定量分析电泳谱带。
1.3.4酶解产物抗原性测定
采用竞争法酶联免疫分析(ELISA)测定酶解产物的抗原性。操作步骤按试剂盒说明书进行。以抗原性剩余率表示酶解去除抗原效果。
1.3.5大豆分离蛋白溶解性的测定
采用双缩脲法测定蛋白含量,以酶解液中可溶性蛋白含量与总蛋白含量比值表示。
1.3.6乳化性和发泡性测定
发泡性及发泡稳定性测定方法参考文献[14];乳化能力及乳化稳定性测定方法参考文献[15]。
1.3.7 数据处理
采用Origin 8.0软件分析。
2 结果与分析
2.1 风味蛋白酶酶解对大豆分离蛋白水解度(DH)的影响
水解度(DH)分析结果(图1)表明,在酶解30 min内,大豆分离蛋白的水解度变化较快,反应10 min时DH即可达到5.1%,在酶解60 min后DH变化趋于稳定。
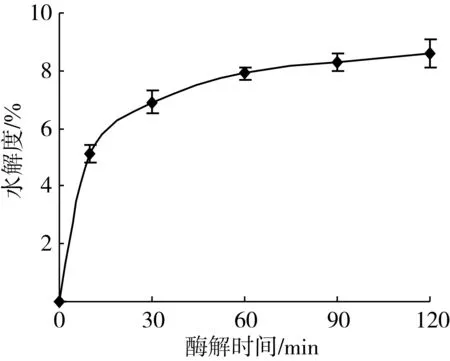
图1 不同酶解时间条件下SPI水解度变化
2.2 酶解过程中大豆分离蛋白分子变化
大豆分离蛋白中的致敏蛋白主要是β-伴球蛋白和豆球蛋白,β-伴球蛋白由α、α′、和β 3个亚基组成,豆球蛋白由酸性多肽(A)和碱性多肽(B)组成[16]。为了考查酶解过程中蛋白质分子的变化,用SDS-PAGE法对酶解物进行了分离(图2),并用Gel-PRO ANALYZER软件对电泳图谱中的谱带密度进行了定量分析(表1)。结果显示,酶解10 min时,β-伴球蛋白的3个亚基以及豆球蛋白的两个亚基颜色快速变浅,其中,α′、α和β3个亚基谱带的光密度值分别降低了93%、87%、73%,A和B多肽的光密度值分别降低了83%和51%;与此同时,产生了3个分子质量分别为31、27、22 ku新谱带(图2中a,b,c所示)。酶解30 min时,β-伴球蛋白的3个亚基几乎全部消失,豆球蛋白的酸性多肽和碱性多肽进一步降解。继续延长酶解时间,豆球蛋白的酸性多肽逐渐减少,而碱性多肽和新产生的3个谱带没有明显变化。这些谱带具有明显的抵抗风味蛋白酶水解的特征。用碱性蛋白酶水解豆粕的过程中也有类似现象出现[17],这些成分抗酶解的原因及其存在的意义值得深入研究和探讨。
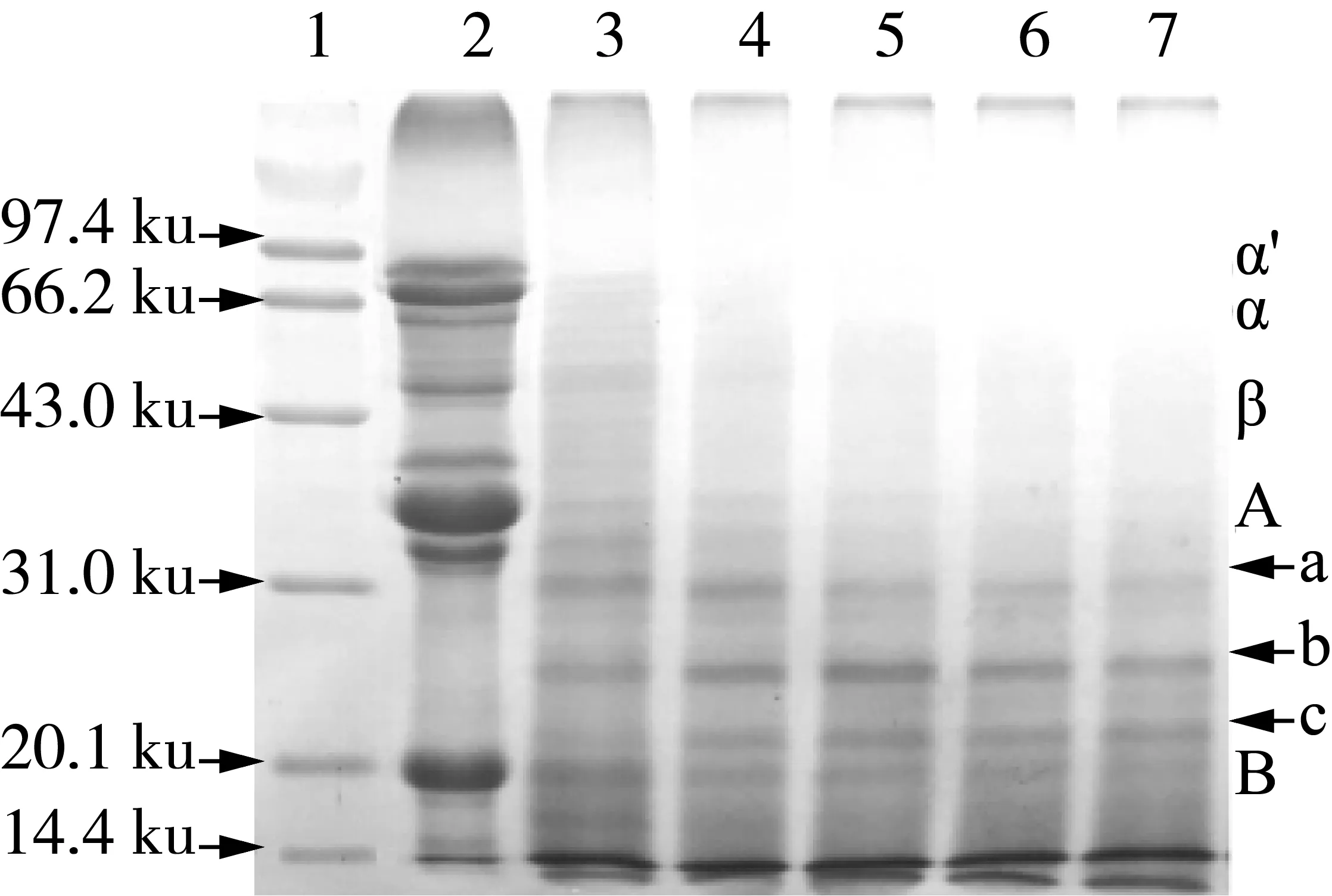
注:泳道1~7分别是Marker、酶解0、10、30、60、90、120 min酶解产物。图2 大豆分离蛋白酶解物SDS-PAGE图谱
表1 大豆分离蛋白酶解物中主要亚基谱带的OD值
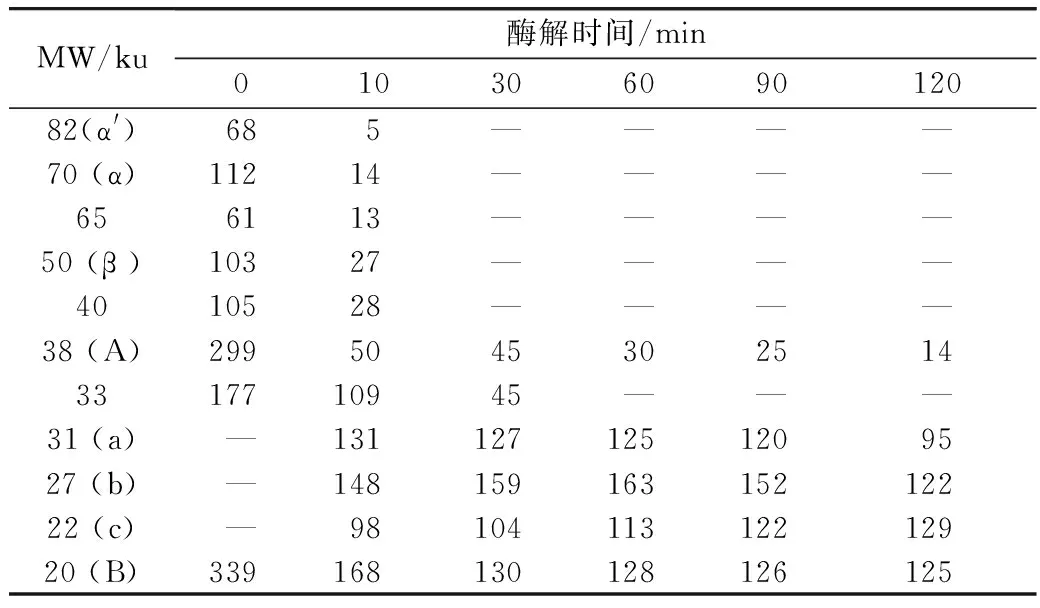
MW/ku酶解时间/min01030609012082(α')685————70(α)11214————656113————50(β)10327————4010528————38(A)29950453025143317710945———31(a)—1311271251209527(b)—14815916315212222(c)—9810411312212920(B)339168130128126125
2.3 酶解产物抗原性变化
大豆蛋白酶解后的抗原性变化是近年来国内外研究的热点。为了进一步考查经风味蛋白酶水解后,大豆分离蛋白分子变化与其抗原性变化之间的关系,本研究分别采用竞争法11S球蛋白和7S β-伴球蛋白ELISA试剂盒测定了酶解物的抗原性(见图3)。可以看出,酶解10 min时,大豆蛋白的致敏性明显降低,11S球蛋白和7S β-伴球蛋白的抗原剩余率分别降至43% 和56%。酶解30 min时,两种蛋白的抗原剩余率分别降至25%和34%。继续延长酶解时间,抗原剩余率变化趋势趋于平稳。这与大豆分离蛋白水解度变化趋势和SDS-PAGE图谱中亚基变化趋势基本一致。
值得注意的是,当酶解120 min时间内,11S球蛋白和7S β-伴球蛋白分子亚基早已完全消失时,其抗原性并未完全消除,而且在酶解10 min时新产生的3个谱带(图2中a、b、c所示)也没有随着酶解时间的延长而消失,显然,酶解物的抗原性与这些抗酶解肽链有一定关系。这些抗酶解的肽链中可能含有序列性抗原决定簇,只要特定的氨基酸序列存在就表现出一定的抗原性。这些结果可以解释加热、高压处理等方法消除抗原效果远不如酶解方法的重要原因。至于哪一条抗酶解肽段具有抗原活性及其决定簇的氨基酸序列如何,本课题将进行后续研究。
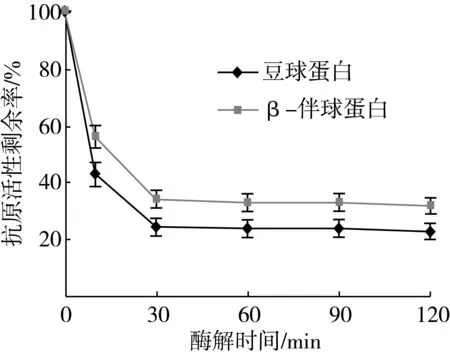
图3 酶解过程中大豆分离蛋白抗原性变化
2.4 酶解对大豆分离蛋白溶解性的影响
不同酶解产物的溶解性分析结果(图4)表明,酶解初始阶段(30 min)大豆分离蛋白的溶解性快速增加,随着酶解时间的延长,酶解后溶解度变化趋于平稳。酶解至120 min时溶解性达到86%。此结果与水解度和分子质量图谱的变化相对应。大豆分离蛋白经过酶解后,极性基团与小肽数目增加,亲水性增强,从而利于提高大豆分离蛋白溶解性。
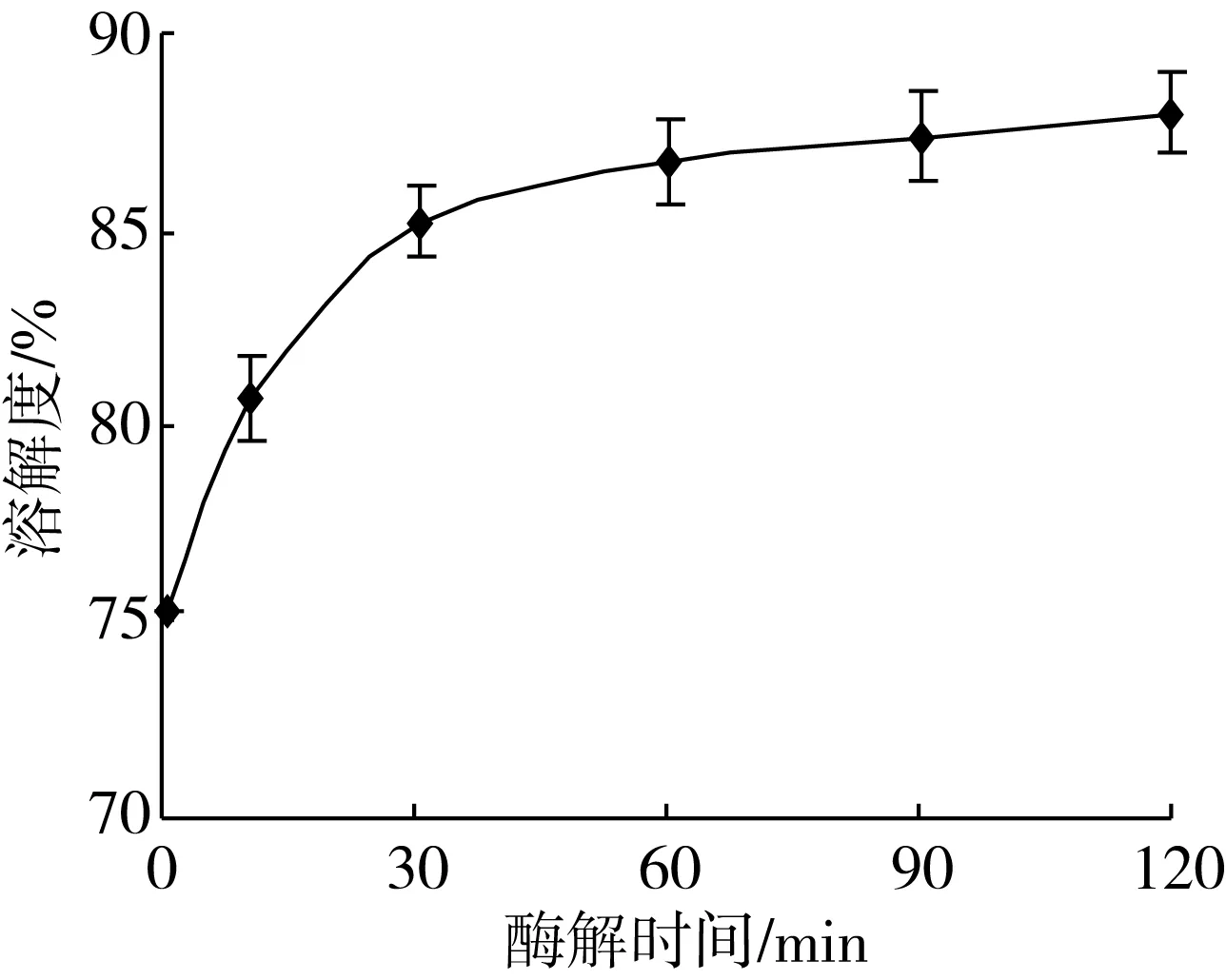
图4 不同酶解时间条件下蛋白溶解性变化
2.5 酶解物的乳化性能分析
乳化能力和乳化稳定性是反映蛋白质及其酶解物乳化性能的重要指标。试验结果(图5)可以看出,随着酶解时间的延长,大豆分离蛋白及其酶解物的乳化能力和乳化稳定性均显示为先提高、后降低的趋势。酶解30 min后的乳化能力降低幅度较大,乳化稳定性降低幅度较小。这可能由于酶解前期,蛋白质分子的空间结构发生较大变化,增加了大豆分离蛋白的溶解性,改善了蛋白质与油脂分子的结合性能。但随着酶解时间的延长,虽然蛋白质溶解性仍有所增加,而蛋白质分子变小,维持蛋白质分子状态的内部结构力(如氢键、范德华力等)被破坏,油滴表面的保护层变薄,导致乳化性能的降低[18],另一方面,由于溶液中小分子肽增多,乳化液微粒直径变小,乳化稳定性的变化不大。
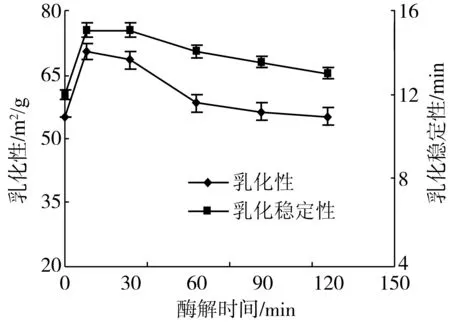
图5 酶解不同时间大豆分离蛋白的乳化性能变化
2.6 酶解物的起泡性能分析
酶解不同时间后大豆分离蛋白的起泡性和泡沫稳定性分析结果如图6所示。可以看出,在酶解过程中,大豆分离蛋白的起泡性先升高后降低,泡沫稳定性逐渐降低。可能是因为酶的水解作用使大豆蛋白质分子的空间构象发生变化,从而影响了蛋白质的表面疏水性和分子柔性等,进而影响蛋白质的发泡性能。蛋白质的发泡能力和泡沫稳定性取决于不同分子性质,前者取决于蛋白质的疏水性、吸附速度和柔性,而后者主要受蛋白质膜的流变形状影响,其中分子所带净电荷的影响较大[19-20]。此外,蛋白质分子中羰基和氨基之间的相互作用也会影响其发泡性能。
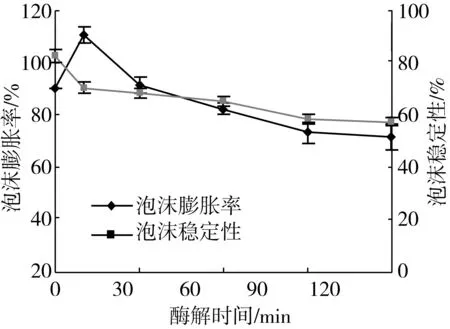
图6 酶解不同时间大豆分离蛋白的起泡性能变化
3 结论
对风味蛋白酶水解大豆分离蛋白的研究表明,在酶解初始的30 min内,大豆蛋白水解度快速提高,大豆β-伴球蛋白的3个亚基以及豆球蛋白的两个亚基快速减少;随着酶解时间的延长,蛋白质水解度和各个肽成分变化不明显。此外,在酶解10 min时新产生3个醒目的分子质量为31、27、22 ku的谱带,即使延长酶解时间至120 min时这些谱带也未消失,表现出较强的抗酶解作用。用竞争法ELISA试剂盒的分析表明,起初30 min酶解时间内,大豆蛋白的抗原性显著降低,延长反应时间抗原性的变化趋于缓和,与大豆蛋白分子成分的变化趋势一致,推测酶解后抗原性的存在与新生成的3个谱带有密切关联。
对风味蛋白酶水解后大豆分离蛋白的功能性质分析显示,酶解10 min时,大豆蛋白酶解物的乳化性和发泡性最高,延长酶解时间这些功能性质明显下降。综上所述,本文认为,若用风味蛋白酶水解10~30 min时,即可有效降低大豆抗原性,同时也可获得较好的乳化、发泡等功能性质。这些结果对开发低过敏性大豆蛋白食品和改善其加工性能具有积极作用。
[1]TSUMURA K, SAITO T, TSUGE K, et al. Functional properties of soy protein hydrolysates obtained by selective proteolysis[J]. LWT-Food Science and Technology , 2005, 38 (3):255-261
[2]江连洲,胡少新,李杨,等. 大豆加工领域的科学技术问题[J]. 中国食品学报, 2011, 11(9):98-110
JIANG L Z, HU S X, LI Y, et al. Science and technology problems of soybean processing[J]. Journal of Chinese Institute of Food Science and Technology, 2011, 11(9):98-110
[3]朱婷伟,陈复生,布冠好,等. 大豆蛋白过敏原结构与功能的研究进展[J].食品工业科技,2013,34(21):377-380
ZHU T W, CHEN F S, BU G H, et al. Developments in the structure and function of soybean protein allergens[J] . Science and Technology of Food Industry, 2013, 34(21):377-380
[4]SAVAGE J H, KAEDING A J, MATSUI E C,et al. The natural history of soy allergy[J] . Journal of Allergy and Clinical Immunology, 2010, 125(3):683-686
[5]WANG T, QIN G X, SUN Z W, et al . Advances of research on glycinin and β-conglycinin: a review of two major soybean allergenic proteins. Critical Reviews in Food Science and Nutrition ,2014, 54(7):850-862
[6]杨慧,陈红兵,程伟,等. 大豆主要过敏原及其脱敏方法的研究进展[J] . 食品科学,2011,32(21):273-277
YANG H, CHEN H B, CHENG W, et al. Research progress of soybean allergens and its desensitization methods[J]. Food Science,2011, 32(21):273-277
[7]黄婷,布冠好,陈复生. 酶解改性对大豆蛋白抗原性的影响研究[J]. 河南工业大学学报,2016,37(4):11-17
HUANG T, BU G H, CHEN F S. Effect of enzymatic hydrolysis on the antigenicity of soy protein isolate[J]. Journal of Henan University of Technology, 2016,37(4):11-17
[8]WANG Z C, LI L J, YUAN D Q, et al. Reduction of the allergenic protein in soybean meal by enzymatic hydrolysis[J]. Food and Agricultural Immunology, 2014,25(3): 301-310
[9]李胤静,张娜,杨宝柱,等. 大豆分离蛋白的限制性酶解及其功能性质研究[J].中国林副特产,2014,2:10-13
LI Y J, ZHANG NA, YANG B Z, et al. Study on hydrolysis and functional proerties of soy protein isolate by two kinds of enzymes. Forest By-Product and Speciality in China,2014,2:10-13
[10]赵国华,明建,陈宗道. 酶解大豆分离蛋白乳化特性的研究[J].中国粮油学报,2002,17(2):48-50
ZHAO G H, MING J, CHEN Z D. Emulsifying properties of enzymatic degraded soy protein isolate[J]. Journal of the Chinese Cereals and Oils Association , 2002, 17(2):48-50
[11]MEINLSCHMIDT P, SUSSMANN D, SCHWEIGGERT-WEISZ U, et al. Enzymatic treatment of soy protein isolates: effects on the potential allergenicity, technofunctionality, and sensory properties. Food Science & Nutrition, 2016, 4(1): 11-23
[12]徐英操,刘春红. 蛋白质水解度测定方法综述[J] . 食品研究与开发, 2007, 28(7):173-175
XU Y C, LIU C H. Introduction of method for determination of degree of hydrolysis of protein hydrolysates[J]. Food Research and Development, 2007, 28(7):173-175
[13]LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227: 680-685
[14]MOLINA E, PAPADOPOULOU A, LEDWARD D A. Emulsifying properties of high pressure treated soy protein isolate and 7S and 11S globulins[J]. Food Hydrocolloid, 2001, 15(3): 263-269
[15]郭荣佳. 酶解对大豆蛋白结构功能性影响及高乳化起泡性蛋白制备[D]. 哈尔滨:东北农业大学,2014
GUO R J. Effect of enzymolysis on structure and functional properties of soybean protein and preparation of protein with high emulsibility and foamability[D]. Haerbin:Northeast Agricultural University,2014
[16]谢笔钧.食品化学[M].北京:科学出版社,2004
XIE B J. Food Chemistry[M]. Beijing:Science Press,2004
[17]王章存,李乐静,赵学伟,等. 碱性蛋白酶水解对豆粕中大豆抗原蛋白的影响[J]. 中国粮油学报,2013,28(2): 6-7
WANG Z C, LI L J, ZHAO X W, et al. The influence of alcalase enzymatic hydrolysis on the soybean antigen proteins in soybean meal[J]. Journal of the Chinese Cereals and Oils Association, 2013, 28(2):6-7
[18]NAKAI S. Structure-function relationship of food proteins with an emphasis on the importance of protein hydrophobicity[J]. Journal of Agricultural and Food Chemistry, 1983,31(4):676-683
[19]TOWNSEND A, NAKAI S. Relationships between hydrophobicity and foaming characteristics of food Proteins[J]. Journal of Food Science, 1983, 48:58-594
[20]朱翠,蒋宗勇,郑春田,等. 大豆抗原蛋白的组成及其致敏作用机理[J]. 动物营养学报,2011,23(12) : 2053-2063
ZHU C, JIANG Z Y, ZHENG C T, et al. Soybean antigenic protein: composition and allergy mechanisms[J].Chinese Journal of Animal Nutrition, 2011,23(12) : 2053-2063.
