p-MTOR在结肠癌中的表达及与患者病理学特征的关系
2018-04-08孙红兰刘慧峰姜国丹
孙红兰,刘慧峰,姜国丹
首都医科大学附属北京潞河医院普外科,北京1011000
随着人们饮食结构的改变,结肠癌的发病率呈逐年上升的趋势,现已成为临床上影响患者生活质量甚至危及生命的严重疾病之一[1‐3]。目前结肠癌的肿瘤标志物较多,磷酸化雷帕霉素靶蛋白(phosphor‐ylated mechanistic target of rapamycin,p‐MTOR)就是其中之一[4‐5]。p‐MTOR 是 AKT/MTOR 信号通路中的重要中心调控蛋白,主要调控细胞的生存、增殖以及凋亡,通过磷酸化下游多种蛋白的方式来调控基因的翻译和转录,进而可调控蛋白质合成和血管内皮细胞增殖,因此有望成为肿瘤治疗的新靶点,从而开发新的治疗措施和治疗药物[6‐8]。本文通过研究p‐MTOR在结肠癌组织中表达的变化以及对预后的影响,为临床应用提供理论依据。
1 资料与方法
1.1 一般资料
选取首都医科大学附属北京潞河医院收集的结肠癌患者的结肠癌组织标本110例及其对应的癌旁正常组织110例。纳入标准:①结肠癌的诊断主要依据肠镜活组织病理学、术后病理学结果;②结肠癌癌旁组织来源于距离肿瘤边缘3 cm的结肠组织;③患者术前未接受放化疗、免疫治疗;④全身各系统无严重疾病;⑤患者的各项资料完整。排除标准:①合并其他部位肿瘤疾病;②既往具有放化疗病史;③伴其他系统严重疾病;④资料不完整难以纳入统计。所有患者中,男62例,女48例;年龄37~79岁,平均(58.3±12.6)岁;TNM分期:Ⅰ期20例,Ⅱ期29例,Ⅲ期48例,Ⅳ期13例;组织学分级:高分化31例,中分化49例,低分化30例;伴有淋巴结转移41例;肿瘤部位:乙状结肠38例,升结肠21例,横结肠29例,降结肠22例。
1.2 免疫组化检测方法
所有石蜡标本采用4 μm连续切片,逐级脱蜡至水,用H2O(23%)封闭内源性过氧化物酶10 min,后高温高压热修复,牛血清(2%)封闭20 min,滴加羊抗人浓缩型多克隆抗体MTOR和一抗(p‐MTOR、HⅠF‐1α单抗的稀释浓度分别为1∶100、1∶50),放入湿盒内,冰箱(4℃)孵育过夜,然后滴加生物素标记,保持室温20 min,滴加辣根酶标记的链霉亲和素,二氨基联苯胺(diaminobenzidine,DAB)显色,后进行脱水、透明及封片。
1.3 判断标准
p‐MTOR蛋白主要表达于细胞质,阳性着色表达于细胞质和细胞膜,呈黄色、棕黄色、褐色表达,免疫组化结果判定:①根据着色强度,0分为无色,1分为淡黄色,2分为棕黄色,3分为褐色、黑色;②根据阳性细胞比例,阳性细胞所占比例≤10%为1分,阳性细胞所占比例11%~50%为2分,阳性细胞所占比例51%~75%为3分,阳性细胞所占比例>75%为4分。两种积分相乘总分<3分为阴性,≥3分为阳性;总分<3分为“-”,总分3~5分为“+”,总分6~9分为“++”,总分>9分为“+++”。
1.4 统计学方法
采用SPSS 16.0统计-软件进行数据分析,计量资料以均数±标准差(±s)进行统计描述,计数资料以例数及率(%)表示,组间比较采用χ2检验;生存分析采用Kaplan‐Meier法,生存时间比较采用Log‐rank法;多因素分析采用Cox比例风险回归模型;以P<0.05为差异有统计学意义。
2 结果
2.1 p-MTOR蛋白表达水平
结肠癌组织中p‐MTOR蛋白阳性表达率为54.55%(60/110),明显高于癌旁组织的10.00%(11/110),差异有统计学意义(χ2=49.931,P<0.01)。(表1、图1)
2.2 结肠癌组织中p-MTOR蛋白阳性表达与患者临床病理特征的关系
110例结肠癌癌组织中,p‐MTOR蛋白阳性60例(54.55%),阴性50例(45.45%);不同TNM分期、浸润深度及是否有淋巴结转移患者结肠癌组织中p‐MTOR蛋白阳性表达率比较,差异有统计学意义(P<0.01)。(表2)

表1 两种组织标本中的p‐MTOR蛋白表达水平

图1 p‐MTOR蛋白阳性表达的病理结果图(免疫组化染色,×100)
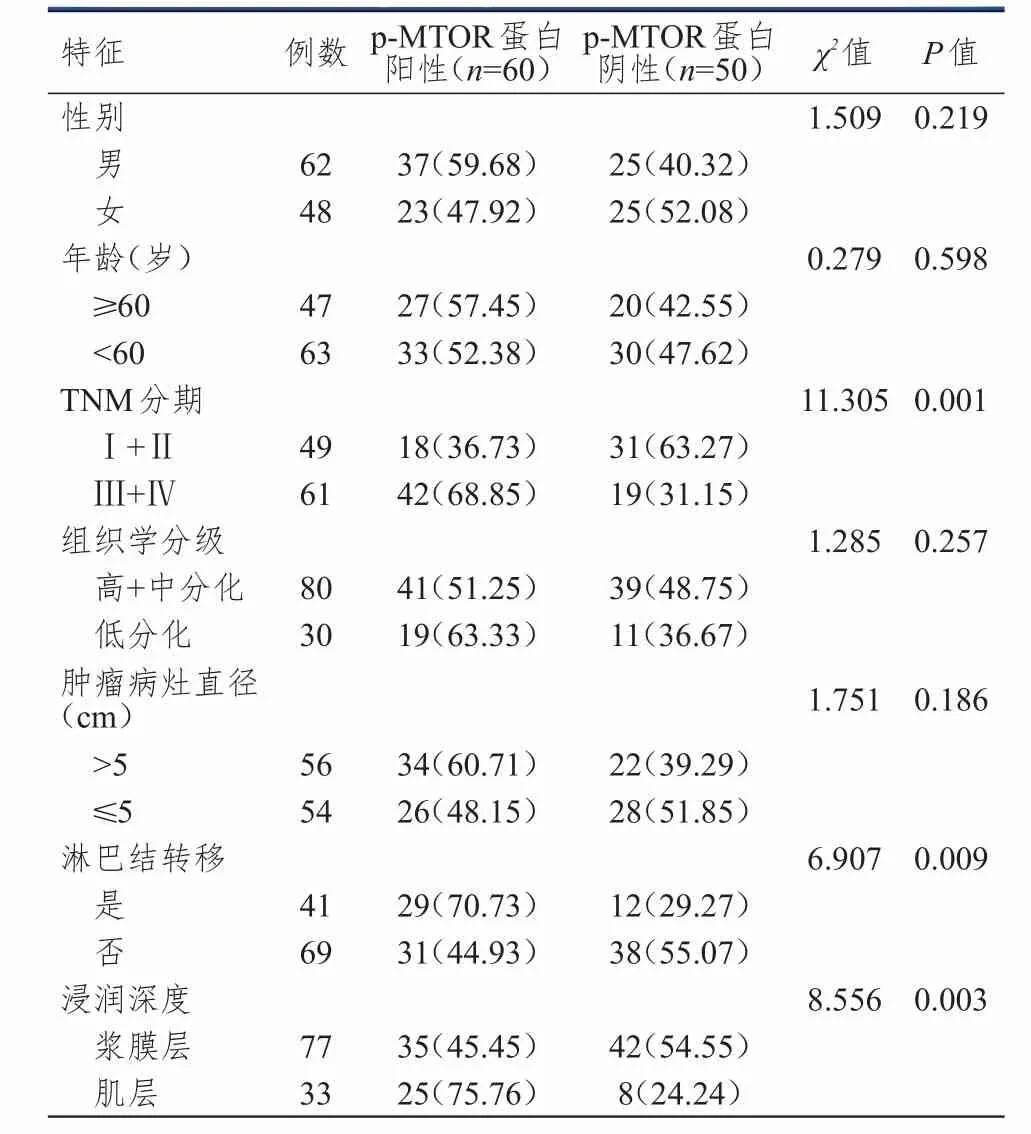
表2 结肠癌组织中p‐MTOR蛋白阳性表达与患者临床病理特征的关系[ n(%)]
2.3 结肠癌组织中p-MTOR蛋白阳性表达与患者预后的关系
结肠癌组织中p‐MTOR蛋白阳性表达患者的3年生存率(28.33%)明显低于p‐MTOR蛋白阴性表达患者(55.00%),差异有统计学意义(χ2=8.364,P=0.004),详见图2;采用Cox比例风险回归模型进行分析结果显示,TNMⅢ+Ⅳ期、发生淋巴结转移、浸润肌层、p‐MTOR蛋白阳性表达是结肠癌患者不良预后的独立危险因素(P<0.05),详见表3。
3 讨论
结肠癌是临床上高发的消化道恶性肿瘤之一,随着其发病率的逐年增加,其病死率也跃居中国恶性肿瘤第5位,严重威胁着人们的生命健康,因此结肠癌的治疗一直是临床上的热点问题。由于近年来对肿瘤细胞和分子水平研究的深入,提出了肿瘤干细胞的假说,即肿瘤细胞起始于一群具有增殖能力的细胞,进而维持肿瘤的不断更新及分化,从而形成异质细胞群体,因此在此假说基础上的治疗,可以通过抑制该类细胞的增殖分化,以达到治疗的目的[9‐10]。据报道,多种恶性肿瘤的发生与PⅠ3K/AKT/MTOR信号通路活化密切相关,该通路可以加速细胞周期、降低细胞凋亡并促进肿瘤细胞的迁移,因此可以通过控制该通路的活化,从而抑制肿瘤细胞的生长[11‐12]。生长因子等物质可经过PⅠ3K/AKT/MTOR信号通路磷酸化MTOR的Ser2448位点,从而激活 MTOR,即为 p‐MTOR,p‐MTOR有助于维持细胞未分化的状态,进而促进癌细胞去分化[13]。p‐MTOR可以改变S6k1和4E‐BP1的磷酸化状态启动翻译过程,从而启动HⅠF‐1的翻译,提高HⅠF‐1的表达。被活化的p‐MTOR可通过抑制肿瘤细胞凋亡、加速血管生成、促进肿瘤浸润与转移和促进药物抵抗等方面来加速肿瘤的病情发展,因此p‐MTOR作为该过程的核心蛋白,具有作为结肠癌治疗新靶点的希望,在临床上可以通过药物等治疗手段以抑制p‐MTOR的活性或活化过程,从而控制癌细胞的增殖、分化及转移,从而抑制肿瘤的生长,达到治疗的目的[14‐15]。
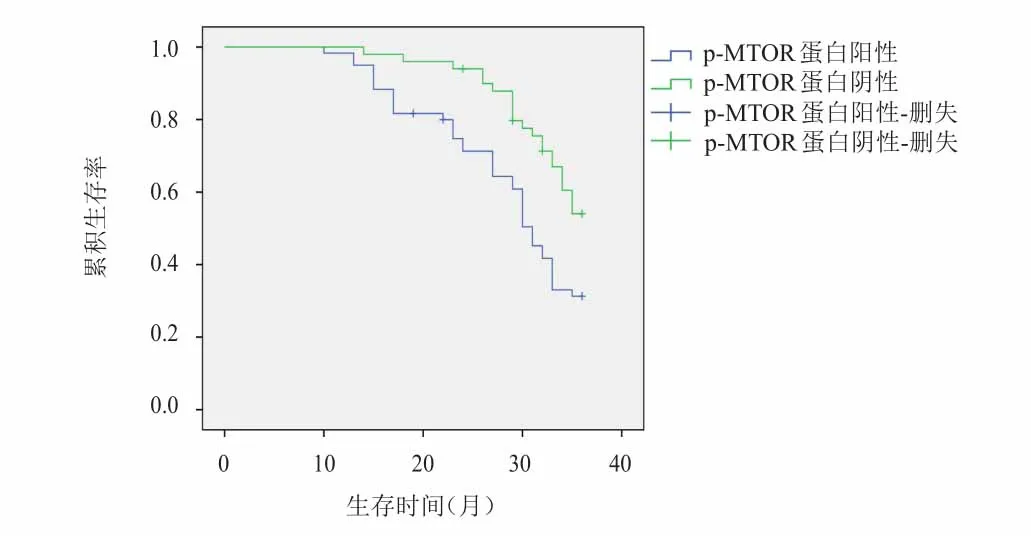
图2 两组患者的生存曲线图
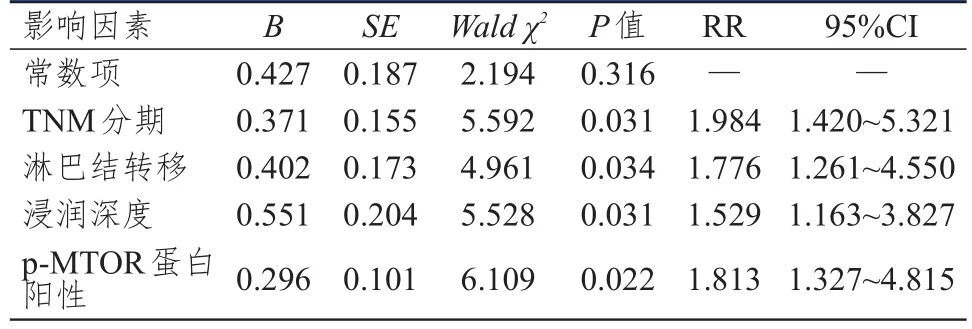
表3 结肠癌组织中p‐MTOR蛋白阳性表达与患者预后的关系
3.1 两种组织标本中p-MTOR蛋白表达水平的比较
p‐MTOR是结肠癌的重要肿瘤标志物,是结肠癌癌细胞增殖、分化和转移的关键蛋白酶,因此其水平可随着结肠癌的发生而明显升高,因此本文对比考察了结肠癌组织和癌旁组织的p‐MTOR阳性表达,发现结肠癌组织中p‐MTOR蛋白阳性表达率明显高于癌旁组织,差异有统计学意义,这表明p‐MTOR可以作为结肠癌特异性的肿瘤标志物,p‐MTOR的表达水平和结肠癌的发生有关。
3.2 结肠癌组织中p-MTOR蛋白阳性表达与患者临床病理特征的关系
临床上常用TNM分期、淋巴结转移和浸润深度等临床病理特征来评估结肠癌的发展程度,而结肠癌组织中p‐MTOR会参与到癌细胞增殖、分化、浸润和转移的全过程。本研究发现结肠癌组织中p‐MTOR蛋白阳性表达率与患者的TNM分期、淋巴结转移、浸润深度有关,因此证明p‐MTOR蛋白阳性表达与TNM分期、淋巴结转移和浸润深度具有对应关系,p‐MTOR蛋白表达水平可以在一定程度上反映结肠癌病情发展的程度。
3.3 结肠癌组织中p-MTOR蛋白阳性表达与患者预后的关系
结肠癌癌细胞容易脱落扩散转移,因此治疗后患者易复发或在其他部位出现转移癌,由于p‐MTOR在癌细胞增殖、分化、扩散、转移的过程中均起到了重要作用,因此可以用其蛋白阳性表达情况来预测结肠癌的预后。本研究讨论了p‐MTOR蛋白阳性表达与患者预后的关系,发现p‐MTOR蛋白阳性表达患者的3年生存率低于p‐MTOR蛋白阴性表达患者;采用Cox比例风险回归模型进行分析结果显示,TNM分期增高、发生淋巴结转移、浸润肌层、p‐MTOR蛋白阳性表达是结肠癌患者不良预后的独立危险因素,这表明p‐MTOR蛋白阳性表达可以促进癌症的复发和扩散,严重降低患者生活质量,导致不良预后的发生,而p‐MTOR蛋白阳性表达与TNM分期增高、发生淋巴结转移以及浸润肌层等病理特征一样,可作为癌症发生发展的促进因素之一,因此临床可以通过控制p‐MTOR蛋白阳性表达来治疗结肠癌。
综上所述,本文通过研究p‐MTOR阳性表达水平与结肠癌组织、临床病理特征以及患者预后的关系,发现p‐MTOR阳性表达水平与结肠癌的发生发展关系密切,可在一定程度上反映结肠癌病情发展的程度并是结肠癌发生的独立危险因素,因此临床上可以通过抑制p‐MTOR阳性表达,从而控制结肠癌的发生发展及不良预后的发生。
[1]张芬,石振旺,王志红.结直肠癌筛查技术的研究进展[J].国际消化病杂志,2016,36(6):343‐346.
[2]金鲜珍,陈瑾,廖春艳,等.持续性护理对结肠癌患者术后生活质量的影响[J].山西医药杂志,2015,44(21):2584‐2586.
[3]Wynder EL,Reddy BS.Colon cancer prevention:today’s challenge to biomedical scientists and clinical investigators[J].Cancer,1977,40(5 Suppl):2565‐2571.
[4]许星宇,陈博,熊茂明.p‐mTOR在胃癌组织中的表达与临床病理及预后的关系[J].中华普通外科杂志,2016,31(2):145‐148.
[5]马志恒,蒋海存,陈建新,等.mTOR信号通路与胃癌的相关性研究[J].国际消化病杂志,2016,36(4):256‐258.
[6]张春,李清漪,董海影,等.PⅠ3K/AKT/mTOR信号通路在诱导胶质瘤细胞凋亡中的作用[J].中国新药杂志,2016,25(16):1909‐1912.
[7]Zhang X,Shi H,Tang H,et al.miR‐218 inhibits the inva‐sion and migration of colon cancer cells by targeting the PⅠ3K/Akt/mTOR signaling pathway[J].Ⅰnt J Mol Med,2015,35(5):1301‐1308.
[8]Chen J,Shao R,Li F,et al.PⅠ3K/Akt/mTOR pathway dual inhibitor BEZ235 suppresses the stemness of colon cancer stem cells[J].Clin Exp Pharmacol Physiol,2015,42(12):1317‐1326.
[9]李姗姗,边育红,王丽.基于肿瘤干细胞的西黄丸抗结肠癌作用研究[J].天津中医药,2017,34(3):181‐185.
[10]曲泽,侯明星,王峰.结肠癌肿瘤干细胞相关因子研究进展[J].中国肿瘤临床与康复,2017,24(3):376‐380.
[11]郭琳,王强.PⅠ3K/Akt/mTOR信号传导通路与恶性肿瘤浸润和转移的研究进展[J].现代肿瘤医学,2009,17(8):1585‐1589.
[12]Manfredi GⅠ,Dicitore A,Gaudenzi G,et al.PⅠ3K/Akt/mTOR signaling in medullary thyroid cancer:a promising molecular target for cancer therapy[J].Endocrine,2015,48(2):363‐370.
[13]刘田田,毕经旺.PⅠ3K/Akt/mTOR信号通路与结直肠恶性肿瘤[J].实用医药杂志,2016,33(4):367‐370;374.
[14]王茜,时延龙,毕经旺.p‐mTOR与HⅠF‐1α在结直肠癌组织中的表达及其临床意义[J].中国肿瘤生物治疗杂志,2015,22(6):779‐784.
[15]张少华,毕经旺.结直肠癌组织中S6K1及4EBP1蛋白的表达及其与临床病理特征的关系[J].中国肿瘤生物治疗杂志,2015,22(6):747‐753.
