外科治疗以癫痫为主要症状的脑膜瘤124例
2018-04-03张杰高晋健张德明陈卉王嗣松吴建兵杜春富李智慧
张杰 高晋健 张德明 陈卉 王嗣松 吴建兵 杜春富 李智慧
1雅安市人民医院神经外科(四川雅安625000);2西南医科大学附属成都市西区医院神经外科(成都610000);3西南医科大学附属成都三六三医院神经外科(成都610041)
脑膜瘤为颅内最常见的肿瘤之一,发病率约占颅内肿瘤的20%,约50%的脑膜瘤患者以癫痫为首发或继发表现。脑膜瘤切除术后癫痫发作使后续的治疗、护理费用、住院时间增加,影响患者的生存质量[1]。特别是术后癫痫急性发作常给患者及家属带来严重的精神负担,增加了手术的失败感。因此,脑膜瘤患者癫痫的控制倍受重视。有关以癫痫为主要症状的脑膜瘤患者发病前后癫痫发作情况的文献报道有限,本研究回顾性分析近6年来我院接受手术治疗的以癫痫为主要症状的脑膜瘤患者124例,分析总结术后癫痫控制情况汇报如下。
1 资料与方法
1.1一般资料回顾性分析2010年1月至2016年1月以癫痫为首发症状的脑膜瘤患者124例。其中女78例,男46例;病程1周~10年,平均1.5年;年龄10~75岁,平均42岁。所有患者以癫痫为主要症状,全身性发作70例,复杂部分性发作20例,单纯部分性发作12例,部分性发作继发全身性发作22例;癫痫发作伴随头痛头昏者46例,伴有肢体轻度偏瘫34例,视力下降23例,嗅觉减退4例。术前28例未接受药物抗癫痫治疗,96例患者接受过1~3种抗癫痫药物治疗,用药时间2周~2.5年,平均6.5个月,癫痫控制不良。
1.2术前影像学检查所有患者均行增强CT或者增强MRI检查定位肿瘤。42例患者肿瘤邻近功能区则给予磁共振弥散张量成像(diffusion tensor imaging,DTI)明确锥体束与肿瘤的关系,以指导手术。其中肿瘤位于矢状窦及大脑镰旁59例,大脑凸面54例、嗅沟4例、蝶骨嵴3例、海绵窦旁2例、中颅凹1例、天幕1例。
1.3术前脑电图检查24 h动态脑电图检查,124例患者中89例记录到1~3次发作;放电起始部位位于肿瘤区或者邻近区域79例,远隔部位10例(包扩距离肿瘤5~6 cm内5例,2例距离肿瘤7.5 cm,2例位于肿瘤对侧前中颞区新皮层,1例位于位于对侧颞叶内侧结构);记录到发作间期痫性放电27例,20例位于肿瘤所在部位及邻近区域皮层,远隔部位7例(包括位于对侧颞叶内侧2例,肿瘤同侧5例,距离肿瘤在4~6 cm);其余提示脑电节律异常,均位于肿瘤同侧,邻近区域5例,远隔区域3例(距离肿瘤5~6 cm 2例,7 cm 1例);其中22例因不能准确定位发作起始区行进一步硬膜下电极或者深部电极监测;所有患者均由神经电生理学、神经放射学、神经心理学组成的专家组评估决定手术方式。
1.4手术方式手术以肿瘤为中心,同时兼顾术前脑电检测所提示的癫痫波所发放的区域设计切口大小。如癫痫波发放在肿瘤的邻近部位(≤5 cm),则采取扩大切口,充分暴露脑组织;如癫痫发放区位于肿瘤远隔部位(>5 cm),单个手术切口过大且不能有效覆盖癫痫波发放区域,对术前监测到独立的发作起始的患者征得患者及家属许可后另行切口切除致痫灶,家属对另行切口处理癫痫灶有疑虑者以及术前未能监测到发作期脑电图患者则不予处理。术中常规行皮层脑电监测,进一步明确癫痫灶位置及手术切除范围。显微镜下切除肿瘤及肿瘤邻近3~4 cm的硬脑膜,部分肿瘤位于矢状窦、颅底,或者与其他静脉窦或者血管邻近,则行局部电灼硬脑膜处理或适当残留部分肿瘤;显微镜下切除肿瘤后,再次皮层脑电监测,当提示异常放电局限于肿瘤邻近部位时,在非功能区行局部皮质切除,在功能区行低功率电凝热灼术或者多处软脑膜下横纤维切断术(multiple subpial transection,MST);少数病例术前考虑癫痫灶位于颞叶内侧,行前颞叶切除,同时切除海马、杏仁核、内嗅区皮质等颞叶内侧结构;异常放电波及功能区时采取术中电刺激功能监测、术中唤醒技术等确定功能区后,行致痫灶切除+多处皮层热灼术或MST。术中密切监测患者感觉、肌力状况,当出现肌力、精细活动、感觉减退等情况,立即终止切除性手术操作。
1.4术后处理术后使用德巴金持续静脉泵入3 d,剂量根据患者体质量计算。术后第2天开始给予口服抗癫痫药物(antiepileptic drugs,AEDs),结合术前癫痫发作类型首选单个抗癫痫药物治疗,如单药治疗可以控制发作,但不能完全控制发作,则添加机制不同或者多种机制的AEDs治疗;如单药治疗无效,则换用另一种AEDs。
1.5统计学方法采用SPSS 19.0软件进行统计分析,对达到SimpsonⅠ/Ⅱ级切除与SimpsonⅢ/Ⅳ级切除患者术后癫痫控制情况采取卡方检验。对远隔组与邻近组术后癫痫控制情况采取独立样本四格表的Fisher确切概率法。P<0.05为差异有统计学意义。
2 结果
手术达到SimpsonⅠ、Ⅱ级切除94例,SimpsonⅢ级切除22例,SimpsonⅣ级切除8例。接受肿瘤邻近区域局部皮质切除40例,MST或低功率电灼术25例,同时接受局部皮质切除+MST或低功率电灼术者29例;肿瘤同侧远隔部位皮质切除3例,MST或低功率电灼术2例,皮质切除+MST或低功率电灼术2例。接受肿瘤对侧前颞叶切除及颞叶内侧结构切除1例(脑膜瘤术后8个月),肿瘤对侧新皮层致痫皮质切除2例(脑膜瘤术后1年);术前异常发放区域未处理者20例,其中5例患者手术切除肿瘤后再次皮层电极监测未见异常脑电发放。术后随访1~6年,平均2.5年,通过电话、门诊随访癫痫控制情况:EngelⅠ级98例(79.0%),EngelⅡ级11例(8.9%),EngelⅢ级12例(9.7%),EngelⅣ级3例(2.4%)。达到SimpsonⅠ、Ⅱ级切除94例中EngelⅠ级+EngelⅡ级者87例(92.6%)。达到SimpsonⅠ/Ⅱ级切除后,92.6%患者癫痫控制满意(EngelⅠ级+EngelⅡ级),而SimpsonⅢ/Ⅳ级切除者癫痫控制满意率为73.3%,差异有统计学意义(P=0.009)。远隔部位癫痫灶的存在或者处理不全将直接影响患者术后癫痫的疗效,邻近组患者术后癫痫控制满意率(90.4%)较远隔组(70.0%)高(P=0.023)。见表1、2。
3 讨论
对于以癫痫为主要症状的脑膜瘤患者,目前国内很多神经外科医师仅行单纯的切除肿瘤而缺乏对癫痫的重视,这在没有条件开展侵袭性颅内电极监测及术中皮层脑电监测的科室中更为常见,术后不少患者癫痫控制不良,生存质量差[1],有研究表明术前神经系统缺陷术后改善或恢复与癫痫发作控制密切相关[2]。为此术中对潜在致痫灶的处理将变得至关重要。由于没有证据证明癫痫与肿瘤的先后关系,如果癫痫的发生出现在肿瘤之前,两者极可能无明确的关系,则癫痫存在独立的发作起始区。临床上大多数情况下会认为癫痫是由肿瘤引起,没有去明确癫痫的真正起源。本组病例术前脑电图检查显示16.1%的患者异常发放区域在肿瘤的远隔部位,如单纯的切除肿瘤,术前被忽略致痫灶将成为术后癫痫控制不佳的直接原因。有研究显示约80%的术前有癫痫发作的患者肿瘤术后能达到无癫痫发作,但近20%的患者仍有癫痫发生或发展成新的致癫痫灶[3],目前对肿瘤与癫痫的关系了解甚少,有多种不同假说,可能的解释包括:压迫周围皮层引起局部刺激,微观肿瘤侵袭和缺血性改变到微血管闭塞[4]。由脑膜瘤本身引起的癫痫,其异常发放多位于肿瘤邻近的脑皮质。本组病例中104例(83.9%)的患者术前异常发放区域位于肿瘤邻近皮质,部分患者癫痫发作起始区存在于远隔部位甚至在肿瘤对侧部位。新的研究表明术前患者癫痫持续性发作更可能受益于术前脑电监测[5],术前脑电监测将成为手术方式的选择的抉择因素。实践证明不能轻易地认为脑膜瘤与癫痫均存在相关性,术中仅切除肿瘤及处理邻近区域皮质无疑将遗漏远隔部位独立的发作起始区,这将直接导致术后癫痫控制不佳。本组数据中3例患者术前在肿瘤的远隔部位监测到独立的发作起始,仅行肿瘤切除,癫痫控制不佳,呈习惯性发作,6个月~1年后接受致痫灶切除,术后癫痫控制良好。
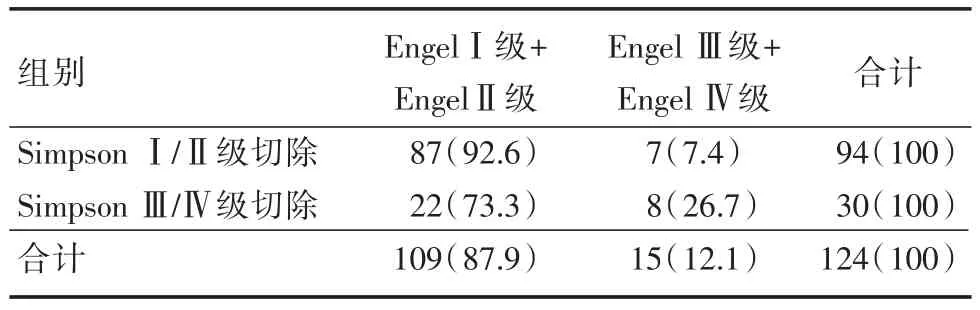
表1 以癫痫为主要症状的脑膜瘤术后Engel分级Tab.1 Epilepsy as the main symptom of meningioma postoperative Engel grading composition ratio 例(%)

表2 远隔组与邻近组术后Engel分级Tab.2 Distant group and adjacent group postoperative Engel grade ratio 例(%)
以癫痫为主要症状的脑膜瘤患者术后影响癫痫疗效的因素众多,如肿瘤切除的程度,术中对潜在致痫灶的处理是否彻底,特别是对远隔致痫灶的处理;DORZI等[6]报道表明术前癫痫病史是术后癫痫发作独立危险因素。本组病例整体癫痫控制满意率为87.9%,这与完整的术前评估密不可分。部分肿瘤受到局部解剖的限制不能达到彻底的切除甚至需要适当的残留,由于残余瘤体对局部脑组织的刺激仍然存在,这部分由肿瘤引起的继发性癫痫患者术后癫痫疗效将明显降低。结合本组数据显示,达到SimpsonⅠ/Ⅱ级切除后,92.6%的患者癫痫控制满意(EngelⅠ级+EngelⅡ级),而SimpsonⅢ/Ⅳ级切除者癫痫控制满意率为73.3%,差异有统计学意义(P=0.009)。可见肿瘤切除程度与术后癫痫控制的疗效有确切的相关性,是术后癫痫强有力的预测因子。
由于存在一定比例的患者癫痫灶位于肿瘤的远隔部位,甚至在肿瘤的对侧;对这部分的患者的处理是困难的,要处理远隔部位独立的发作起始区需要另行手术切口完成,这对于患者来说是不容易接受的,同时由于癫痫网络的存在,远隔部位的癫痫发作可能同样与肿瘤存在一定程度的相关性,在本组患者中有5例患者肿瘤切除后,原邻近区域异常发放皮质再次皮层监测未见明显的异常发放,这也给手术抉择带来困难。部分患者要求同时手术处理肿瘤及癫痫意愿明确,术后收到良好的效果。但这一处理方式存在一定程度的缺陷,不能被效仿,远隔部位的皮层切除需慎重,需在术前监测到明确的发作起始前提下进行。但这部分患者如单纯切除肿瘤,癫痫预后多较差,本组3例远隔部位存在独立发作起始患者,肿瘤切除术后癫痫控制不良,后经再次手术切除致痫灶后癫痫控制显著改善。远隔部位癫痫灶的存在或者处理不全将直接影响患者术后癫痫的疗效,本组数据显示邻近组患者术后癫痫控制满意率(90.4%)较远隔组(70%)高(P=0.023),多由于在存在远隔部位的癫痫患者,部分由于术前未能监测到发作期脑电图,同时患者对另行手术切口处理致痫灶的抉择困难、手术医师对这一处理方式的合理性持质疑态度等因素有关。笔者认为以癫痫为主要症状的脑膜瘤患者术前需要充分评估是否存在远隔部位的致痫灶,有必要提前让患者及家属预知癫痫的预后并充分尊重患者意愿,以降低医疗不良事件的发生。
MST通过切断皮质间的横向纤维联系,达到抑制癫痫放电的形成与扩散目的,同时保留了纵向纤维,使皮质的主要功能不受影响,从而避免了术后偏瘫、失语等并发症。低功率电凝热灼术与MST原理大致相当[7],由于MST、低功率电凝热灼术这些姑息性手术仍就存在一定程度的缺陷,理论上疗效在临床实际操作中不易精准地实现阻断所有致痫灶的传导;上述两种术术方式的疗效难以评价,因为很多病例接受上述术式的同时接受了切除性手术,这就不能明确手术效果是来自于MST及低功率电凝热灼术,还是病灶切除性手术,还是两者均有影响,其实用性及疗效有限。而且解剖定位的Broca及Wernicke区并非不能切除,只有皮层电刺激定位为语言功能区才不能切除,同样在肢体运动功能区性限制性切除,虽然术后出现功能障碍,多数数个月后消失。本研究在处理肿瘤邻近异常发放的皮质时,在非功能区及邻近功能区更多的多采取了局部皮质切除的术式及切除与MST或者低功率电凝热灼术,在功能区采取了MST或者低功率电凝热灼术。整体上术后87.9%的患者达到EngelⅠ级+EngelⅡ级疗效,75.8%的患者达到SimpsonⅠ/Ⅱ级切除。DENG等[8]报道了26例脑膜瘤伴中央区癫痫术后疗效,其中达到SimpsonⅠ级中有17例,Ⅱ级6例,Ⅲ级3例,但文中没有术后癫痫发作情况的叙述。其肿瘤切除率较本组病例高,这可能与病例组成及技术层面差异有关,本组患者中部分肿瘤位于矢状窦、天幕缘、蝶骨嵴等部位,无法达到广泛的切除硬脑膜。
传统观点认为完全切除致癫病灶可能会导致癫痫发作停止,但往往尽管全切了MRI上所见的病灶,癫痫发作仍然持续存在;原因为病灶可能引起致癫病灶远隔区域的脑组织一些细小的变化,而这些细小的变化是致癫的,对于这些患者来说,选择性的切除MRI上的病灶不足以使癫痫发作完全停止;同时MRI在探测整个病灶时的敏感性方面存在差异,病灶周围脑组织可能为病理学严重程度较轻的病变组织,尽管这些组织是致癫的,这在MRI上可能无法观察到,由于不能切除MRI上不能观察到的病变组织,因此术后不能有效的控制患者癫痫发作,目前7.0T MRI的使用有助于发现普通MRI无法显示的脑组织微细结构的改变而发现潜在的致痫灶[9]。对大部分癫痫患者,神经影像学技术发现的结构性改变,致癫区就在它的邻近部位,但也可在病变的远隔部位。本组数据显示绝大部分(83.9%)患者致癫区常在致癫病变邻近的皮质内,如单纯切除病变常无效果,应该切除病变和和邻近皮质内的致癫区才会有效。故外科医师不仅应切除一个邻近的一个致癫病变,而且应该切除附近的致癫区,同时尽可能解决远隔致痫灶,以期待优良的效果。
以癫痫为主要症状的脑膜瘤术后癫痫的预后有赖于术前尽可能明确肿瘤与癫痫关系:如是否为继发性癫痫;癫痫发作是否为习惯性发作;癫痫发作是否存在独立的发作起始区[10]。对于术前无癫痫发作的患者术后时常出现癫痫发作,这可能与手术对脑组织刺激、术区出血、脑组织移位、血流动力学改变、肿瘤切除后术区受压迫的脑组织因血管充血水肿加重等继发性反应有关。针对这部分患者术后易出现癫痫发作的因素有肿瘤位于运动区皮质、体积较大等[11]、部分切除及肿瘤进展[12]及肿瘤的分级,如低级别脑膜瘤术后癫痫发作率相对较低[13]。尤其是对凸面肿瘤,肿瘤全切是一种有效的保护因素[14],本研究结果也证实了这一结论;有效的团队合作和沟通、显微镜下精湛的手术技术、术中导航可能有助于降低术后的癫痫发作[15]。
本文仅从肿瘤、异常发放区两方面来研究术后癫痫控制的情况。缺乏脑膜瘤病理分级及影像学等方面来分析术后癫痫发作情况。针对这种高度个体化的复合性疾病,如何能达到“肿瘤-癫痫-功能”三者平衡的最优解,尚需进一步的探索。
[1]MATTHEW J T,ANTHONY G,EMMANUEL C,et al.The im⁃pact of epilepsy on the quality of life of patients with meningio⁃ma:A systematic review[J].Br J Neurosurg,2016,30(1):23⁃28.
[2]WIRSCHING H G,MOREL C,GMUR C,et al.Predicting out⁃come of epilepsy after meningioma resection[J].Neuro Oncol,2016,18(7):1002⁃1010.
[3]HAI X,OLAFUR S,TORBJOM T,et al.Intracranial meningio⁃mas and seizures:a review of the literature[J].Acta Neuro⁃chir,2015,157(9):1541⁃1548.
[4]BREEMEN M S,WILMS E B,VECHT C J.Epilepsy in pa⁃tients with brain tumours:epidemiology,mechanisms,and management[J].Lancet Neurol,2007,6(5):421⁃430.
[5]CHEN W C,MAGILL S T,ENGLO D J,et al.Factors associat⁃ed with pre⁃and postoperative seizures in 1033 patients under⁃going supratentorial meningioma resection[J].Neurosurgery,2017,81(2):297⁃306.
[6]DORZI A,HASAN M,ABDBDULLAH A,et al.Incidence,risk factors and outcomes of seizures occurring after craniotomy for primary brain tumor resection[J].Neuroscience,2017,22(2):107⁃113.
[7]SPENCER S S,SCHRAMM J,WYLER A,et al.Multiple sub⁃pialtransaction for intractable partial epilepsy:an internation meta analysis[J].Epilepsia,2012,43(2):141⁃145.
[8]DENG W S,ZHOU X Y,LI Z J,et al.Microsurgical treatment for central gyrus region meningioma with epilepsy as primary symptom[J].J Craniofac Surg,2014,25(5):1773⁃1775.
[9]CORAS R,MILESI G,ZUCCA I,et al.7T MRI features in con⁃trol human hippoeampus and hippocampal sclerosis:an ex vivo study with histologic correlations[J].Epilepsia,2014,55(12):2003⁃2016.
[10]OSTROM Q T,GITTLEMAN H,LIAO P,et al.CBTRUS sta⁃tistical report:primary brain and central nervous system tumors diagnosed in the United States in 2007⁃2011[J].Neuro Oncol,2014,16(4):1⁃63.
[11]HAMASAKI T,YAMADA K,YANO S,et al.Higher inci⁃dence of epilepsy in meningiomas located on the premotor cor⁃tex:a voxel⁃wise statistical analysis[J].Acta Neurochir,2012,154(12):2241⁃2249.
[12]ZHENG Z,CHEN P,FU W,et al.Early and late postoperative seizure outcome in 97 patients with supratentorial meningioma and preoperative seizures:a retrospective study[J].J Neuroon⁃col,2013,114(1):101⁃109.
[13]ROGERS L,BARANI I,CHAMBERLAIN M,et al.Meningio⁃mas:knowledge base,treatment outcomes,and uncertainties.A RANO review[J].J Neurosurg,2015 ,122(1):4⁃23.
[14]CHARLES C,ELENA W,SEBASTIAN B,et al.World Health Organization grade III meningiomas.A retrospective study for outcome and prognostic factors assessment[J].Br J Neurosurg,2015,29(5):693⁃698.
[15]WONG J M,PANCHMATIA J R,ZIEWACZ J E,et al.Pat⁃terns in neurosurgical adverse events:intracranial neoplasm surgery[J].Neurosurg Focus,2012,33(5):1⁃9.
