二乙酰二去水卫矛醇对肺癌细胞NCI⁃H460增殖及凋亡的影响
2018-04-03吴余燕徐佳佳邓超澄刘华钢汤婷婷
吴余燕 徐佳佳 邓超澄 刘华钢 汤婷婷
1广西中医药大学药学院(南宁 530001);2广西医科大学药学院(南宁 530021)
肺癌是目前世界各国最常见的恶性肿瘤之一,也是男性病死率最高的恶性肿瘤,治疗效果差,术后易复发[1-2]。因此,研究更多高效低毒的药物用于治疗或辅助治疗肺癌是许多学者的研究方向。二乙酰二去水卫矛醇(DADAG)是将去水卫矛醇(DAG)结构的3,4位羟基酯化得到[3]。本课题组前期研究[4-7]证实DAG对肺癌、脑肿瘤、卵巢癌等肿瘤细胞有明显的抑制作用。其他学者[8-11]发现DADAG对肝癌细胞HLE、BEL⁃7404、SMMC⁃7721、白血病L1210细胞的生长有明显的抑制作用。本研究通过探讨DADAG对肺癌细胞株NCI⁃H460增殖和凋亡的影响,从而为寻找出更多治疗肺癌的化疗药物提供实验基础。
1 材料与方法
1.1试剂与药物RPMI1640培养基(赛默飞世尔仪器有限公司);胎牛血清(维森特生物技术有限公司);PBS(0.01 mol/L)、青链霉素混合液(100 U/mL)、MTT、Giemsa染色液(北京索莱宝科技有限公司);AO/EB染色液、细胞凋亡检测试剂盒(南京凯基生物科技发展有限公司);RNAiso Plus试剂盒、SYBR Premix Ex TaqTMII、PrimeScriptTMRTreagent Kit(日本TaKara公司);DADAG由广西医科大学有机与药物化学教研室提供,用RPMI1640培养基溶解,0.22 μm微孔滤膜过滤后-20℃保存,临用前用培养基稀释到所需浓度。
1.2细胞肺癌细胞株NCI⁃H460购买于中国科学院细胞库。
1.3仪器311型CO2培养箱(Thermo Fisher scien⁃tific,USA);SpectraMaxPlus384型酶标仪(Tecan Austria GmbH);CFM⁃500E型倒置显微镜(重庆光学仪器厂出品);FacsCalibur型流式细胞仪(美国Becton Dickson公司);7300型Real⁃time PCR System(美国ABI公司)。
1.4实验方法
1.4.1细胞培养细胞于25 cm2培养瓶中以配好的完全培养基(含10%的胎牛血清和青链霉素混合液)培养于37℃、5%CO2培养箱中,实验均采用对数期增殖细胞。
1.4.2细胞增殖抑制率的测定(MTT法)取NCI⁃H460细胞调整密度为5 000/孔接种于96孔板中,细胞贴壁24 h后,加入含不同浓度DADAG的完全培养液100 μL,同时设置不含药的空白对照组,设置4个复孔。放置37℃、5%CO2培养箱中培养48 h后,每孔加入20 μL MTT溶液,培养箱中继续培养4 h,弃去上清,每孔加入150 μL二甲基亚砜,振荡溶解,于490 nm波长酶标仪测定吸光度值(OD)。实验重复3次。抑制率=(1⁃实验组平均OD值/对照组平均OD值)×100%。
1.4.3集落形成实验检测细胞集落形成能力接种细胞500/孔于6孔板中,每孔1 mL。37℃,5%CO2培养箱中培养144 h,倒置显微镜下观察细胞增殖情况。待单个细胞分裂至30~50个细胞后,算一个集落的形成。弃去孔内培养基,分别加含DADAG 11.50、23.00、46.00、69.00 μg/mL的完全培养基,1.5 mL,设置1个空白对照孔,培养箱中培养48 h后终止培养,弃去孔内液体,PBS清洗2遍,每孔加入1 mL甲醇固定10 min,弃去甲醇空气中干燥。用Giemsa染色液染色10 min,PBS清洗2遍,干燥,拍照观察。
1.4.4AO/EB染色接种细胞45×104/孔于6孔板中,每孔1 mL,设置空白对照孔。于37℃,5%CO2培养箱中培养24 h,给药组分别加入含DADAG 11.50、23.00、46.00、69.00 μg/mL 的完全培养基1.5 mL,空白组加入等量的培养基。在37℃,5%CO2培养箱中培养48 h后终止培养。小心弃去孔内液体,PBS冲洗2遍,每孔加入1 mL的PBS后,再加入20 μL的AO/EB混合液,染色2~3 min。倒置显微镜下观察并拍照。
1.4.5细胞凋亡状况的检测按照“1.4.4”方法处理细胞,DADAG作用48 h后,按照细胞凋亡试剂盒说明步骤处理细胞,通过流式细胞仪检测细胞凋亡。
1.4.6RT⁃PCR检测凋亡相关基因的表达按照“1.4.4”方法处理细胞,DADAG作用48 h后,提取RNA,并进行RNA的定量以及纯度分析,经反转录后的cDNA进行RT⁃PCR反应。基因序列来源于Gene Bank,委托TaKara公司合成,Bax F:5′⁃GAC⁃GAACTGGACAGTAACATGGA⁃3′,R:5′⁃GCAAAG⁃TAGAAAAGGGCGACA⁃3′;Bcl⁃2 F:5′⁃GTTCGGT⁃GGGTCATGTGT⁃3′,R:5′⁃ATCCCAGCCTCCGTTA⁃TCCT⁃3′。
1.5统计学方法采用SPSS 17.0软件进行统计分析,数据用表示,实验组与空白对照组之间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1DADAG对NCI⁃H460细胞株增殖的影响DADAG(2.88、5.75、11.50、23.00、46.00 μg/mL)对H460细胞作用48 h的OD值均较空白组低,差异有统计学意义(P<0.05)。随着给药剂量的增大,给药组OD值逐渐减小,说明药物对细胞的增殖抑制作用逐渐增强。DADAG作用于H460细胞48 h的OD值及抑制率见表1。利用SPSS 17.0软件概率单位法计算出DADAG对H460细胞的IC50值为24.79 μg/mL。根据计算出的IC50以及预实验结果,初步确定以11.50、23.0、46.00、69.00 μg/mL进行后续实验。
2.2DADAG作用后对H460细胞体外克隆形成能力的影响肿瘤细胞具有形成集落的能力,集落抑制实验常用于抗癌药物对肿瘤细胞增殖影响的观察。不同浓度的DADAG作用于H460细胞后,与空白组比较,给药组的集落形成明显受到抑制,随着给药浓度的增大,抑制越来越强,见图1。
表1 不同浓度DADAG对H460细胞的OD值以及抑制率Tab.1 The inhibitory rate and OD value of different concentration of DADAG on H460 cells ±s

表1 不同浓度DADAG对H460细胞的OD值以及抑制率Tab.1 The inhibitory rate and OD value of different concentration of DADAG on H460 cells ±s
注:与空白组比较,*P <0.05,**P<0.01
DADAG(μg/mL)0.00 2.88 5.75 11.50 23.00 46.00 OD 1.39±0.13 1.17±0.12*1.03±0.10*0.86±0.19**0.71±0.10**0.56±0.17**抑制率(%)0.00 15.68 25.82 38.17 49.30 59.61 48 h⁃IC50(μg/mL)24.79
2.3AO/EB染色观察细胞形态变化经方法1.4.4染色处理的各组细胞,在荧光显微镜下观察到的细胞形态如下:(1)空白组:细胞在荧光显微镜下核染色质呈绿色,且形态正常,细胞质透亮;(2)给药组:细胞在荧光显微镜下可观察到核染色质被呈橘红色,且随着给药剂量的增加,被染成橘红色的细胞数增多,细胞形态与空白组比较发生一定的变化,表现为细胞圆缩,不规则,见图2。
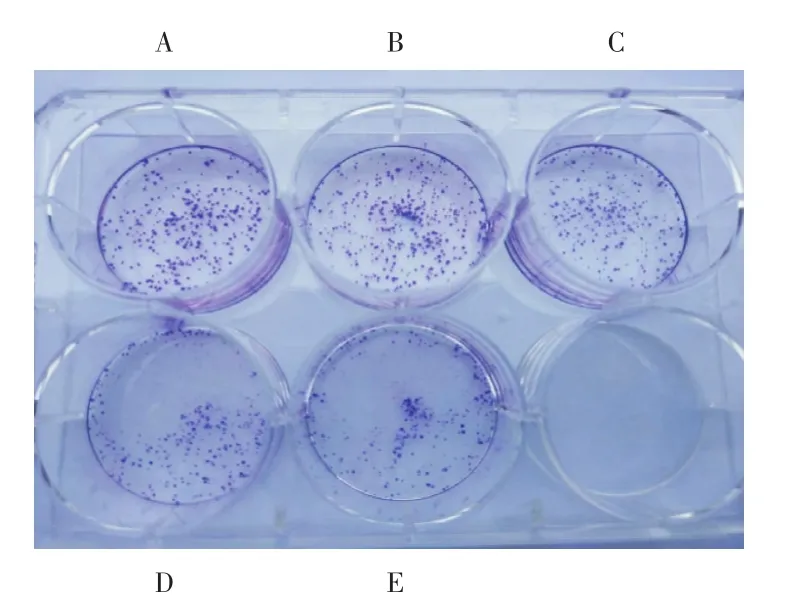
图1 不同浓度DADAG对H460细胞集落的影响Fig.1 Effects of different concertrations of DADAG on H460 cell colony

图2 AO/EB荧光染色法观察DADAG诱导H460细胞凋亡情况(200×)Fig.2 Effects of DADAG on apoptosis of H460 by AO/EB staining(200 ×)
2.4DADAG对H460细胞凋亡的影响流式细胞术检测结果见图3,在流式双变量散点图中左下象限表示活细胞,染色结果为Annexin V-PI-;左上象限表示坏死的细胞,染色结果为Annexin V-PI+;右下象限表示早期凋亡的细胞,染色结果为Annexin V+PI-;右上象限表示中晚期凋亡的细胞,染色结果为Annexin V+PI+。经DADAG处理过的细胞总凋亡率明显高于空白组,且随着DADAG给药量的增加,发生凋亡的细胞数越来越多,各组总凋亡率分别为:(5.71±0.88)%,(13.10±0.87)%,(28.94±0.44)%,(40.06±0.91)%,见图4。
2.5DADAG对H460细胞内凋亡相关基因的影响随着DADAG给药浓度的增加(23.00、46.00、69.00 μg/mL)NCI⁃H460细胞内Bcl⁃2的相对表达量减少,Bax的相对表达量增加,见图5。
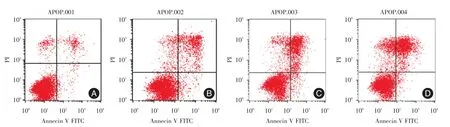
图3 H460经DADAG作用48 h后的细胞总凋亡分布图Fig.3 The distrbution of cell apopotosis of H460 cell after treated with DADAG for 48 h
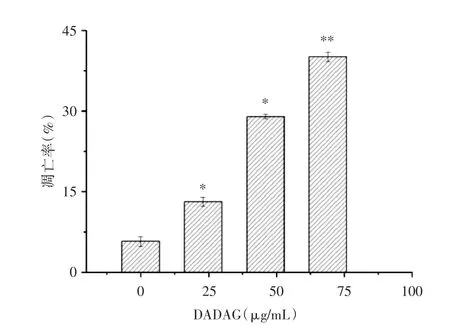
图4 H460经DADAG作用48 h后的细胞总凋亡率柱形图(n=3,±s)Fig.4 The histogram of total cell apopotosis of H460 cell after treated with DADAG for 48 h

图5 DADAG对NCI⁃H460细胞内Bcl⁃2、Bax mRNA表达的影响(n=3,±s)Fig.5 Effect of DADAG on Bcl⁃2、Bax mRNA express of H460 Cell
3 讨论
目前,关于DADAG的抗癌作用已有一些报道,但其抗癌机制还未见阐明[12]。本研究发现,DADAG能够显著地抑制肺癌NCI⁃H460细胞增殖,与空白组比较差异有统计学意义(P<0.05)。DADAG能够抑制H460细胞集落的形成,从染色结果可以看出,当DADAG浓度达到69.00 μg/mL时与空白组比较,集落数明显减少。MTT和集落实验提示,DADAG对NCI⁃H460细胞的增殖有抑制作用。细胞增殖是生命的基本特征之一,是个体发育和生命延续的基本保证,其实质是DNA的复制[13]。
细胞发生凋亡的过程中,细胞的形态会发生显著变化,因此从细胞形态的变化分析细胞凋亡是最基本的方法。本研究根据48 h⁃IC50值选取了11.50、23.00、46.00、69.00 μg/mL 药物浓度,采用AO/EB染色法进行细胞凋亡形态学的观察。进一步用流式细胞仪定量检测,给药组中细胞的凋亡率随着给药量增加而增大。DADAG 46 μg/mL组的细胞增殖抑制率和凋亡率分别为59.61%和28.94%。该结果提示DADAG能够引起肺癌NCI⁃H460细胞凋亡,但抑制NCI⁃H460细胞增殖作用并不完全源于其诱导凋亡的作用,DADAG也有可能调控NCI⁃H460细胞的细胞周期,使细胞周期发生阻滞产生一定的抑制细胞增殖作用。这一假设还需后续实验进一步验证。
研究[14-15]表明DADAG对肝癌细胞HLE、白血病HL⁃60细胞产生凋亡使细胞死亡。已发现的参与细胞凋亡的基因主要有 Bcl⁃2、Caspase、Bax、p53、Fas、FasL等,研究较多的一类基因是Bcl⁃2基因家族,Bax也属于Bcl⁃2基因家族,Bax与Bcl⁃2分别是细胞内重要的凋亡促进蛋白和凋亡抑制蛋白[16-18]。本研究应用RT⁃PCR法检测H460细胞凋亡结果提示DADAG能够诱导肺癌细胞H460产生凋亡,其凋亡的机制可能与促凋亡基因Bax表达量上调,抗凋亡基因Bcl⁃2基因的表达量下调有关。
综上所述,DADAG能够抑制肺癌细胞NCI⁃H460的增殖,并诱导其产生凋亡,作用机制可能与Bax表达量上调,Bcl⁃2的表达量下调有关。本研究为DADAG对肺癌细胞NCI⁃H460体外作用机制提供了重要的理论依据,但也存在一定的局限性,本研究目前只探讨了DADAG对NCI⁃H460的体外作用,体内作用还在摸索中;考察的基因表达谱较窄,外源性死亡受体途径相关基因及蛋白表达谱的变化有待进一步研究。
[1]常咏梅,颜文森,江小运,等.miR⁃3p靶向AEG⁃1抑非小细胞肺癌细胞增殖[J].实用医学杂志,2017,14(33):2267⁃2271.
[2]SIEGEL R,MA J,ZOU Z H,et al.Cancer statistics[J].CA:Cancer J Clin,2014,64(1):9⁃29.
[3]ERDEYI T V,KERPE F S,KAN Y B,et al.Pharmacokinetic study in a phase I trial with an alkylating agent,diacetyidianhy⁃drogalactitol(DADAG)[J].Cancer Chemother Pharmacol,1986,16(3):257⁃263.
[4]梁乔芳,刘华钢,谭强,等.二去水卫矛醇对人脑肿瘤细胞体外抑制作用[J].广西科学,2015,22(4):454⁃456.
[5]张慧玲,王稼农,梁霜,等.二去水卫矛醇对四种肿瘤细胞的体外抑制作用[J].广西科学,2013,20(1):82⁃84.
[6]周莹,刘华钢,苏桂玉,等.二去水卫矛醇对人卵巢癌细胞的体外抑制作用[J].广西中医药大学学报,2015,18(4):66⁃67.
[7]苏桂玉,刘华钢,黄慧学,等.二去水卫矛醇对人肺癌细胞株体外抗癌活性及机制探讨[J].中国实验方剂学杂志,2016,22(10):122⁃127.
[8]杨锦南,杜宝顺,詹合琴,等.二乙酞二脱水卫矛醇对白血病L1210细胞生长的抑制作用[J].新乡医学院学报,2006,23(2):145⁃146.
[9]曹林枝,滕少康,廖志红,等.双脱水二乙酰卫矛醇对3种肝癌细胞生长的影响[J].广西医科大学学报,2007,24(4):572⁃574.
[10]许建功,何瑞芳,赵营,等.二乙酰二脱水卫矛醇对白血病L1210细胞增殖的抑制作用[J].华西药学杂志,2006,23(2):147⁃148.
[11]韦怡怡,赖国丽,邓振德,等.双脱水二乙酰卫矛醇对人肝癌细胞生长影响的研究[J].广西医科大学学报,2005,27(2):174⁃176
[12]ZHANG X Y,LIAN Y X,GUO W,et al.Anticancer activity and mechanisms of diacetyldianhydrogalactitol on hepatoma QGY⁃7703 cells[J].Anticancer Drugs,2009,20(10):926⁃931.
[13]陈建平,张春江,赵丹,等.1,25⁃二羟维生素D3对人系膜细胞增殖与凋亡的影响[J].实用医学杂志,2014,30(3):342⁃345.
[14]LAI X J,CAO L Z,ZHOU Y,et al.Apoptosis of hepatocarci⁃noma cell line HLE induced by the combination of wild type P53 gene and 1,2:5,6⁃dianhydro⁃3,4⁃diacetylgalactitol[J].Ai Zheng,2004,23(10):1139⁃1143.
[15]YANG J N,LIU J Y,XU H,et al.Apoptosis induced by di⁃acetyldianhydrogalactitol and its mechanism in HL⁃60 leukemia cells[J].Yao Xue Xue Bao,2002,37(9):691⁃695.
[16]李奎,刘英,康相涛.主要凋亡基因对细胞凋亡的调控[J].解剖科学进展,2007,13(1):62⁃65,70.
[17]ISHII H H,GOBE G C,YONEYAMA J,et al.Role of p53,apoptosis,and cell proliferation in early stage Epste⁃Barr virus positive and negative gastric carcinomas.[J].J Clin Pathol,2004,57(12):1306⁃1311.
[18]杨贞,郭新宇,李海霞,等.益气法对超排卵小鼠卵巢颗粒细胞 Bcl⁃2、Bax、Caspase3 表达的影响[J].实用医学杂志,2017,13(33):2105⁃2108.
