聚乙烯亚胺对人血清白蛋白的构象和结合能力的影响
2018-03-29韦邦帜郭志勇王帆黄爱民马林
韦邦帜,郭志勇,王帆,黄爱民,马林
广西大学化学化工学院,南宁 530004
1 引言
基因治疗由于在治疗和预防遗传性和获得性疾病方面具有的潜在应用而成为现代医学领域最前沿的研究课题之一,基因治疗应用最大的障碍在于缺乏高效、安全的基因载体系统。病毒载体是迄今最有效的基因传递系统,但是病毒载体常常引起严重的细胞毒性和免疫反应,使得人们把注意力逐步转向以阳离子聚合物和阳离子脂质体为基材而设计和制备基因载体系统1–4。聚乙烯亚胺(polyethyleneimine,PEI)由于其高电荷密度和独特的“质子海绵效应”而具有良好的转染效率,相对分子量25 kDa的支化PEI和相对分子量22 kDa的线性 PEI被认为是高分子基因载体的“黄金标准”5–8。
PEI材料具有不同程度的细胞毒性,然而,载体材料的细胞毒性评估大都是建立在体外细胞活性分析(如 MTT)的基础上,这种试验通常在利用材料处理细胞后4–8 h进行,其结果只能反映细胞对材料的急性应答,可能并不代表基因治疗中载体材料安全性的真实情况6–11。Moghimi等9发现利用PEI处理细胞后24 h受处理细胞中才表现出明显的半胱天冬酶激活现象(细胞凋亡的表现)。目前,尽管 PEI基因载体材料的改性工作已有大量报道6–8,但是人们对PEI进入生物后对各种生物大分子和细胞器的结构功能的影响和作用机理的了解还相当缺乏。
在实际应用中,载体材料携带基因通过多种途径进入生物体。由于血管网络遍及生物体,载体材料及其降解碎片总会或多或少、或早或迟、或直接或间接地进入生物体循环系统,因此,研究载体材料对血浆蛋白和血细胞的结构和功能的影响也是其安全性评估的重要内容。研究显示,PEI能与血浆蛋白结合并引起血红细胞、血小板的结构和聚集状态的变化11,12。血清白蛋白是血浆中最丰富的蛋白质,在维持体内pH平衡、血浆渗透压方面具有重要作用。同时,血清白蛋白是循环系统中最重要的运输蛋白之一,在许多外源性和内源性活性分子的转运、分配和代谢中具有关键作用13,14,因此成为了研究生物材料生物相容性最常用的模型蛋白质之一15–20。但是,到目前为止,关于 PEI对血清白蛋白结构和结合功能的影响的报道还非常少。
论文综合应用吸收光谱、荧光光谱、圆二色谱(circular dichroism,CD)、动态光散射(dynamic light scattering,DLS)技术和zeta-电位测定研究相对分子量为25和1.8 kDa的支化PEI与人血清白蛋白(human serum albumin,HSA)的相互作用对HSA 构象的影响。同时以 8-苯氨基萘-1-磺酸镁(8-anilino-1-naphthalenesulfonic acid,ANS)和槲皮素(quercetin,Que)为模型化合物,应用荧光光谱法分析PEI对HSA与小分子化合物结合能力的影响及机理,为了解 PEI生物安全性的分子作用机制提供有用信息。
2 实验部分
2.1 试剂
支化PEI (平均相对分子量为1.8和25 kDa,记为 PEI1.8k和 PEI25k)、HSA(> 96%,冻干粉)和ANS (> 97%)购自美国Sigma公司,生化纯槲皮素购自国药集团试剂有限公司。所有试剂未经进一步纯化直接使用。
PEI和 HSA 溶解于 10 × 10−3mol·L−1磷酸盐缓冲溶液(PBS,pH7.4)分别配制 10 mg·mL−1和 2.5 ×10−4mol·L−1储备液,以 HCl/NaOH 溶液调节 pH至7.4,0–5 °C保存备用,使用时以PBS稀释至所需要的浓度。由于论文工作中所用的 PEI的平均相对分子量相差很大,为便于比较,PEI的浓度以质量浓度表示,而其他物料的浓度则以摩尔浓度表示。
ANS溶解于PBS制成储备液,0–5 °C保存。ANS储备液浓度利用日本 Shimadzu UV-2501PC分光光度计在350 nm测定,摩尔吸光系数取6300 L·mol−1·cm−121。
槲皮素溶解于分析纯乙醇配制 1.0 × 10−2mol·L−1储备液,0–5 °C 保存备用。使用前以 PBS稀释至 1.0 × 10−4mol·L−1,光谱测定时稀释至所需浓度。
2.2 仪器和实验方法
2.2.1 蛋白质内源荧光
以PBS缓冲液配制系列浓度的PEI溶液,加入 HSA储备液、混合均匀(HSA最终浓度为 5 ×10−6mol·L−1),25 °C 下利用日本 Shimadzu RF6000荧光分光光度计测定 HSA的发射荧光光谱(λex=295 nm),测量时激发和发射狭缝宽度为3 nm,波长扫描范围为300–450 nm。
2.2.2 紫外-可见光吸收
配制PEI浓度系列变化的HSA-PEI溶液,以相同浓度的PEI溶液作为参比,利用1 cm光程石英比色皿在日本 Shimadzu UV-2501PC分光光度计测定 HSA的吸收光谱,波长扫描范围为 200–500 nm。
2.2.3 动态光散射和zeta-电位
配制PEI浓度系列变化的HSA-PEI溶液,25 °C下在英国Malvern Zetasizer Nano ZS纳米粒度电位测定仪上测定 HSA的流体动力学直径和 zeta-电位。相同条件下至少测定3次,结果取平均值。
2.2.4 圆二色谱
配制PEI浓度系列变化的HSA-PEI溶液,使用光程为 1 mm的石英样品池在 Chirascan Spectrometer型 CD 光谱仪(英国 Applied Photophysics Ltd.公司)室温下测定 HSA 在 190–250 nm的圆二色谱,测量时扫描步进0.5 nm,响应时间0.1 s,每个样品重复扫描3次后取平均。相同条件下测定同浓度 PEI溶液的圆二色谱,其影响在最终结果中扣除。
2.2.5 ANS和槲皮素荧光
准确移取所需的 ANS (或槲皮素)储备液、HSA储备液和PEI储备液,配置PEI浓度系列变化的 ANS (或槲皮素)-PEI溶液和 ANS (或槲皮素)-PEI-HSA溶液(ANS、槲皮素和HSA最终浓度均为 5 × 10−6mol·L−1,利用 1 cm × 1 cm 石英比色皿在日本Shimadzu RF6000荧光分光光度计上测定ANS和槲皮素的发射荧光光谱。ANS荧光激发波长λex= 388 nm,波长扫描范围为400–600 nm;槲皮素荧光激发波长λex= 465 nm,波长扫描范围为480–700 nm。测量时激发和发射狭缝宽度为3和1.5 nm。
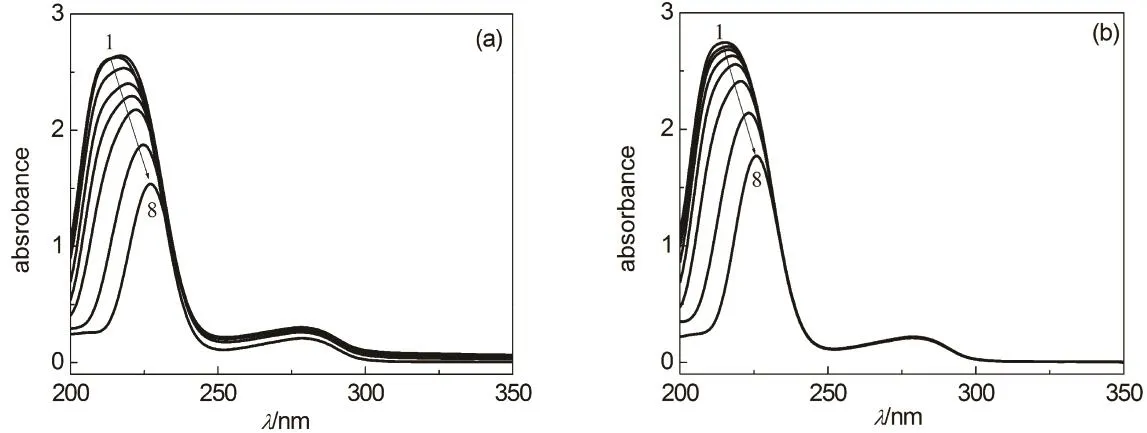
图1 HSA在含PEI的PBS缓冲液(pH 7.4)中的吸收光谱
3 结果与讨论
3.1 PEI与HSA的相互作用对HSA构象的影响
3.1.1 吸收光谱
HSA在含系列浓度PEI的缓冲液中的吸收光谱汇总于图1。在PBS缓冲溶液中,HSA在210 nm附近具有一个强的吸收峰。一般认为,蛋白质在190–240 nm 的吸收源自于酰胺基团的 n→π*和π→π*跃迁,其变化与骨架肽链的结构有关,可以反映蛋白质二级结构的变化22,23。图2给出了含不同浓度PEI的缓冲液中HSA酰胺基团最大吸收波长和最大吸收强度,可见,随着溶液中 PEI浓度的增加,HSA酰胺基团吸收峰逐步红移,吸收强度下降,意味着PEI可能与HSA的酰胺基团结合并对其二级结构产生影响。
PEI与HSA结合形成复合物还表现为溶液体系光密度的变化。HSA和PEI在300 nm以上波长基本没有吸收(图 1和图 S1 (见 Supporting Information)),但是实验发现,HSA溶液中添加少量PEI25k可以使得300 nm以上波长的吸光度轻微增加(图1),由于实验中以同浓度的PEI溶液为参比,因此HSA-PEI溶液300 nm以上波长的吸光度主要归因于溶液中HSA-PEI复合物颗粒光散射导致的光密度的变化。图3给出了HSA-PEI25k溶液500 nm光密度值随着溶液中PEI25k浓度的变 化 关 系, 可 见, cPEI25k≥ 0.2 mg·mL−1时HSA-PEI25k溶液500 nm光密度值基本不变,表明PEI25k与HSA结合达到饱和。
蛋白质分子芳香族氨基酸残基的 π→π*跃迁在260–300 nm范围内产生一个弱的吸收峰,其吸收强度和波长的变化通常意味着酪氨酸、色氨酸和苯丙氨酸所处微区环境发生改变24。在实验研究的PEI浓度范围内,HSA芳香族氨基酸残基最大吸收波长无明显变化,但是少量PEI25k可以使吸收强度明显增加,PEI25k浓度大于0.2 mg·mL−1时吸收强度轻微下降。这一规律与溶液体系光密度的变化不同(图3),说明芳香族氨基酸残基暴露程度减小,蛋白质分子可能形成更紧密的构象。
由图1和图2可以看到,PEI与蛋白质的相互作用具有明显的分子尺寸效应,相对分子量较大的 PEI25k对 HSA构象的影响更明显,HSA-PEI1.8k溶液250 nm以上波长吸收光谱变化很小,因此图3未给出含PEI1.8k的缓冲液中HSA氨基酸残基吸收和溶液光密度的分析结果。
3.1.2 zeta-电位
图4给出了含不同浓度PEI25k和PEI1.8k的缓冲液中HSA的zeta-电位。HSA是一种酸性蛋白(pI ~5.6)25,在中性 PBS (pH7.4)中其 zeta-电位为−10.5 mV。溶液中添加PEI25k导致HSA表面电位增加,并在浓度大于0.06 mg·mL−1时转变为正值。PEI1.8k同样导致HSA表面电位增加,但是在研究的浓度范围内,HSA的zeta-电位均为负值。
PEI为多胺化合物,其氨基易于发生质子化而带正电荷。Yasuhara等26研究表明相对分子量较低的PEI更易于质子化。Sabín等27曾测定PEI1.8k在不同pH下的zeta-电位,根据他们的结果,pH7.4时PEI1.8k的zeta-电位约为13 mV。我们的实验结果显示,PEI25k和PEI1.8k在PBS (pH 7.4)中的zeta-电位分别为7.0和14.1 mV,与Yasuhara26和Sabín27等的结果相吻合。然而,由图4可以看到,相对分子量较高的PEI对HSA表面电位具有更大的影响,说明HSA表面电位的增加不是由于与带正电荷的PEI的简单混合、而是由于HSA与PEI形成静态复合物而造成的。
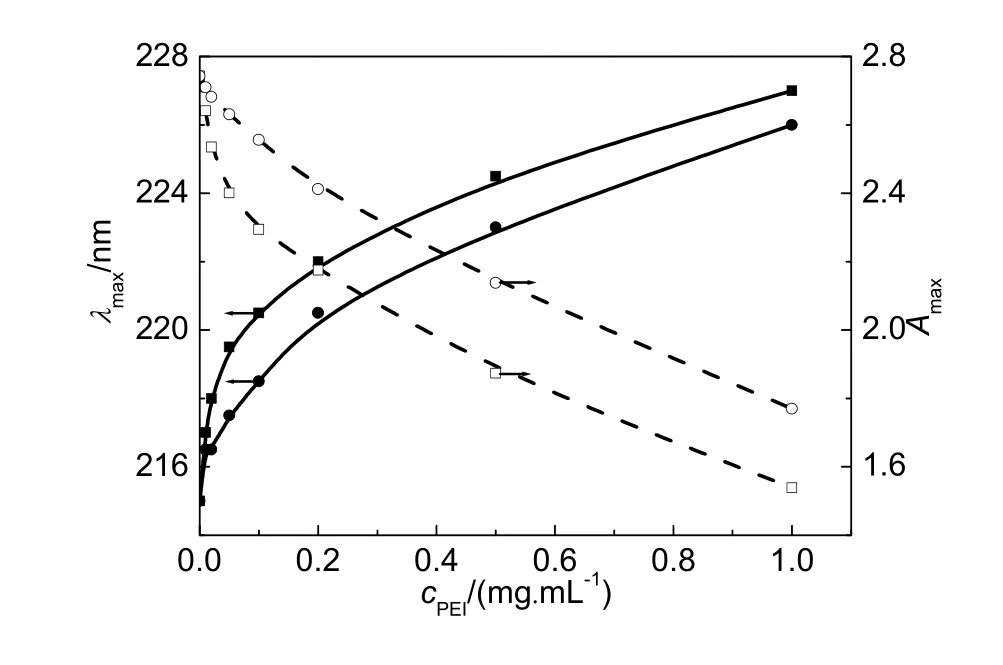
图2 PBS缓冲液(pH 7.4)中HSA酰胺基团最大吸收波长λmax (实线)和最大吸收强度Amax (虚线)随着PEI浓度的变化关系
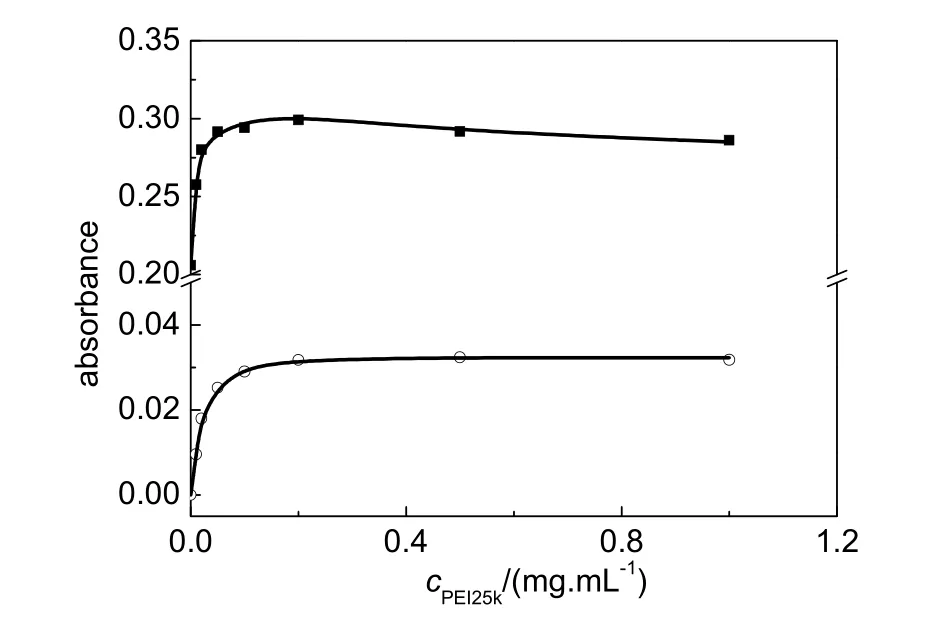
图 3 HSA-PEI25k 溶液 280 nm (■) 和 500 nm (○)吸光度随着溶液中PEI25k浓度的变化关系
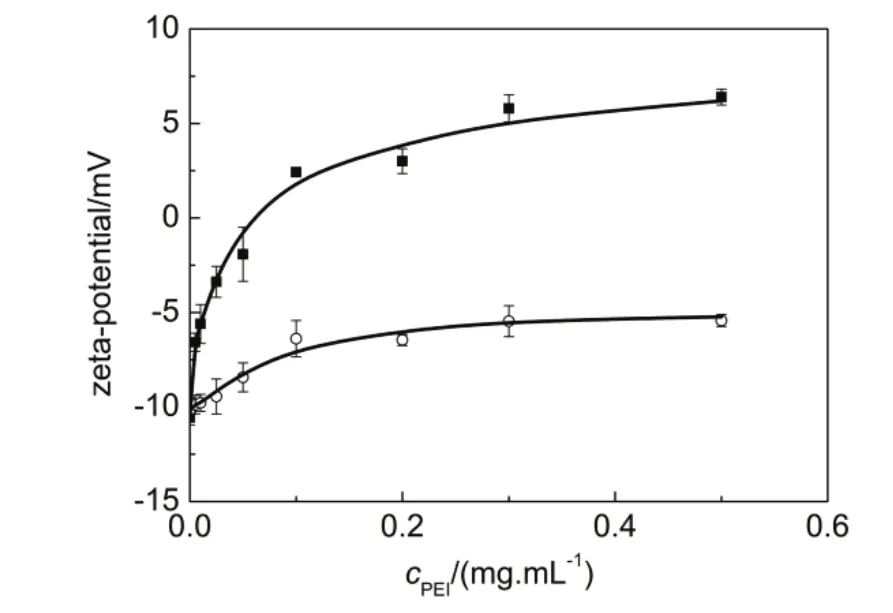
图4 PBS缓冲液(pH 7.4)中HSA的zeta-电位随着PEI浓度的变化关系
大分子离子吸附带相反电荷的聚电解质常常导致表面电位的反转。在含高浓度PEI25k的缓冲液中HSA-PEI复合物的表面电位为正值,说明结合在HSA表面的PEI分子所携带的正电荷多于蛋白质的负电荷。根据Nguyen和Shklovskii的观点28,29,由于分子间或者支链间的静电排斥作用,吸附于蛋白质表面的 PEI只有部分链段与蛋白质产生结合,而游离的阳离子基团导致表面电位的反转。研究显示,相对分子量较低的 PEI更倾向于以平铺的构象吸附在阴离子基质的表面30。Anderson等31认为PEI以疏松、卷曲的构象平铺结合在蛋白质分子表面,相对分子量较低的 PEI更有利于与蛋白质分子产生紧密的接触。因此,与PEI25k相比,结合在HSA表面的PEI1.8k分子上游离的阳离子氨基基团的数量较少,从而使复合物具有较低的表面电位(图4)。
3.1.3 动态光散射
利用DLS测定了HSA-PEI溶液的平均流体动力学直径,结果汇总于图5。HSA在PBS中的流体动力学直径约为10.2 nm,添加少量PEI25k (≤ 0.05 mg·mL−1)使得溶液的平均流体动力学直径先减小后增加,在0.01 mg·mL−1附近达到最小值,进一步增加PEI25k浓度时平均流体动力学直径缓慢增加。低浓度PEI1.8k (≤ 0.02 mg·mL−1)同样导致溶液平均流体动力学直径迅速减小,随着PEI1.8k浓度的进一步增加,溶液平均流体动力学直径轻微减小。
HSA-PEI溶液平均流体动力学直径的变化可能受到以下因素的影响:(1) PEI对溶液体系散射光的影响,(2) PEI与HSA结合形成复合物,(3)HSA构象的变化。高支化PEI分子可以近似看作球形26,由于所用PEI的相对分子量较大,其对HSA流体动力学直径的测定不容忽视,因此论文利用DLS 技术测定 0.1、0.5 和 1.0 mg·mL−1三个不同浓度下 PEI的流体动力学直径,结果显示改变浓度对PEI分子的流体动力学直径的影响可以忽略,PEI25k和PEI1.8k分子的平均流体动力学直径分别为 10.9 和 2.5 nm。由图 5可以看到,PEI25k浓度大于 0.05 mg·mL−1时,HSA-PEI25k 溶液平均流体动力学直径缓慢增加,并与PEI25k分子流体动力学直径非常接近,因此可以认为含高浓度PEI25k的HSA-PEI25k溶液体系动态散射光测定结果主要体现PEI25k的影响。由于HSA-PEI复合物的形成将导致颗粒流体动力学直径的增加,因此含低浓度PEI25k的HSA-PEI25k溶液平均流体动力学直径减小说明HSA形成更紧密的构象。由Rayleigh定律可知,散射光强度与颗粒粒径的 6次方成正比,由于PEI1.8k的流体动力学直径远小于HSA,因此HSA-PEI1.8k溶液动态散射光测定结果主要体现 HSA-PEI1.8k复合物的形成和蛋白质分子的构象变化,溶液平均流体动力学直径减小表明PEI1.8k与HSA的相互作用导致蛋白质分子形成更紧密的构象。
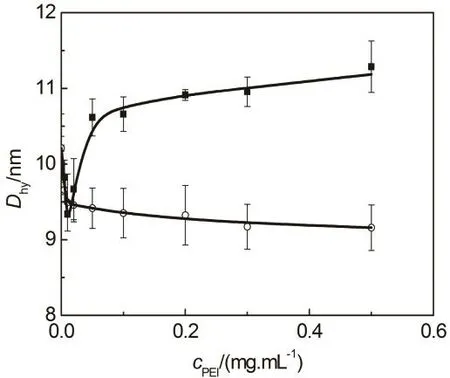
图5 HSA-PEI溶液平均流体动力学直径Dhy随着溶液中PEI浓度的变化关系
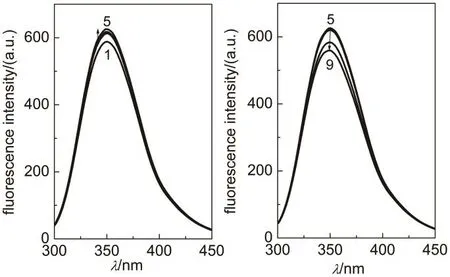
图6 PBS缓冲液(pH 7.4)中PEI25k对HSA发射荧光光谱的影响
3.1.4 内源荧光
蛋白质内源荧光主要来自色氨酸残基和酪氨酸残基。色氨酸残基荧光对环境极性非常敏感,一般情况下,色氨酸残基的荧光光谱发生红移,意味着所处微区环境极性增强或在极性环境中的暴露程度增加32,33。由于酪氨酸与色氨酸残基的荧光光谱相互叠加,对蛋白质荧光光谱的分析带来一定的困难,论文采用295 nm激发波长避免酪氨酸残基与色氨酸残基之间的共振能量转移由于蛋白质分子构象变化对后者发射荧光的影响32。由于PEI1.8k对HSA荧光光谱的影响不明显,图6仅给出了HSA在含PEI25k的缓冲液中的详细结果。由图可见,PBS缓冲溶液中HSA色氨酸残基在350 nm附近出现最大荧光,低浓度PEI25k对HSA最大发射波长无明显影响,但是高浓度PEI25k导致HSA色氨酸发射荧光光谱轻微蓝移,说明色氨酸残基所处环境极性下降。HSA只有 1个色氨酸残基Trp214,位于结构亚域IIA的疏水口袋中34,35,上述结果说明PEI结合导致HSA形成更紧密的构象,与吸收光谱分析相吻合。
3.1.5 圆二色谱
论文测定了含PEI溶液中HSA的圆二色谱(详细结果见图S2 (Supporting Information))。HSA在208和222 nm出现两个明显的负峰,这是α-螺旋结构的圆二色特征36,37。与PEI25k的结合不改变HSA的圆二色特征,但是208和222 nm圆二色椭圆度随着 PEI25k浓度的增加先减小后增加,在0.02 mg·mL−1附近达到最小值。与 PEI25k不同,PEI1.8k使得 HSA圆二色椭圆度持续下降(图 7)。Mazzaferro等25认为酸性蛋白质在PEI溶液中聚集导致 CD信号的减弱,然而,比较图 7与图 3和图5可以看到,含PEI溶液中HSA圆二色椭圆度与溶液光密度的变化规律具有很大区别,而与溶液平均流动动力学直径的变化非常相似,说明HSA圆二色椭圆度的变化主要是由于蛋白质构象的变化引起的,相对分子量较低的PEI1.8k和低浓度的PEI25k引起HSA的α-螺旋结构增加,而高浓度的PEI25k对HSA二级结构具有稳定作用。
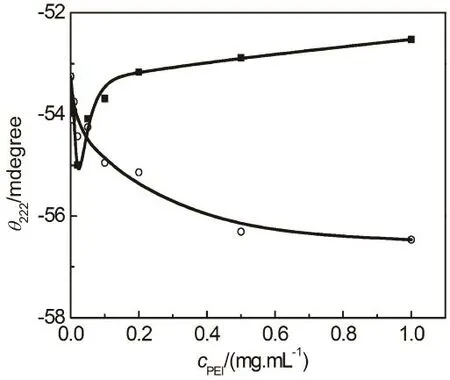
图7 PBS缓冲液(pH 7.4)中HSA在222 nm的圆二色椭圆度θ222随着PEI浓度的变化关系
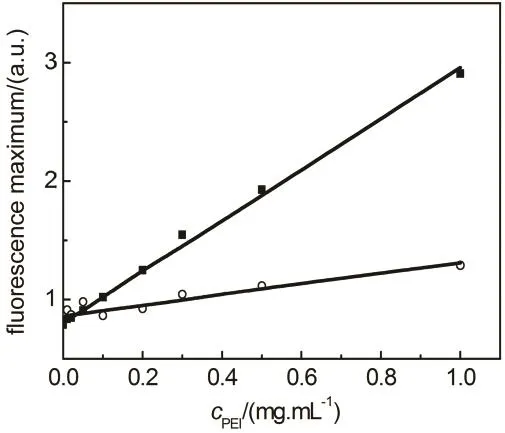
图8 PBS缓冲液(pH7.4)中ANS最大发射荧光强度随着PEI浓度的变化关系
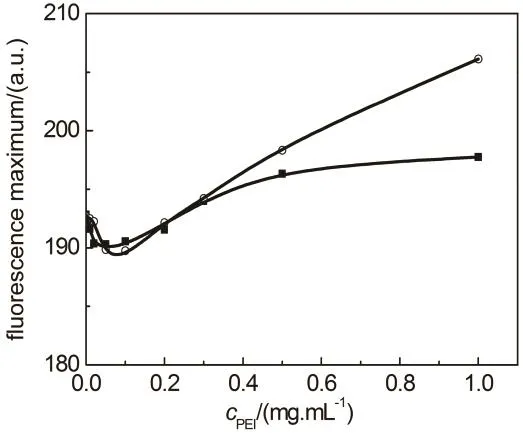
图9 含HSA的PBS缓冲液(pH 7.4)中ANS最大发射荧光强度随着PEI浓度的变化关系
3.2 PEI对药物小分子与HSA结合的影响
3.2.1 HSA-ANS结合
ANS能与血清白蛋白结合并猝灭其内源荧光38,39。荧光猝灭法是研究药物分子与蛋白质相互作用的有用方法,但是ANS-HSA-PEI溶液中各组分之间相互作用和蛋白质构象变化使得解释HSA与ANS之间的共振能量转移变得很复杂。因此,论文根据ANS荧光光谱分析PEI对HSA与ANS结合能力的影响,测定了PEI浓度系列变化的ANS-HSA-PEI溶液中ANS的发射荧光光谱(λex=388 nm),考虑到PEI与ANS的相互作用,论文同时测定了ANS-PEI溶液中ANS荧光光谱(详细结果汇总于图 S3和 S4 (见 Supporting Information)),其最大荧光发射强度随着溶液中PEI浓度的变化规律示于图8和图9。
ANS是分析疏水相互作用的良好探针,其荧光强度的增强和最大发射波长蓝移通常意味着所处环境疏水性的增强32,40。实验结果显示,PBS中ANS在517 nm附近有一个非常弱的荧光峰,添加 PEI引起 ANS荧光轻微增强和光谱蓝移(图S3),说明PEI分子与ANS结合并增强了ANS所处环境的疏水性。与HSA的结合使得ANS的荧光蓝移至473 nm,荧光强度急剧增强(图S4),说明ANS进入了HSA的疏水内核。中性条件下ANS在HSA和BSA分子上的平均结合位点数分别为14和17.641,Daniel和Weber39的研究结果显示,ANS与BSA结合后其荧光大部分来自结合在疏水内核的4–5个ANS分子。由此可知,ANS-HSA-PEI溶液中任何两个组分间都能形成复合物。由于PEI结合在蛋白质表面,同时 PEI分子具有大量的氨基基团,因此可以假设HSA-PEI复合物的形成对PEI与ANS结合的影响较小,PEI对HSA与ANS结合能力的影响取决于PEI与ANS的竞争结合和蛋白质构象变化。由于HSA对ANS荧光的增强作用远大于PEI (图8和图9),PEI竞争结合将导致ANS荧光强度的下降。然而,由荧光光谱分析可知,PEI结合增强了HSA分子内部疏水性,这将有利于与 ANS的结合。这就很好解释了ANS-HSA-PEI溶液中 ANS的荧光强度随着 PEI浓度的增加而先减弱后增强的现象(图 9)。尽管PEI25k对蛋白质构象的影响更有效,但是图9结果显示含PEI1.8k溶液中ANS荧光的变化更明显,这可能归因于相对分子量较大的PEI25k具有更强的ANS结合能力(图8)。
3.2.2 HSA-槲皮素结合
槲皮素具有荧光活性,但是5-羟基与4-羰基的氢键作用使得槲皮素容易发生激发态质子转移反应,在水中观察不到明显的荧光,槲皮素与其他分子结合时常常可以消除分子内氢键导致的荧光猝灭,从而表现出不同的荧光特征42–46。因此,论文根据槲皮素荧光光谱分析PEI对HSA与槲皮素结合能力的影响,测定了 PEI浓度系列变化的槲皮素-PEI溶液和槲皮素-HSA-PEI溶液中槲皮素的发射荧光光谱(λex= 465 nm),结果汇总于图10和11。
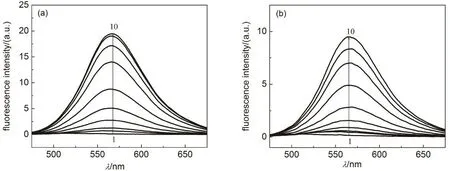
图10 含PEI的PBS缓冲液(pH 7.4)中槲皮素发射荧光光谱
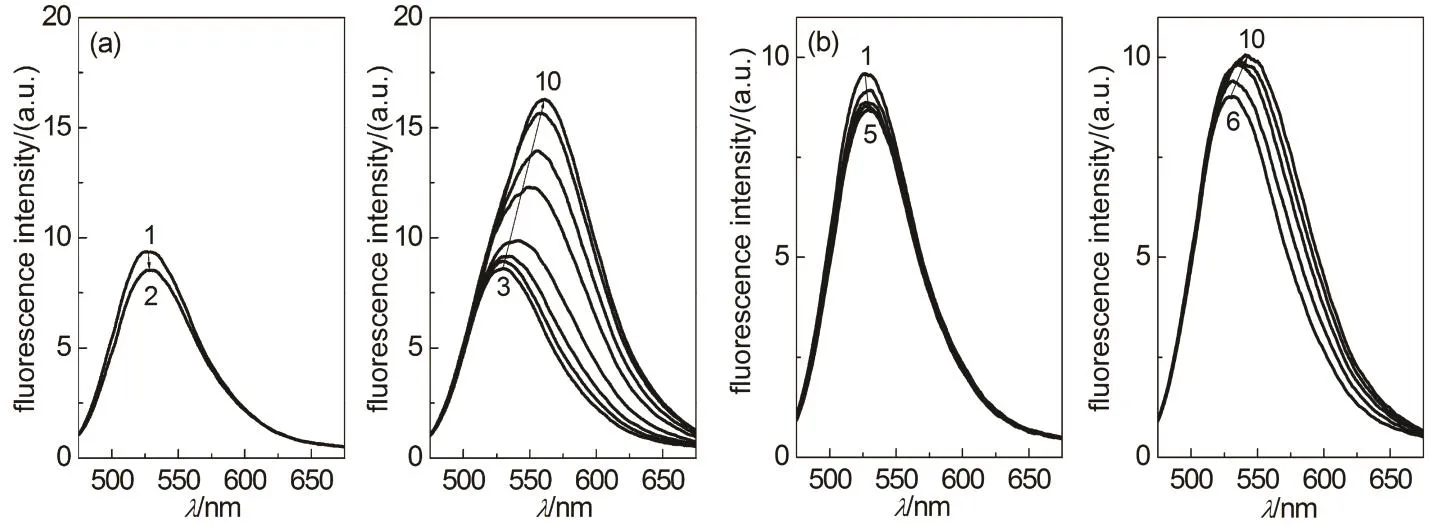
图11 含HSA和PEI的PBS (pH 7.4)缓冲液中槲皮素的发射荧光光谱
槲皮素在PBS中无明显荧光(图10),与HSA结合后在530 nm附近表现出较强的荧光(图11)。槲皮素与 BSA结合后也有相同的现象。Dangles等44认为,与BSA的结合促进了槲皮素的5-羟基、3-羟基和 4-羰基之间的分子内质子转移,形成高荧光活性的类吡喃结构的异构体。质子性溶剂,如乙醇和纤维素通过与槲皮素的 5-羟基形成氢键消除了槲皮素分子内氢键导致的荧光猝灭45,46。实验发现,PEI也导致槲皮素出现较强的荧光,其最大荧光发射波长在560 nm附近(图10),与槲皮素在乙醇中的发射荧光光谱相类似45,说明 PEI作为质子受体与槲皮素分子5-羟基形成氢键。
以上分析表明,槲皮素-HSA-PEI溶液中任何两个组分都可以形成复合物,因此,应该从蛋白质构象变化和 PEI的竞争结合两个因素理解 PEI对HSA-槲皮素复合物形成的影响。由于槲皮素-HSA和槲皮素-PEI复合物的特征荧光光谱相互叠加,论文对槲皮素-HSA-PEI溶液中槲皮素的荧光光谱按以下方程进行分解,
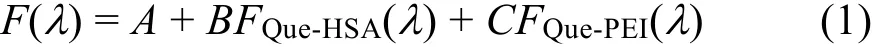
其中 FQue-HSA(λ)和 FQue-PEI(λ)为槲皮素-HSA 和槲皮素-PEI复合物的特征荧光光谱。溶液中槲皮素与HSA和PEI的结合是一个动态的平衡过程,由于试验中无法分离槲皮素-HSA和槲皮素-PEI复合物并获得其特征荧光光谱,因此实际计算中以无PEI的槲皮素-HSA溶液和含高浓度PEI25k (1.0 mg·mL−1)的槲皮素-PEI25k溶液的荧光光谱作为参考,所得参数B和C代表槲皮素-HSA-PEI溶液中槲皮素-HSA和槲皮素-PEI复合物与对照溶液中槲皮素复合物的相对浓度。参数A无明确物理意义,可能代表基线漂移、光散射等其他因素的影响。计算结果显示,上述方法可以很好拟合槲皮素-HSA-PEI溶液中槲皮素荧光光谱,相关系数均大于0.999,所得参数B和C汇总于图12。参数A值与相应溶液中槲皮素最大荧光发射强度的比值小于0.8%,可以忽略不计。
HSA与BSA结构高度相似,因此可以认为槲皮素与HSA的结合机理与BSA相同。研究表明槲皮素通过疏水相互作用结合到BSA的疏水空穴44,与ANS与BSA的相互作用机理相类似39,41。因此,可以推测,槲皮素-HSA-PEI溶液中槲皮素与HSA的结合将受到 PEI竞争结合和蛋白质内部疏水性增强两个相反因素的影响。如图12所示,随着PEI浓度的增加,槲皮素-HSA-PEI溶液中PEI-槲皮素复合物的浓度单调增加,而槲皮素-HSA复合物的浓度则表现出“S”型的变化规律,少量 PEI (浓度低于0.1 mg·mL−1)显著减少了HSA-槲皮素复合物的形成,但是其影响随着溶液中 PEI浓度的增加迅速减弱,随着溶液中PEI浓度的进一步增加,HSA对槲皮素的结合能力缓慢下降,其下降速率略有增加。这一规律与ANS-HSA-PEI溶液中ANS荧光的变化相类似(图9),不同之处在于,可能由于ANS荧光对环境疏水性变化非常敏感,PEI浓度较高的溶液中 ANS荧光明显增加(图 9),而槲皮素-HSA复合物仅表现为浓度下降速率的减缓(图 12)。
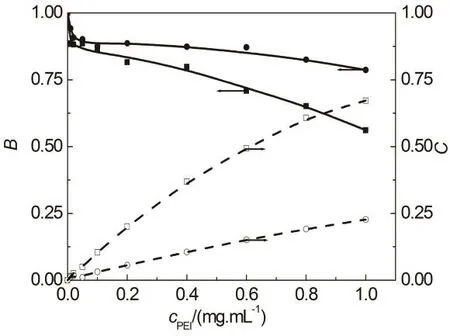
图12 槲皮素-HSA-PEI的PBS (pH 7.4)缓冲液中槲皮素荧光光谱分解拟合参数B和C随着PEI浓度的变化关系
4 结论
PEI与HSA结合形成静态复合物,在一定程度上影响了HSA的构象和结合能力。在水溶液中,PEI结合有助于HSA形成更紧密的构象,导致蛋白质分子流体动力学直径变小和分子内环境疏水性增强。相对分子量较低的PEI1.8k能引起HSA的α-螺旋结构增加,低浓度的PEI25k也有类似的作用,但是高浓度的PEI25k对HSA二级结构具有稳定作用。PEI对HSA结合能力的影响主要归因于PEI的竞争结合和PEI与HSA结合引起的蛋白质构象变化。PEI的竞争结合降低了HSA对ANS和槲皮素的结合效率,但是蛋白质的构象变化增强了HSA与ANS和槲皮素的结合能力。PEI与HSA的相互作用具有明显的分子尺寸效应,增加PEI的相对分子量可以增强对HSA构象和结合能力的影响。
Supporting Information:available free of charge via the internet at http://www.whxb.pku.edu.cn.
(1) Yin, H.; Kanasty, R. L.; Eltoukhy, A. A.; Vegas, A. J.; Dorkin, J. R.;Anderson, D. G. Nat. Rev. Genet. 2014, 15, 541. doi: 10.1038/nrg3763
(2) Giacca, M.; Zacchigna, S. J. Control. Release 2012, 161, 377.doi: 10.1016/j.jconrel.2012.04.008
(3) Tiera, M. J.; Shi, Q.; Winnik, F. M.; Fernandes, J. C. Curr. Gene Ther.2011, 11, 288.
(4) Ibraheem, D.; Elaissari, A.; Fessi, H. Int. J. Pharm. 2014, 459, 70.doi: 10.1016/j.ijpharm.2013.11.041
(5) Neu, M.; Fischer, D.; Kissel, T. J. Gene Med. 2005, 7, 992.doi: 10.1002/jgm.773
(6) Sawant, R. R.; Sriraman, S. K.; Navarro, G.; Biswas, S.; Dalvi, R. A.;Torchilin V. P. Biomaterials 2012, 33, 3942.doi: 10.1016/j.biomaterials.2011.11.088
(7) Dong, H. F.; Ding, L.; Yan, F.; Ji, H. X.; Ju, H. X. Biomaterials 2011,32, 3875. doi: 10.1016/j.biomaterials.2011.02.001
(8) Yamano, S.; Dai, J.; Hanatani, S.; Haku, K.; Yamanaka, T.; Ishioka,M.; Takayama, T.; Yuvienco, C.; Khapli, S.; Moursi, A. M.; et al.Biomaterials 2014, 35, 1705. doi: 10.1016/j.biomaterials.2013.11.012
(9) Moghimi, S. M.; Symonds, P.; Murray, J. C.; Hunter, A. C.; Debska,G.; Szewczyk, A. Mol. Ther. 2005, 11, 990.doi: 10.1016/j.mythe.2005.02.010
(10) Larsen, A. K.; Malinska, D.; Koszela-Piotrowska, I.; Parhamifar, L.;Hunter, A. C.; Moghimi, S. M. Mitochondrion 2012, 12, 162.doi: 10.1016/j.mito.2011.08.013
(11) Zhong, D.; Jiao, Y.; Zhang, Y.; Zhang, W.; Li, N.; Zuo, Q.; Wang, Q.;Xue, W.; Liu, Z. Biomaterials 2013, 34, 294.doi: 10.1016/j.biomaterials.2012.09.060
(12) Pan, T.; Xiao, Z.-D.; Huang, P.-M. J. Lumin. 2009, 129, 741.doi: 10.1016/j.jlumin.2009.02.006
(13) Kragh-Hansen, U. Pharmacol. Rev. 1981, 33(1), 17.
(14) Ghuman, J.; Zunszain, P. A.; Petitpas, I.; Bhattacharya, A. A.;Otagiri, M.; Curry, S. J. Mol. Biol. 2005, 353, 38.doi: 10.1016/j.jmb.2005.07.075
(15) Wu, J.; Zhao, C.; Hu, R.; Lin, W.; Wang, Q.; Zhao, J.; Bilinovich, S.M.; Leeper, T. C.; Li, L.; Cheung, H. M.; et al. Acta Biomater. 2014,10, 751. doi: 10.1016/j.actbio.2013.09.038
(16) Almeida, N. L.; Oliveira, C. L. P.; Torriani, I. L.; Loh, W. Colloids Surf. B 2004, 38, 67. doi: 10.1016/j.colsurfb.2004.08.004
(17) Bekale, L.; Agudelo, D.; Tajmir-Riahi, H. A. Colloids Surf. B 2015,130, 141. doi: 10.1016/ j.colsurfb.2015.03.045
(18) Xiao, F.; Gu, M.; Liang, Y.; Li, L.; Luo, Y. Spectrochim. Acta Part A 2014, 118, 1106. doi: 10.1016/j.saa.2013.09.074
(19) Bekale, L.; Agudelo, D.; Tajmir-Riahi, H. A. Colloids Surf. B 2015,125, 309. doi: 10.1016/j.colsurfb.2014.11.037
(20) Sekowski, S.; Buczkowski, A.; Palecz, B.; Gabryelak, T. Spectrochim.Acta Part A 2011, 81, 706. doi: 10.1016/j.saa.2011.07.009
(21) Haouz, A.; El Mohsni, S.; Zentz, C.; Merola, F.; Alpert, B. Eur. J.Biochem. 1999, 264, 250. doi: 10.1046/j.1432-1327.1999.00628.x
(22) Beaven, G. H.; Holiday, E. R. Adv. Protein Chem. 1952, 7, 319.doi:10.1016/S0065-3233(08)60022-4
(23) Rosenheck, K.; Doty, P. Proc. Natl. Acad. Sci. USA 1961, 47 (11),1775. doi:10.1073/pnas.47.11.1775
(24) Donovan, J. W. J. Biol. Chem. 1969, 244, 1961.
(25) Mazzaferro, L.; Breccia, J. D.; Andersson, M. M.; Hitzmann, B.;Hatti-Kaul, R. Int. J. Biol. Macromol. 2010, 47, 15.doi: 10.1016/j.ijbiomac.2010.04.003
(26) Yasuhara, K.; Tsukamoto, M.; Tsuji, Y.; Kikuchi, J. Colloids Surf. A 2012, 415, 460. doi: 10.1016/j.colsurfa.2012.01.024
(27) Sabín, J.; Vázquez-Vázquez, C.; Prieto, G.; Bordi, F.; Sarmiento, F.Langmuir 2012, 28, 10534. doi:10.1021/la3019259
(28) Nguyen, T. T.; Shklovskii, B. I. Phys. A 2001, 293, 324.doi: 10.1016/S0378-4371(01)00020-6
(29) Nguyen, T. T.; Shklovskii, B. I. J. Chem. Phys. 2001, 114, 5905.doi: 10.1063/1.1355289
(30) Pfau, A.; Schrepp, W.; Horn, D. Langmuir 1999, 15, 3219.doi: 10.1021/la9808925
(31) Andersson, M. M.; Hatti-Kaul, R. J. Phys. Chem. B 2000, 104, 3660.doi: 10.1021/jp993506g
(32) Lakowicz, J. R. Principles of Fluorescence Spectroscopy, 2nd ed.;Plenum Press: New York, NY, USA, 1999; pp. 185–486.
(33) Burstein, E. A.; Vedenkina, N. S.; Ivkova, M. N. Photochem.Photobiol. 1973, 18, 263.
(34) Carter, D. C.; Ho, J. X. Adv. Protein Chem. 1994, 45, 153.doi: 10.1016/0162-0134(94)85112-3
(35) He, X. M.; Carter, C. D. Nature 1992, 358, 209.doi: 10.1038/358209a0
(36) Johnson, W. C. Ann. Rev. Biophys. Biophys. Chem. 1988, 17, 145.
(37) Brahms, S.; Brahms, J.; Spach, G.; Brack, A. Proc. Natl. Acad. Sci.USA 1977, 74 (8), 3208. doi: 10.1073/pnas.74.8.3208
(38) Seedher, N.; Agarwal, P. J. Lumin. 2010, 130, 1841.doi: 10.1016/j.jlumin.2010.04.020
(39) Daniel, E.; Weber, G. Biochemistry 1966, 5, 1893.doi: 10.1021/bi00870a016
(40) Gasymov, O. K.; Glasgow, B. J. Biochim. Biophys. Acta 2007, 1774,403. doi: 10.1016/j.bbapap.2007.01.002
(41) Kuznetsova, I. M.; Sulatskaya, A. I.; Povarova, O. I.; Turoverov, K. K.PLoS ONE 2012, 7 (7), e40845. doi: 10.1371/journal.pone.0040845
(42) Dufour, C.; Dangles, O. Biochim. Biophys. Acta 2005, 1721, 164.doi: 10.1016/j.bbagen.2004.10.013
(43) Wolfbeis, O. S.; Begum, M.; Geiger, H. Z. Naturforsch. 1984, 39b,231. doi: 0.1515/znb-1984-0219
(44) Dangles, O.; Dufour, C.; Bret, S. J. Chem. Soc., Perkin Trans. 2 1999,737. doi: 10.1039/a810017i
(45) Falkovskaia, E.; Sengupta, P. K.; Kasha, M. Chem. Phys. Lett. 1998,297, 109. doi: 10.1016/S0009-2614(98)01112-9
(46) Sengupta, P. K.; Kasha, M. Chem. Phys. Lett. 1979, 68 (2–3), 382.doi: 10.1016/0009-2614(79)87221-8
