乌贼墨汁黑色素对糖尿病肾病小鼠肾脏的保护作用
2018-03-20徐洋洋王春琳宋微微母昌考李荣华
董 慧,徐洋洋,王春琳,2,宋微微,2,*,母昌考,2,李荣华,2
(1.宁波大学 应用海洋生物技术教育部重点实验室,浙江 宁波 315211;2.宁波大学 浙江海洋高效健康养殖协同创新中心,浙江 宁波 315211)
糖尿病肾病作为糖尿病最常见的并发症,是导致终末期肾衰竭常见病因[1-2]。糖尿病肾病发病早期出现微量蛋白尿,不及时治疗会发展到临床蛋白尿期,表现为肾小球肥大、滤过能力减弱,出现蛋白尿,最终导致不可逆转的肾衰竭,快速进入尿毒症期[3-4]。目前,对糖尿病肾病的发病机制未能完全明确,已知的主要是通过多元醇通路、氧化应激的加速、血管活性物质及促进肾组织纤维化的细胞因子(转化生长因子(transforming growth factor β,TGF-β)和结缔组织生长因子(connection tissue growth factor,CTGF))的激活、长期高血糖状态发生非酶途径产生过量的晚期糖基化终末产物(advanced glycation end products,AGE)、蛋白酶C的激活、激肽释放酶-激肽系统作用等途径,它们之间的相互作用也会加速糖尿病肾病的产生[5]。现行的治疗策略主要是饮食疗法和药物疗法,饮食疗法见效慢,具有限制性;药物干预法中,西药虽见效快,但容易造成低血糖、乳酸中毒等副作用,中药制剂虽然副作用小但服用量较大,较难为患者接受[6]。因此,开发有效治疗糖尿病肾病发生、发展的安全有效药物成为炙手可热的研究。海洋作为一个开放复杂的系统,孕育着丰富的动植物和微生物,它们的成分与陆地生物不同,富含化学结构特异的高效活性物质。目前,从海洋生物如刺参中提取的岩藻聚糖硫酸酯[7]和文蛤中的极性提取物均能够调控糖尿病小鼠的高血糖症状[8],另外还有研究表明,从多管藻中提取的总酚[9]和海参虫草复剂等海洋活性物质都能够通过修复糖尿病模型小鼠胰岛β细胞损伤和降低氧化酶活性的途径,控制糖尿病小鼠空腹血糖浓度[10]。因此,有效开发海洋生物活性物质,成为了当今的热潮。
乌贼墨汁是由直径为120~180 nm的黑色素颗粒形成的黑色悬浊液,在乌贼加工过程中一直被视为废弃物,中医中把它作为一种止血剂使用,墨汁约为乌贼总体质量的1.28%,其主要成分为黑色素,是开发保健黑色素产品的价廉质高的原料[11]。乌贼墨汁黑色素(melanin extracted from cuttlefish ink sacs,MECIS)属于真黑色素,它是由吲哚单体5,6-二羟基吲哚和5,6-二羟基吲哚-2羧酸组成[12-13],在长期高糖环境下容易失去2 个电子而发生氧化还原反应,从某些途径有效地拮抗高糖并发症的侵害[14]。在对头足类黑色素资源开发过程中,已陆续证明黑色素可参与许多生理、病理活动[15],如抗炎[16]、抗肿瘤、抗紫外辐射[17]、抗脂质过氧化、清除自由基[18]、增强免疫功能[19-20]和DNA光保护作用。雷敏[21]研究发现,鱿鱼墨汁黑色素能够对实验性高脂血症小鼠脂代谢紊乱起调节作用。本实验室先前研究发现,曼氏无针乌贼墨汁黑色素能够很好地清除D-半乳糖所致的衰老模型小鼠体内积累的过氧化物以及自由基,起到很好的抗氧化作用[22];另外,曼氏无针乌贼墨汁黑色素能缓解免疫低下模型小鼠的炎症反应,降低糖基化模型小鼠体内的AGEs及其受体水平。基于已有的研究,本实验以链脲佐菌素(streptozocin,STZ)诱导的糖尿病模型小鼠以其自然病程发展成的肾病模型[23]为研究对象,主要从乌贼墨汁黑色素是否调控高糖引起的氧化应激和降低糖尿病肾病组织纤维化复杂的网络细胞核心因子表达量2 条研究途径出发,评价乌贼墨汁黑色素能否对糖尿病肾病模型小鼠病情起到缓解作用,为开发乌贼墨汁黑色素的药用价值提供理论参考。
1 材料与方法
1.1 材料与试剂
健康ICR品系雄性小鼠70 只,体质量(20.8±3.6)g,由浙江省动物中心提供,合格证号:SCXK(浙)2014-0001;冰冻乌贼25 kg(平均每只体质量(560.8±18.6)g)购于宁波市路林市场,剖开取墨囊,放入-80 ℃冰箱保存。
STZ 美国Sigma公司;碱性蛋白酶 北京索莱宝科技有限公司;盐酸二甲双胍片 中美上海施贵宝制药有限公司;超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malonaldehyde,MDA)、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒 南京建成生物工程研究所;Trizol试剂 美国Invitrogen公司;Trans实时荧光聚合酶链式反应(real time polymerase chain reaction,RT-PCR)试剂盒、Trans Start®Top Green定量PCR(quantitative PCR,qPCR)预混液 北京全式金生物有限公司;高尔宝尿八联试纸 广州市花都高尔宝生物技术有限公司。
1.2 仪器与设备
贝克曼库尔特AU5800血液自动生化分析仪 美国Beckman Coulter公司;尼康E200照相显微镜 南京兆坤仪器有限公司;FreeZone4.5台式冷冻干燥机 美国Labconco公司;Spectra max190酶标仪 美国Molecular Devices公司;强生稳择易血糖仪及配套血糖试纸 强生(中国)医疗器材有限公司;Eppendorf RT-qPCR仪 宁波欧普仪器有限公司。
1.3 方法
1.3.1 乌贼墨汁黑色素的提取
常温下解冻冰冻的乌贼墨囊,采用先前研究的酶法提纯获取高浓度乌贼墨汁黑色素[11,24]。具体步骤为:挤压冲洗乌贼墨囊获得墨汁→3 层纱布过滤→重复2 次离心(8 000 r/min、10 min)→冷冻干燥获黑色素粗品→碱性蛋白酶精提黑色素(2%的粗品黑色素和1.5%的碱性蛋白酶在pH 10.3、温度50 ℃条件下酶解4~5 h)→酶解产物离心6 次(6 000 r/min、10 min)→冷冻干燥获得高纯度黑色素。
1.3.2 糖尿病肾病模型小鼠的制备及分组
糖尿病肾病模型小鼠的制备:同批次70 只小鼠暂养4 周后,随机选10 只作为正常组,其余小鼠禁食不禁水12 h,连续2 d进行腹腔注射STZ溶液(剂量为45 mg/kg(以体质量计,下同),用pH 4.2的0.1 mol/L柠檬酸-柠檬酸钠缓冲液在冰浴中新鲜配制),正常组注射等体积的柠檬酸-柠檬酸钠缓冲液。为了防止小鼠休克,在注射STZ之前给小鼠灌胃10%的葡萄糖溶液。72 h后对造模小鼠禁食不禁水12 h,剪尾采血后用血糖仪测定空腹血糖,以血糖值高于11.1 mmol/L者作为建模成功小鼠[25]。
糖尿病肾病模型小鼠分组及灌胃:选取造模成功的小鼠50 只,随机分为糖尿病肾病模型组、阳性治疗组、乌贼墨汁黑色素低、中、高剂量组(120、240、480 mg/kg),每组10 只,分笼暂养1 周后进行灌胃,模型组和阳性治疗组小鼠分别灌胃生理盐水和盐酸二甲双胍溶液(120 mg/kg),其余3 组按以上剂量灌胃乌贼墨汁黑色素悬浊液。灌胃体积为10 mL/kg,每日1 次,连续灌胃4 周,期间小鼠自由进食、饮水,观察并记录小鼠基本生长情况。4 周后使用尿糖试纸测定各组小鼠尿糖浓度及尿蛋白水平(定性测定)。
1.3.3 指标测定
1.3.3.1 肾脏指数及肾功能指标
最后1 次给药后,对小鼠进行禁食不禁水5 h,乙醚麻醉处理,称量小鼠体质量,眼球取血500 μL,3 500 r/min离心15 min,取上清液,上清液采用血液自动生化分析仪检测,以肌酐和尿素氮水平为指标判断各组小鼠肾功能。
迅速剥离双肾,生理盐水清洗,滤纸吸干,肉眼观察肾脏表面形态,剥离外包膜后称双肾质量。肾脏指数按照下式计算。
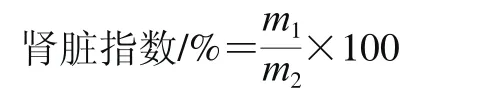
式中:m1为小鼠双肾总质量/g;m2为小鼠体质量/g。
1.3.3.2 肾脏组织学观察
迅速剥离各组小鼠双肾后留取部分右肾组织置于配制好的波恩氏液中固定24 h,然后经脱水、透明、常规石蜡包埋并以5 µm厚度连续切片、苏木精-伊红(hematoxylineosin,HE)染色后,于显微镜下观察并拍照。
1.3.3.3 肾组织相关抗氧化酶活力测定
同1.3.3.1节操作方法。剪一小块肾脏,按照为1∶9(m/V)的比例加入生理盐水,用组织匀浆机冰上匀浆后2 500 r/min离心10 min,取上清液,即10%的组织匀浆备用。测定小鼠肾脏的SOD、CAT、GSH-Px的活力及MDA含量。操作步骤严格遵从试剂盒说明书。
1.3.3.4 RT-PCR检测肾组织促纤维化细胞因子mRNA的表达量
取各组新鲜的肾组织,Trizol法提取总RNA,并测定总RNA提取质量。参照Trans反转录试剂盒合成cDNA,随后将反转后的cDNA按照说明书的量加入到含SYBR Green的RT-PCR反应体系中,采用实时荧光定量PCR仪进行记录和分析。与内参基因β-actin标化后,以2-ΔΔCT值表示各目的基因,即与诱导糖尿病肾病相关的4 个转化因子,分别为TGF-β及其Ⅱ型受体(TGF type Ⅱ receptor,TβRⅡ)、CTGF和参与抗炎症因子的过氧化酶体增殖物活化受体(peroxisome proliferator activated receptor γ,PPAR-γ)的表达量。PCR反应条件为:94 ℃预变性5 min,94 ℃变性45 s,退火30 s,72 ℃延伸45 s,最后72 ℃延伸10 min,不同基因的引物序列、产物长度、退火温度和循环数见表1。

表 1TGF-β、TβRII、CTGF、PPAR-γ和β-actin的引物序列、产物长度、退火温度和循环数Table1 Primer sequences, product lengths, annealing temperatures and cycles for PCR analysis ofTGF-β, TβRII, CTGF,PPAR-γ and β-actin
1.4 数据分析
采用SPSS 13.0统计学软件进行分析,数据用平均值±标准差表示,采用单因素方差分析(one-way analysis of variance,ANOVA)和Duncan test检验方法进行组间比较,其中P<0.05表示差异显著;P<0.01表示差异极显著。
2 结果与分析
2.1 不同处理组小鼠的生长情况
诱导糖尿病肾病小鼠模型成功后,与正常组相比,其余各组小鼠逐渐出现毛色枯黄无光泽、精神萎靡、脱毛严重、体质量减轻,并出现多饮、多食、多尿、脚部明显脱皮,眼球发红等表观现象,灌胃黑色素的小鼠上述状况明显改善,且尿糖症状减轻(表2)。
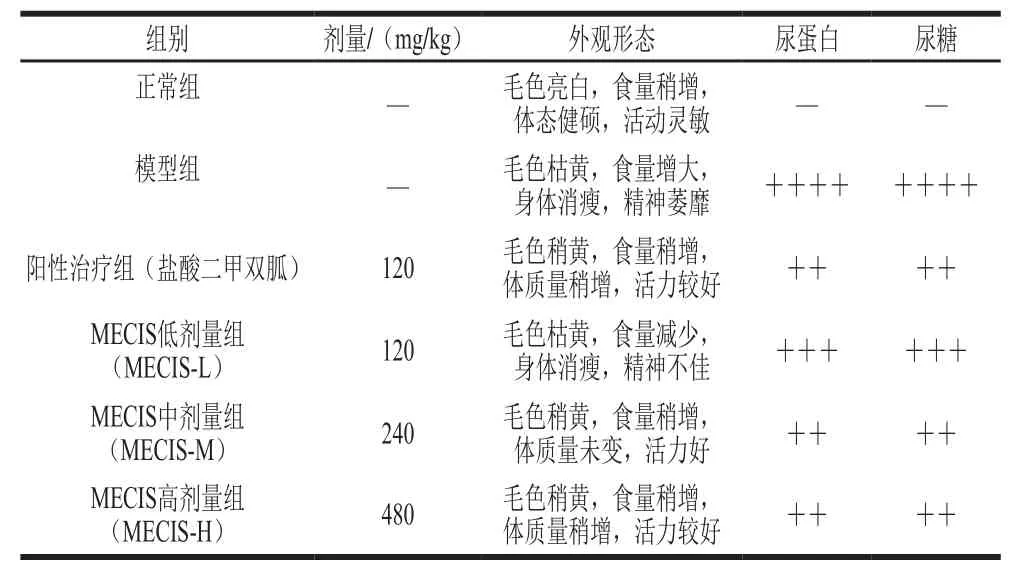
表2 各组小鼠生长状况及尿糖、尿蛋白测定结果(n=10)Table2 Growth status, urine sugar and urinary protein in mice from all groups (n= 10)
2.2 乌贼墨汁黑色素对不同处理组小鼠肾脏指数和肾功能的影响
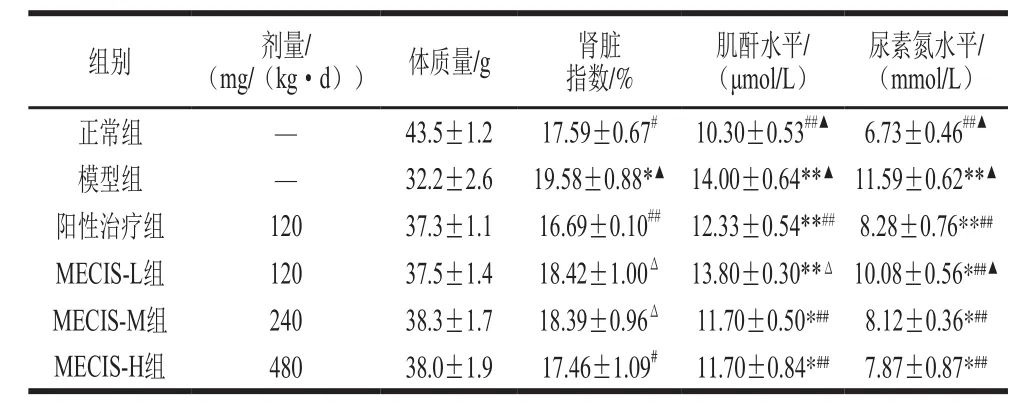
表3 乌贼墨汁黑色素对小鼠肾脏指数和肾功能的影响(n=10)Table3 Effect of melanin extracted from cuttle fish ink sacs on kidney index and kidney function (n= 10)
由表3可知,连续灌胃4周后,与正常组相比,糖尿病肾病模型组小鼠的肾脏指数显著升高(P<0.05),阳性治疗组(盐酸二甲双胍组)和乌贼墨汁黑色素处理组无差异;与模型组相比,阳性治疗组(盐酸二甲双胍组)和黑色素高剂量组的肾脏指数显著降低(P<0.01、P<0.05),黑色素低、中剂量组分别降低了6.0%、6.1%;与阳性对照组相比,黑色素高剂量组差异不显著(P>0.05),黑色素低、中剂量组肾脏指数显著升高(P<0.05)。结果表明,乌贼墨汁黑色素能缓解糖尿病肾病模型小鼠肾脏肿胀。
肌酐和尿素氮指标可间接反映肾脏的损伤程度。由表3可知,与模型组相比,阳性治疗组和黑色素处理组中、高剂量组肌酐水平极显著降低(P<0.01),虽然黑色素低剂量组与模型组相比,肌酐水平有所降低,但不存在显著差异;与阳性治疗组相比,黑色素中、高剂量组肌酐水平差异不显著(P>0.05)。与模型组相比,阳性治疗组、3个黑色素处理组的尿素氮水平极显著降低(P<0.01),但与正常组相比差异显著(P<0.05、P<0.01);与阳性治疗组相比,而黑色素中、高剂量组的尿素氮水平不存在统计学差异(P>0.05),但低剂量组差异极显著(P<0.01)。因此,结果表明乌贼墨汁黑色素能够对肾功能损伤起到修复作用,且高剂量组的效果最佳。
2.3 乌贼墨汁黑色素对小鼠肾脏组织结构的影响
通过HE染色,光学显微镜下400倍观察结果如图1所示。正常组小鼠(图1A)肾小球外形规则饱满,肾小球血管球充盈,肾间质清晰可见,细胞核形状圆润且排列规则,肾小囊边界清晰;糖尿病肾病模型组(图1B)肾小体血管球体积肥大,形状不规则且排列杂乱无章,内部充斥着大量细胞炎症因子,肾间质的纤维化程度高,细胞核形状亦变为椭圆形,细胞核表现为空核,肾小囊腔变窄,基质沉淀明显增加;灌胃高剂量黑色素后(图1C),肾小体血管球形状有所改善,稍微规则,炎症因子减少,肾间质纤维化程度降低,细胞核形状也恢复接近正常,内容物充盈,缓解了肾小球肥大和基质沉淀。
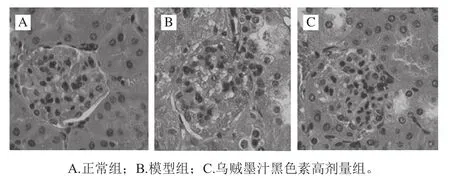
图1 乌贼墨汁黑色素对糖尿病肾病小鼠肾脏组织形态的影响(400×)Fig.1 Effect of melanin extracted from cuttlef i sh ink sacs on renal histology of diabetic mice (400 ×)
2.4 乌贼墨汁黑色素对各组小鼠肾组织相关氧化酶活力的影响
通过对各组小鼠肾组织SOD、CAT、GSH-Px活力及MDA含量测定分析乌贼墨汁黑色素对模型小鼠肾脏抗氧化酶指标的影响,结果如表4所示,与模型组相比,阳性治疗组和乌贼墨汁黑色素中、高剂量组的SOD活力相比极显著升高(P<0.05、P<0.01),黑色素低剂量处理组虽然升高了12.3%,但差异不显著(P>0.05);与正常组相比,阳性治疗组、黑色素中、高剂量组小鼠的肾SOD活力无显著性差异(P>0.05),模型组和低剂量组的SOD活力差异显著;与阳性治疗组相比,黑色素低、中剂量组的SOD活力无显著差异(P>0.05),而高剂量组却存在显著性差异(P<0.05)。结果表明,乌贼墨汁黑色素可明显提高糖尿病肾病模型小鼠的SOD活力。
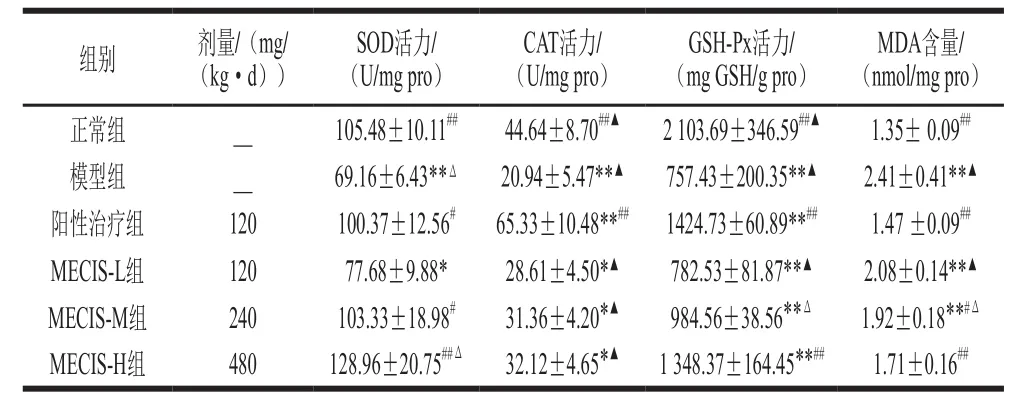
表4 乌贼墨汁黑色素对糖尿病肾病模型小鼠相关氧化酶活力的影响(n= 10)Table4 Effect of melanin extracted from cuttle fish ink sacs on antioxidant enzyme activities in kidney (n= 10)
与模型组相比,3个乌贼墨汁黑色素剂量组的CAT活力升高但不显著(P>0.05);与正常组相比,3个黑色素剂量组的CAT活力显著下降(P<0.05);与阳性治疗组相比,3个黑色素剂量组的CAT活力极显著下降(P<0.01)。因此可推断,乌贼墨汁黑色素能够提高糖尿病肾病模型小鼠的CAT活力,但仍达不到正常组水平。
与模型组相比,阳性治疗组和乌贼墨汁黑色素高剂量组小鼠肾脏的GSH-Px活力升高,差异极显著(P<0.01),而黑色素低、中剂量组活力也有所升高,但差异不显著(P>0.05);与正常组相比,阳性治疗组和3个黑色素剂量组的GSH-Px活力虽然有所升高,但差异极显著(P<0.01)。
阳性治疗组和黑色素中、高剂量组的MDA含量与模型组相比显著降低(P<0.05、P<0.01),而黑色素低剂量组差异不显著(P>0.05);与正常组相比,阳性治疗组和黑色素高剂量组的MDA含量基本上已达到正常组水平,差异不显著(P>0.05),而黑色素低、中剂量组与正常组相比,MDA含量极显著升高(P<0.01)。结果表明,乌贼墨汁黑色素中、高剂量组对糖尿病肾病模型小鼠起到很好的抗脂质氧化作用。
2.5 各组小鼠肾皮质中促纤维化炎症细胞因子mRNA的表达情况
为进一步研究乌贼墨汁黑色素对糖尿病肾病模型小鼠肾脏保护作用的机理,实验分析了肾皮质中转化因子及受体、促纤维化炎症的细胞因子和抗炎、抗增生转录因子的表达情况。
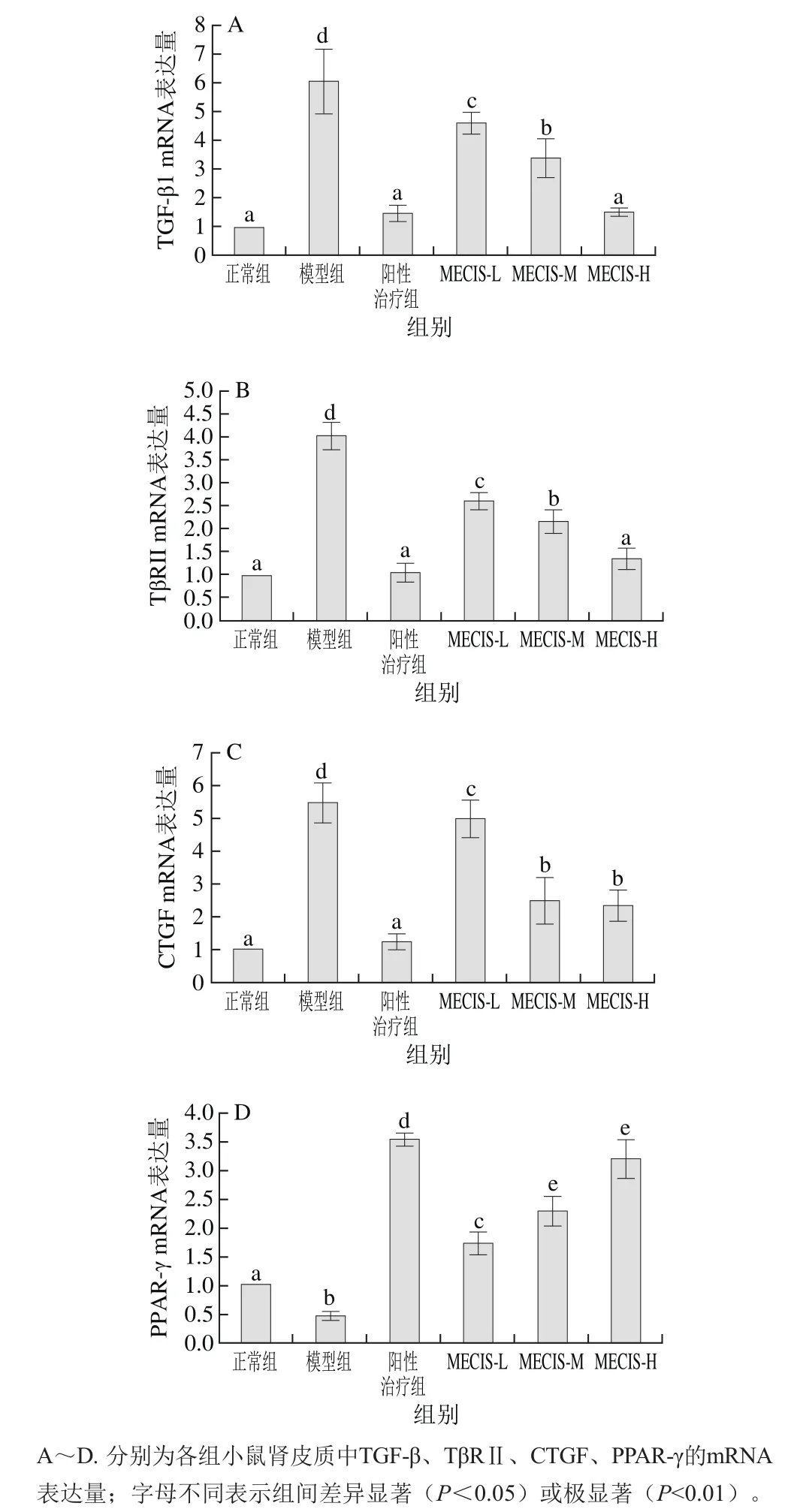
图2 各处理组小鼠肾皮质中促纤维化细胞因子mRNA的表达量Fig.2 mRNA expression levels of renal fibrogenic cytokines in mice from all groups
由图2A和图2B可知,阳性治疗组和乌贼墨汁黑色素高剂量组的小鼠肾皮质TGF-β及其受体TβRⅡ的mRNA表达量与模型组相比极显著降低(P<0.01),与正常组相比不存在显著性差异(P>0.05),已经达到了正常水平;虽然黑色素低、中处理组的二者的mRNA表达量有所降低,但与模型组和正常组相比均差异显著(P<0.05)。
由图2C和图2D可知,模型组小鼠肾脏固有细胞的促纤维化因子CTGF的mRNA表达量和正常组相比上调了大约4.5 倍,经乌贼墨汁黑色素干预后,中、高剂量组分别下调了54.1%、57.2%,与模型组相比具有极显著差异(P<0.01),黑色素低剂量组虽然有所下调,但与模型组相比无显著性差异(P>0.05)。与模型组相比,在乌贼墨汁黑色素的干预下,低、中、高剂量组小鼠肾皮质的PPAR-γ mRNA表达量分别上调了2.6、3.9、5.8 倍,与模型组相比具有极显著差异(P<0.01)。
3 讨 论
本研究从不同水平分析了乌贼墨汁黑色素对糖尿病肾病的保护作用。研究发现,机体长期处于高糖环境会引发肾脏肿胀、肾小球基质纤维化程度加重,导致肾小球滤过功能减弱,出现严重的蛋白尿和尿糖症状[4]。实验发现经乌贼墨汁黑色素3个剂量组干预后,糖尿病肾病小鼠的肾脏指数显著性降低,肾脏肿胀减轻,肾脏功能基本恢复;肾脏组织切片观察发现,肾小球系膜区细胞外基质纤维化积聚程度变弱,细胞核内容物充盈,肾小球形态恢复正常,尿糖和尿蛋白程度减轻,且黑色素高剂量组效果最为显著。
机体在正常状况下,自由基在体内动态平衡状态的维持主要依赖于自身完整的抗氧化酶系统。SOD与其他抗氧化酶如CAT、GSH-Px都属于体内抗氧化酶防御系统,SOD可以将体内的转化为H2O2,最终由CAT转化为H2O;GSH-Px和CAT是动物体内重要的抗氧化酶,也可把H2O2还原为水,MDA是生物膜中多不饱和脂肪酸受到自由基攻击后发生脂质过氧化作用所形成过氧化物的最终分解产物,能够直接反映脂质过氧化程度,间接反映机体受自由基损伤的程度[26]。已有的研究发现,机体在持续高糖环境下,线粒体呼吸链中活性氧自由基(活性氧簇)生成过多,自由基超过了机体的清除能力,平衡状态被破坏,就会处于氧化应激状态,从而引起机体损伤,导致抗氧化酶系统紊乱,持续氧化状态下,会致使糖尿病患者引发糖基化终末产物堆积,进而诱发各种糖尿病并发症[27]。肾脏是对氧化应激损伤敏感的器官,长期氧化应激刺激下,肾组织细胞正常清除自由基的能力被逐渐破坏,导致肾功能衰竭。本实验结果显示,模型组小鼠肾皮质中SOD、CAT和GSH-Px组成的抗氧化体系酶活力降低,肾皮质中脂质过氧化物的终产物MDA含量显著升高,而使用乌贼墨汁黑色素3 个剂量灌胃4周后,小鼠肾皮质中SOD、CAT、GSH-Px活力极显著升高,抗氧化应激能力增强,但仍与正常水平存在一定的差异;MDA含量较模型组显著降低。总体来看,黑色素处理组小鼠的抗氧化能力增强,有效抑制了脂质过氧化物和糖基化终末产物的堆积,较好地缓解了糖尿病肾病的进一步发展。
肾组织中复杂的细胞网络因子的变化关系到糖尿病肾病的发生和发展。TGF-β是调控肾脏组织纤维化的细胞因子,主导糖尿病肾病的肾小球硬化、系膜基质堆积,其基因的高表达能够导致肾间质的纤维化[28]。本实验研究发现,糖尿病肾病模型组肾皮质TGF-β mRNA的表达水平明显高于正常组;Iwano等[29]研究发现机体长时间处于高血糖状态下TGF-β mRNA的表达水平升高,这与本实验结果相同,说明实验模型诱导成功,同时组织学结果也同样验证了这一结论。TβRⅡ是TGF-β的活性受体,能够与TGF-β结合,促进细胞外基质合成、抑制其降解,导致细胞膜外基质堆积[30]。
本实验结果发现,糖尿病肾病模型组小鼠经乌贼墨汁黑色素3 个剂量干预4 周后,肾脏中的TGF-β mRNA表达水平明显降低,其受体TβRⅡ的表达量和TGF-β mRNA的降低具有很强的一致性。有研究证实,CTGF是TGF-β的下游调节因子,肾小球系膜细胞的TGF-β能够调控CTGF mRNA的表达量[31],而当CTGF mRNA低表达时,糖尿病肾病小鼠的肾小球细胞外基质积聚以及肾脏的纤维化程度均会得到明显改善[32];高表达时,可加强介导肾组织中TGF-β的促纤维化作用及系膜外基质的增生积聚。
本实验结果还发现,经乌贼墨汁黑色素3 个剂量组干预的糖尿病肾病小鼠,CTGF mRNA的表达量与模型组相比显著降低,和TGF-β mRNA的表达量也具有一致性,因此,模型小鼠肾组织的纤维化积聚得到缓解。PPAR-γ是一类配体激活的活受体,是核转录因子家族中的一员,可通过调节血脂平衡、炎症反应等影响血管平滑肌细胞增生的作用,密切参与糖尿病肾病的发生和发展。有研究表明,在糖尿病肾病的进程中PPAR-γ能够阻遏TGF-β/Smad(drosophila mothers against decapentaplegic)信号通路中TGF-β的上调,抑制TGF-β的活性,且能够明显抑制肾小球系膜外基质增生和纤维化的增加[33]。3 个乌贼墨汁黑色素处理组小鼠的PPAR-γ mRNA均高表达,且高剂量组效果最显著,与之前研究[33]相一致。由此可推断,乌贼墨汁黑色素是通过上调PPAR-γ的mRNA表达来抑制TGF-β的活性,进而影响其受体TβRⅡ和下游调节因子CTGF mRNA的表达,从而改善肾脏的结构病变,对肾脏起到保护作用。
综上所述,乌贼墨汁黑色素能够通过改善肾组织的氧化应激,保护高糖下敏感的肾组织;通过介导PPAR-γ/TGF-β代谢通路,缓解肾脏组织形态的病变,修复肾小球因炎症产生的形变,减轻肾基质间纤维化积聚程度,从而增强了肾功能,导致尿糖和尿蛋白程度减轻,进一步改善了肾功能。另外,本实验还发现,乌贼墨汁黑色素中、高剂量对糖尿病肾病能起到更好的控制作用。鉴于引发糖尿病肾病的途径还有很多,另外,处于不同分期的病症发病机制各异,还需进一步探究,为辅助治疗糖尿病开发出安全有效、机制清楚的天然保健食品带来新思路。
[1] 李惠秀, 曹文富. 糖尿病肾病发病机制及治疗进展[J]. 重庆医学,2013, 42(21): 2545-2547; 2568.
[2] AL-RUBEAAN K, YOUSSEF A M, SUBHANI S N, et al. Diabetic nephropathy and its risk factors in a society with a type 2 diabetes epidemic: a saudi national diabetes registry-based study[J]. PLoS ONE, 2015, 9(2): 1-8. DOI:10.1111/aos.12532.
[3] NAJAFIAN B, ALPERS C E, FOGO A B. Pathology of human diabetic nephropathy[J]. Contributions to Nephrology, 2011, 170:36-47. DOI:10.1159/000324942.
[4] 王珊珊, 马畅, 张伟, 等. 血管紧张素转化酶2(ACE2)在糖尿病大鼠肾损伤中的作用及机制分析[J]. 食品科学, 2013, 34(9): 287-291.DOI:10.7506/spkx1002-6630-201309058.
[5] 李敏州, 高彦彬, 马鸣飞, 等. 糖尿病肾病发病机制研究进展[J]. 中国实验方剂学杂志, 2012, 18(22): 344-348.
[6] 马长云. 2型糖尿病治疗方法研究进展[J]. 中国误诊学杂志, 2011,11(9): 2029-2030.
[7] 张珣. 不同种类海参岩藻聚糖硫酸酯降血糖作用及抗肿瘤活性的比较研究[D]. 青岛: 中国海洋大学, 2012: 15-20.
[8] 严晓丹, 钱建瑛, 许泓瑜, 等. 文蛤不同极性提取物对糖尿病小鼠降血糖作用的研究[J]. 中国海洋药物, 2015, 34(5): 71-76.DOI:10.13400/j.cnki.cjmd.2015.05.012.
[9] 柳全文, 张婷, 刘珂, 等. 多管藻总酚降血糖作用实验研究[J]. 中草药,2007, 38(3): 415-418.
[10] 李晓林. 海参虫草复剂对糖尿病大鼠肾脏保护作用及其机制的研究[D]. 青岛: 中国海洋大学, 2010: 18-20.
[11] 周月越, 王春琳, 母昌考, 等. 曼氏无针乌贼墨汁黑色素的提取工艺[J]. 生物学杂志, 2015, 32(2): 28-32. DOI:10.3969/j.issn.2095-1736.2015.02.028.
[12] MAGARELLI M, PASSAMONTI P, RENIERI C. Purification,characterization and analysis of sepia melanin from commercial sepia ink (Sepia officinalis)[J]. Revista Ces Medicina Veterinaria Y Zootecnia, 2010, 5: 18-28.
[13] SZPOGANICZ B, GIDANIAN S, KONG P, et al. Metal binding by melanins: studies of colloidal dihydroxyindole-melanin, and its complexation by Cu(II) and Zn(II) ions[J]. Journal of Inorganic Biochemistry, 2002, 89(1/2): 45-53. DOI:10.1016/S0162-0134(01)00406-8.
[14] 王光, 刘华忠, 吴金龙, 等. 乌贼墨提取物对氧化性损伤小鼠心肌与脑组织的保护作用研究[J]. 中国现代应用药学, 2010, 27(2):95-99. DOI:10.13748/j.cnki.issn1007-7693.2010.02.007.
[15] 宋珅, 丁安伟. 乌贼墨化学成分和药理作用研究概况[J]. 时珍国医国药, 2001, 12(4): 377-378.
[16] 王群, 吕昌龙, 吕超, 等. 乌贼墨诱生小鼠IFN-γ及调节LAK细胞活性的研究[J]. 中国海洋药物, 2001, 79(1): 37-39.
[17] TAKAYA Y, UCHISAWA H, MATSUE H, et al. An investigation of the antitumor peptidogly:an fraction from squid ink[J]. Biological and Pharmaceutical Bulletin, 1994, 17(6): 846-849.
[18] LIU H Z, LUO P, CHEN S H, et al. Effects of squid ink on growth performance, antioxidant functions and immunityin growing broiler chickens[J]. Asian Australasian Journal of Animal Sciences, 2011,24(12): 1752-1756. DOI:10.5713/ajas.2011.11128.
[19] 雷敏, 赵梦醒, 刘淇. 鱿鱼墨黑色素的免疫调节作用[J]. 食品工业科技, 2012, 33(6): 397-400.
[20] 董慧, 王力东, 王春琳, 等. 曼氏无针乌贼墨汁黑色素对免疫低下模型小鼠的调节作用[J]. 生物学杂志, 2016, 33(5): 27-30.DOI:10.3969/j.issn.2095-1736.
[21] 雷敏. 鱿鱼墨黑色素及黑色素铁生物活性的研究[D]. 青岛: 中国海洋大学, 2008: 32-41.
[22] 周月越, 王力东, 杜美凤, 等. 曼氏无针乌贼墨汁黑色素对亚急性衰老模型小鼠抗氧化功能的影响[J]. 天然产物研究与开发, 2015,27(9): 1663-1667; 1588. DOI:10.16333/j.1001-6880.
[23] FORBES J M, COOPER M E, THALLAS V, et al. Reduction of the accumulation of advanced glycation end products by ACE inhibition in experimental diabetic nephropathy[J]. Diabetes, 2002, 51(11):3274-3282. DOI:10.2337/diabetes.51.11.3274.
[24] 李晓, 李和生. 酶法提取金乌贼墨汁中黑色素的工艺条件研究[J]. 天然产物研究与开发, 2010, 22(1): 159-162; 166. DOI:10.16333/j.1001-6880.
[25] 栾畅, 王宏伟, 何忠梅, 等. 植物乳杆菌Sc52联合牛蒡低聚果糖对2型糖尿病模型小鼠的治疗作用[J]. 食品科学, 2015, 36(21): 214-220.DOI:10.7506/spkx1002-6630-201521040.
[26] 张双凤, 苏亚儒, 李巨秀. 膳食中晚期糖基化终产物对大鼠肾脏的影响[J]. 食品科学, 2013, 34(21): 315-320. DOI:10.7506/spkx1002-6630-201321063.
[27] ABE M, MARUYAMA N, OKADA K, et al. Effects of lipid lowering therapy with rosuvastatin on kidney function and oxidative stress in patients with diabetic nephropathy[J]. Atheroscler Thromb, 2011,18(11): 1018-1028. DOI:10.5551/jat.9084.
[28] ZHENG H T, WHITMAN S A, WU W, et al. Therapeutic potential of Nrf2 activators in streptozotocin induced diabetic nephropathy[J].Diabetes, 2011, 60(11): 3055-3066. DOI:10.2337/db11-0807.
[29] IWANO M, KNBO A, NISHINO T, et al. Quantif i cation of glomerular TGF-β1mRNA in patients with diabetes mallitus[J]. Kidney International, 1996, 49: 1120-1126. DOI:10.1038/ki.1996.162.
[30] BOTTINGER E P, BITZER M. TGF-beta signaling in renal disease[J].Journal of the American Society of Nephrology, 2002, 13(10): 2600-2610.
[31] UMEZONO T, TOYODA M, KATO M, et a1. Glomerula expression of CTGF, TGF-β1 and type I Vcollagen in diabetic nephropathy[J].Journal of Nephrology, 2006, 19(6): 751-757.
[32] 李冰, 王静凤, 杨延村, 等. 蛹虫草对糖尿病大鼠肾脏病程发展的抑制作用[J]. 食品科学, 2011, 32(15): 255-259.
[33] 田雪, 于倩, 张捷, 等. 糖尿病大鼠肾组织中PPAR-γ对TGF-β1, cSki调控作用的研究[J]. 天津医科大学学报, 2013, 19(1): 31-35.
