以竹粉为基质固态培养虫拟蜡菌及其产漆酶条件研究
2017-05-12吕琳郑晨琰李宇涛常帅王超
吕琳+郑晨琰+李宇涛+常帅+王超


摘 要:该研究探讨了不同培养条件对Ceriporiopsis subvermispora NL-4固态发酵产漆酶的影响。结果表明,当培养温度为30℃、培养基的初始含水率为64%、接种量为12%、起始pH 6.0时,该菌株活力最好且漆酶产量高;在条件下培养10d,漆酶活力可达12.45 U/g干基,比优化前提高了40%。
关键词:虫拟蜡菌;固态发酵;漆酶
中图分类号 TQ925 文献标识码 A 文章编号 1007-7731(2017)08-0018-03
Abstract:Effect of culture conditions for the production of laccase by Ceriporiopsis subvermispora NL-4 were investigated in solid-state fermentation using the milled bamboo as main substrate.The results of single-factor test showed that the optimal culture conditions of the temperature,moisture of medium,inoulum volume and the initial pH were 30℃,64%,12% and 6.0.After the strain of C. subvermispora NL-4 was cultured for 10d growth under the conditions of the above parameters,the laccase activity was up to 12.45U/g dry medium,which was 40% higher than that under the primitive conditions.
Key words:Ceriporiopsis subvermispor;Solid-fermentation;Laccase
漆酶(laccase,p-diphenoloxidase,E.C.1.10.3.2)最初是從漆树中获得的,随着生物技术的发展,微生物源漆酶有了较大的发展。由于漆酶在多个领域具有广泛的用途,对漆酶的需求日益增多[1-2]。但目前微生物产漆酶的产量仍不高[3],培养期过长导致染菌的可能性增大;漆酶的产量过低严重制约了其分离提取和纯化[4]。采用农林生物质资源作为主要基质,通过固态培养的方式探索漆酶的产生及其产量的提高,不但可以有效节约资源,降低生产成本,减少污染物的排放[5];同时,与液体发酵相比,固态发酵更接近于自然界的生态环境,有利于菌株产酶[6-7]。虫拟蜡菌(Ceriporiopsis subvermispor)[8]是一类高产漆酶的白腐菌,本研究室对其进行了菌株的诱变,获得了一株漆酶产量明显提高的菌株C. subvermispora NL-4[9]。因此,本研究以Ceriporiopsis subvermispora NL-4为发酵菌株,以竹粉为主要基质,对该菌固态发酵产漆酶的条件进行优化,以提高漆酶产量和产酶效率[10]。
1 材料与方法
1.1 菌株 C. subvermispora NL-4,本研究室诱变选育获得。
1.2 竹粉 竹粉,为毛竹(Phyllostachys pubescens)的加工剩余物,产自浙江临安,烘干后过40目筛,干燥贮存备用。
1.3 试剂 葡萄糖等均为国产分析纯,购自杭州木木生物科技有限公司;ABTS,购于sigma公司;马铃薯等购于临安浙皖农贸城。
1.4 培养基 (1)PDA固体培养基(w/w):马铃薯20%,葡萄糖2%,琼脂2%,KH2PO4 0.3%,MgSO4·7H2O 0.15%,121℃灭菌20min[10]。(2)液体种子培养基(w/w):酵母膏0.3%,葡萄糖2%,蛋白胨0.5%,pH自然,121℃灭菌20min[10]。(3)固态发酵基础培养基:在250mL三角瓶中装竹粉30g,含水率60%,121℃灭菌20min[10]。
1.5 固态发酵 参照王超等固态培养方法[10]。
1.6 生化参数的测定 (1)粗酶液制备及酶活测定:参照高恩丽等方法并改进[11]。参照黄丹莲等方法并改进[12]。(2)生物量的测定:用氨基葡糖法,参照彭丹方法测定[13]。
2 结果与分析
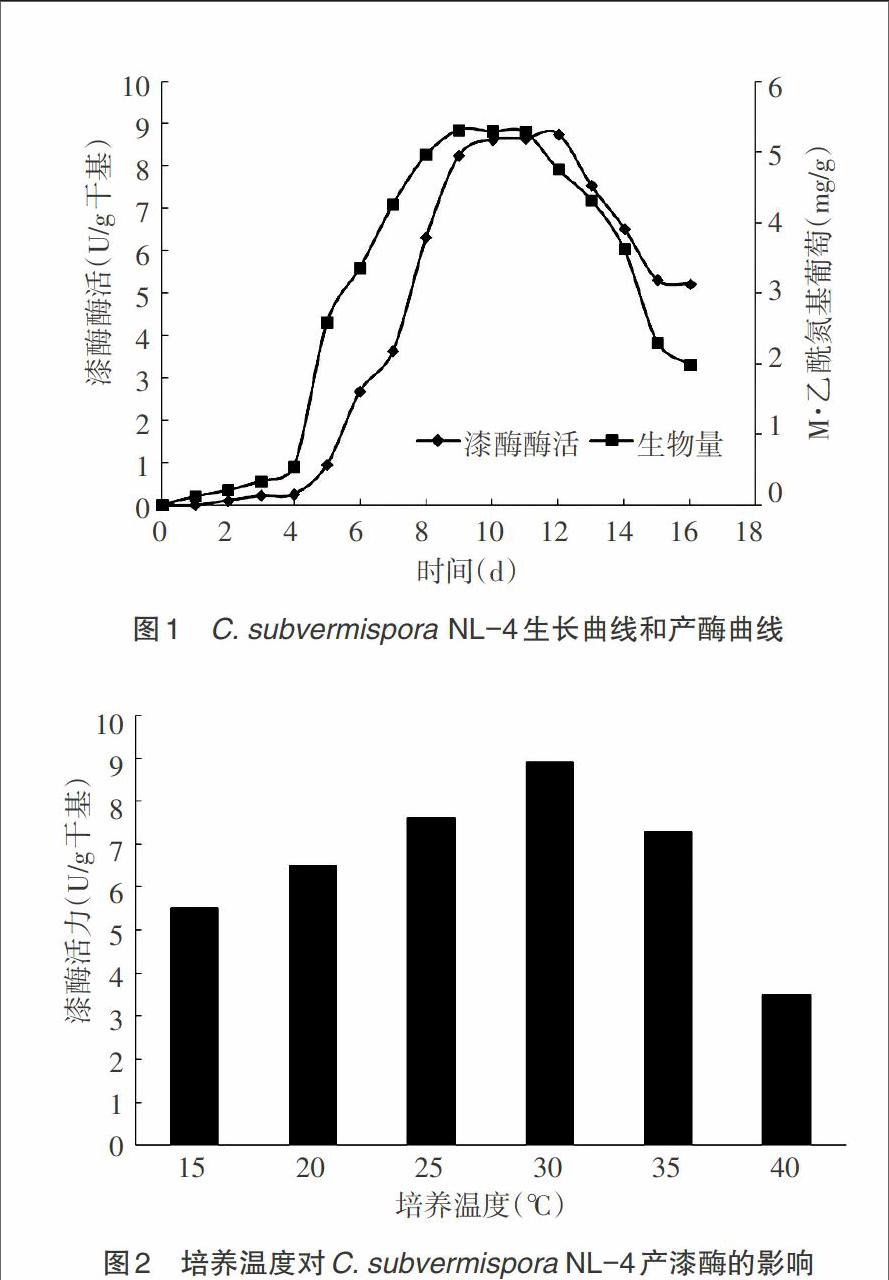
2.1 C. subvermispora NL-4生长曲线和产酶曲线 将液体种子以10%接种量接入固体发酵基础培养基中,180r/min、28℃培养16d,漆酶产量和生物量如图1。由图1中菌体的生长曲线显示,在前4d之内,菌体生长较慢,之后在4~8d之内菌体干重增加较快,呈现出对数生长期,8~11d后保持基本稳定[10]。酶活曲线显示,C. subvermispora NL-4在固态发酵条件下,第5d才开始产酶,第12d漆酶活力达到最高,因此初步确定12d为后续发酵条件研究的培养时间。
2.2 培养温度对C. subvermispora NL-4固态发酵产漆酶的影响 将固态发酵基础培养基分别在15℃、20℃、25℃、30℃、35℃、40℃条件下,180r/min、恒温培养12d后测漆酶产量,结果如图2。图2表明,培养温度对C. subvermispora NL-4固态发酵产漆酶的影响较大,30℃时漆酶酶活达到最高,40℃时仅为最高酶活的39%,因此确定30℃为固态发酵产漆酶的最适培养温度[10]。
2.3 起始含水率对C. subvermispora NL-4固态发酵产漆酶的影响 将固态发酵基础培养基的含水率分别调为44%、48%、52%、56%、60%、64%、68%和72%,180r/min、30℃培养12d后测漆酶产量,结果见图3。图3显示,随着培养基含水量的增加,漆酶活力也有提高,当培养基的含水率64%时,漆酶活力最高。含水率继续增加时,漆酶活力迅速下降。
2.4 起始pH对C. subvermispora NL-4固态发酵产漆酶的影响 将固态发酵基础培养基的pH分别调为4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5,在180r/min、培养基的含水率64%、30℃培养12d,测得的漆酶活力见图4。图4显示,培养基pH会影响菌株固态发酵产酶的活力,当pH为6.0和6.5时,漆酶活力均很高,但pH再增加时,漆酶活力有较大下降。因此选择起始pH为6.0。
2.5 接种量对C. subvermispora NL-4固态发酵产漆酶的影响 在固态发酵基础培养基中,分别接入3%、6%、9%、12%、15%、18%的液体种子,培养基的含水率64%、起始pH 6.0、在180r/min、30℃培养12d,结果见图5。图5显示,接种量不同,漆酶活力变化不明显,当接种量为12%时,漆酶活力最高。接种量增加到15%时,漆酶活力并无明显提高反而下降,因此选择12%为最适宜接种量。
2.6 C. subvermispora NL-4固态发酵产酶曲线 以竹粉为固体发酵基质,采用优化培养基及培养条件进行培养,即接种量12%、培养基起始含水率64%、起始pH6.0、在180r/min、30℃培养16d,研究C. subvermispora NL-4的菌丝体生物量以其漆酶活力的变化,如图6。与优化前相同,最初1~2d,菌体量增长缓慢;而随着培养时间的延长,菌体生物量逐渐增加;在第4~7d呈现对数生长期,第9生物量最大;菌株在第5d产酶量开始有较明显增加,第10d达到最高峰(12.45U/g干基)[10]。
3 结论
(1)对培养条件的优化结果为:培养温度30℃、培养基起始含水率64%、起始pH6.0、接种量12%。
(2)按优化后培养条件,C. subvermispora NL-4在第10d后其产漆酶活力达到最大值12.45 U/g干基,比优化前提高了40%。
参考文献
[1]Ge Hong-hua,Wu Yun,Xiao Ya-zhong.Structure,catalytic mechanism and application of laccases:a review[J].Chin J Biotech,2011,27(2):156-163.
[2]Abadulla E,Tzanov T,Costa S,et al.Decolorization and detoxification of textile dyes with a laccase from Trametes hirsute[J].Appl Environ Microbiol,2000,66(8):3357-3362.
[3]梁朝宁,薛燕芬,马延和.微生物降解利用木质纤维素的协同作用[J].生物工程学报,2010,26(10):1327-1332.
[4]Chao Wang,Xuejun Yu,Hong Xu.Purification and characterization of Laccase from Ceriporiopsis subvermispora[J].Asian Journal of Chemistry,2014(26).
[5]王超,徐虹.固态发酵产漆酶及其对竹木质素的降解[J].中国食品学报,2013,13(12):59-64.
[6]Kalogeris E,Iniotaki F,Topakas E,et al.Performance of an intermittent agitation rotating drum type bioreactor for solid-state fermentation of wheat straw[J].Bioresource Technol,2003,86(3):207-213.
[7]Stepanova E V,Komleva O V,Vasilchenko L G,et a1.Fungal decomposition of oat straw during liquid and solid-state fermentation[J].Applied Biochemistry and Microbiology,2003,39(1):65-74.
[8]Zhang Yu,Xu Jingliang,Li Dong.Research Progress of Lignin Degradationa Fungi Ceriporiopsis Subvermispora[J].Journal of Wuhan University of Technology,2009,31(10):104-108.
[9]Chao Wang,Linlin Zhang,Hong Xu.The effects of N+ Ion implantation mutagenesis on the laccase production of Ceriporiopsis subvermispora.Biotechnology and Bioprocess Engineering,2012,(17):946-951.(SCI)
[10]王超,余学军,张琳琳,等.虫拟蜡菌固态发酵产漆酶条件优化[J].中国食品学报,2013,13(6):97-103.
[11]高恩丽.固态发酵产漆酶及其应用基础研究[D].杭州:浙江大学,2007:17-18.
[12]Huang Danlian,Zeng Guangming,Huang Guohe,et al.Optimum conditions of solid-state fermentation for white-rot fungi and Its degrading straw[J].Acta Scientiae Circumstance,2005,25(2):232-237.
[13]Peng Dan,Xie Gengxin,Zeng Guangming,et al.Research and Application of Producing Laccase by Phanerochaete chrysosporium in Solid-State Fermentation System[J].Environmental Science,2008,29(12):3568-3573. (責编:张宏民)
