不同方式提取的生姜粗、精多糖体外抗氧化研究
2018-03-20王芸位思清王雪宋荣珍唐晓珍
王芸,位思清,王雪,宋荣珍,唐晓珍*
(1.山东农业大学,山东 泰安 271018;2.山东省外贸职业学院,山东 泰安 271000)
自由基是机体内不可或缺的重要活性物质,参与多种生命过程[1]。但是过多的自由基可以造成生物膜系统损伤以及细胞内氧化磷酸化障碍[2,3],引起慢性疾病及衰老效应[4],是人体疾病、衰老和死亡的直接参与者,对人体健康和寿命危害非常大。因此,寻找强有效的自由基清除剂已成为当今十分活跃的研究领域[5-7]。
近年来,人们对多糖的抗氧化活性作用有了更深的认识,已有大量研究表明:多糖类化合物具有清除自由基、抑制脂质过抗氧化作用、抑制亚油酸氧化等抗氧作用[8-10]。生姜多糖是生姜中的有效活性成分,具有很强的药理作用,如抗疲劳、保护脑缺血再灌注损伤等[11,12]。部分研究发现与精多糖相比,粗多糖具有更高的活性[13]。因此,本文就不同方式提取所得的生姜粗、精多糖进行抗氧化的研究,为生姜资源的开发和寻找有效的抗氧化剂提供理论依据。
1 材料与方法
1.1 材料
生姜:山东大唐生物科技有限公司;纤维素酶、木瓜蛋白酶、α-淀粉酶、S-8大孔树脂:北京索莱宝科技有限公司;果胶酶:上海通善生物科技有限公司;无水乙醇、石油醚、磷酸氢二钠、柠檬酸、葡萄糖、硫酸:天津市凯通化学试剂有限公司;蒽酮:国药集团化学试剂有限公司;所用试剂均为分析纯。
1.2 仪器设备
FA2004 电子分析天平 上海上平仪器有限公司;HH-6数显恒温水浴锅 国华电器有限公司;201A-1恒温干燥箱 山东省龙口市电炉制造厂;RE52CS 旋转蒸发仪、B-220恒温水浴锅 上海亚荣生化仪器厂;SHZ-D(Ⅲ)循环水式真空泵、BT600-2J 蠕动泵 保定兰格恒流泵有限公司;1.6 cm×50 cm层析柱、HL-2S 恒流泵、SBS-100 数控计滴自动部分收集器 上海沪西分析仪器厂有限公司;UV-2450紫外可见分光光度计 日本岛津公司。
1.3 实验方法
1.3.1 生姜多糖的不同方式提取
1.3.1.1 脱脂
鲜姜洗净、去皮、切丝后,于55 ℃的烘箱中烘干12 h,索氏提取2次后[14],挥干溶媒,得脱脂脱色姜粉。
1.3.1.2 酶法提取
将脱脂脱色的姜粉中加入1.5%纤维素酶、1%果胶酶、2%木瓜蛋白酶、2.5% α-淀粉酶,按料液比1∶20 (g/mL)添加pH为5.2磷酸-柠檬酸缓冲液,55 ℃水浴中浸提1 h。浸提结束后4500 r离心15 min。取上清液进行抽滤,将抽滤液中加入3倍95%乙醇醇沉12 h,醇沉结束后取沉淀离心4500 r离心15 min。将沉淀复溶得生姜粗多糖溶液。水法提取[15]:将脱脂脱色后的姜粉按料液比1∶20(m/V)添加蒸馏水,90 ℃水浴3 h。后续操作同酶法提取。
1.3.1.3 超声波辅助酶法提取[16]
将脱脂脱色的姜粉中加入1.5%纤维素酶、1%果胶酶、2%木瓜蛋白酶、2.5% α-淀粉酶,按料液比1∶20 (g/mL)添加pH为5.2的磷酸-柠檬酸缓冲液,55 ℃,400 W的条件下超声20 min,之后水浴40 min。后续操作同酶法提取。
1.3.2 脱蛋白色素
将上述溶液配制成50 mg/mL的生姜粗多糖溶液分别进行大孔树脂纯化。根据实验室前期实验结果,选择纯化条件为:上样量70 mL;上样浓度 50 mg/mL;上样流速1.5 mL/min;用水洗脱,洗脱流速1.5 mL/min;洗脱体积2.5 BV。
1.3.3 透析
将脱蛋白后的生姜多糖溶液装入孔径为3500 kDa的透析袋中透析12 h,每隔4 h换1次水。
1.4 多糖含量测定
采用蒽酮比色法进行测定。准确吸取样液1 mL加入具塞试管中,再加入5 mL蒽酮试剂,摇匀后立即放于沸水中水浴6 min。水浴结束后立即冷却至室温。以空白试剂为参比,于620 nm处测其吸光度[17]。
以葡萄糖浓度对吸光度y进行线性回归,线性回归方程为y=5.197x,相关系数R2=0.999,线性相关性良好。
1.5 多糖得率及纯度计算
将上述多糖溶液冷冻干燥得固体样品,称重计算其得率和纯度。
多糖得率[18]=粗多糖质量/姜粉质量×100%;
粗(精)多糖纯度=粗(精)多糖样品中多糖含量/粗(精)多糖样品质量×100%。
1.6 纯度鉴定
将纯化前、后的多糖溶液,用紫外可见分光光度计进行扫描。
1.7 抗氧化性测定[19]
1.7.1 DPPH自由基清除率的测定
分别取不同浓度的各样品溶液2.0 mL,置于10 mL离心管中,加入3.0 mL的DPPH自由基溶液,然后室温避光反应30 min。以蒸馏水为空白,于517 nm波长处测定吸光值。按下列公式计算DPPH自由基清除率,实验重复 3 次。
DPPH自由基清除率(%)=[A0-(As-Ac)]/A0×100%。
1.7.2 清除羟自由基活性的测定
分别取不同浓度生姜多糖溶液1.0 mL置于10 mL试管中,分别加入水杨酸-乙醇溶液1.0 mL,加蒸馏水至 5.0 mL,再分别加入H2O21.0 mL,于37 ℃水浴中反应10 min。以蒸馏水为空白,于510 nm 波长处测定吸光度。按照下列公式计算羟自由基清除率,实验重复3次。
羟自由基清除率 (%)=[A0-(As-Ac)]/A0×100%。
1.7.3 还原力的测定
分别取不同浓度的各样品溶液2.0 mL,分别加入2.5 mL磷酸盐缓冲液和2.5 mL铁氰化钾溶液,将所得的混合物于50 ℃水浴保温20 min,然后加入2.5 mL三氯乙酸溶液,混合溶液4000 r/min离心10 min,精密吸取上清液2.5 mL,加入2.5 mL蒸馏水和0.5 mL三氯化铁溶液,以蒸馏水为空白,在700 nm处测吸光度,实验重复3次。
1.8 数据处理
采用Origin 8.5作图,用SPSS 16.0软件对结果进行数据分析,各组数据结果均以平均值±SD(n=3)表示,并进行方差分析,P<0.05为显著性差异。
2 结果与分析
2.1 不同方式提取的生姜多糖主要化学组分的比较
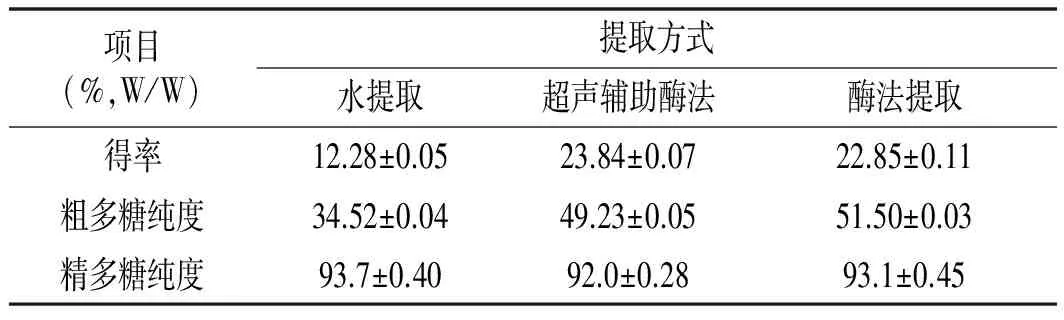
表1 不同方式提取的生姜多糖得率和纯度的比较Table 1 The yield and purity of ginger polysaccharides by different extraction ways
由表1可知,酶法提取的生姜粗多糖的得率和纯度均明显高于水法,但与超声辅助酶法相比差异性不显著(P<0.05)。超声辅助酶法提取的生姜粗多糖的得率略高于酶法提取,这可能是由于果胶酶、纤维素酶和α-淀粉酶等酶类对植物细胞进行破壁提取[20,21],而后超声波的机械破碎和空化作用促使了多糖和其他物质从原料向溶剂的扩散速率[22,23],从而进一步提高了其提取率。纯化后的生姜精多糖基本不含蛋白质、单糖、色素等物质[24]。3种精多糖其纯度均超过90%,差异性不显著(P<0.05)。超声辅助酶法提取生姜粗多糖纯化后的纯度略低于酶法和水法,这是由于超声波辅助提取虽然可以提高多糖的提取得率,但会造成粗多糖的组分更加复杂,分离稍加困难[25]。
2.2 不同提取方式对生姜粗、精多糖抗氧化性的影响
2.2.1 对DPPH自由基清除率的影响
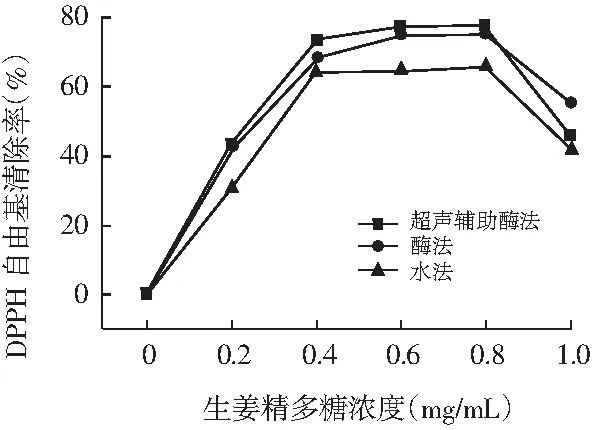
图1 不同提取方式对生姜粗多糖DPPH自由基清除率的影响Fig.1 The effect of crude polysaccharides on DPPH radical scavenging activity by different extraction ways
DPPH自由基清除率是一种常用评价新抗氧化剂自由基清除率的方法[26,27]。由图1可知,对于3种不同方式提取的生姜粗多糖,其DPPH自由基清除率均先随生姜粗多糖浓度的增大而增大,当浓度达到0.8 mg/mL后出现下降趋势,三者之间均差异性不显著(P<0.05)。其清除率下降原因可能与生姜粗多糖的空间结构有关,当多糖溶液达到一定的浓度时,其有效基团被包裹在内无法外露产生作用[28]。结果表明不同方式提取的生姜粗多糖对DPPH自由基的清除能力效果显著,超声辅助酶法、酶法和水法对DPPH自由基最高清除率依次为77.0%,75.4%和65.8%。

图2 不同提取方式对生姜精多糖DPPH自由基清除率的影响Fig.2 The effect of pure polysaccharides on DPPH radical scavenging activity by different extraction ways
由图2可知,在浓度为0~1 mg/mL的范围内,纯化后的3种生姜精多糖其DPPH自由基清除率均随浓度的增加而增大,并具有一定的线性关系。与粗多糖相比,3种精多糖对DPPH自由基的清除能力较低,但在浓度为1 mg/mL时其对DPPH自由基清除能力基本等于粗多糖,超声辅助酶法、酶法和水法对DPPH自由基的清除率依次为45.1%,44.1%和37.6%。此外,3种精多糖对DPPH自由基的清除能力差异性不显著(P<0.05),说明纯化后的多糖组分基本相同。上述说明粗多糖中对DPPH自由基发挥清除作用的成分是多糖。
2.2.2 对羟基自由基清除率的影响
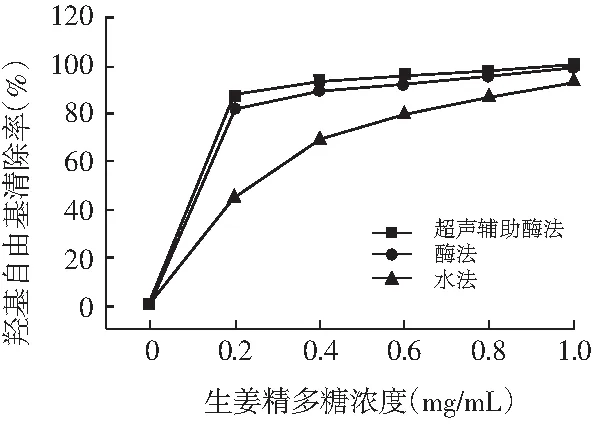
图3 不同提取方式对生姜粗多糖羟基自由基清除率的影响Fig.3 The effect of crude polysaccharides on hydroxy radical scavenging activity by different extraction ways
羟基自由基具有极高的反应性能并可以损害细胞,但它可以被抗氧化剂抑制[29]。由图3可知,对于不同方式提取的生姜粗多糖,都具有很高的羟自由基清除效果,清除效果差异性不显著(P<0.05),浓度在1 mg/mL时清除率分别高达99.7%,99.1%,93.1%。3种粗多糖对羟自由基的清除率随浓度增大而增大,当浓度高于0.2 mg/mL后三者都缓慢增大,差异性显著(P<0.05)。结果表明不同方式提取生姜粗多糖对羟基自由基的清除能力效果显著。

图4 不同提取方式对生姜精多糖羟基自由基清除率的影响Fig.4 The effect of pure polysaccharides on hydroxy radical scavenging activity by different extraction ways
由图4可知,与粗多糖相比,3种生姜精多糖对羟基自由基清除效果差异性不显著(P<0.05),在浓度为1 mg/mL时清除率仅为4.0%左右,这说明在实验条件下,生姜精多糖不与羟基自由基反应,对实验中所存的影响体系不大,故在510 nm波长处吸收不明显。结果表明生姜精多糖无清除羟基自由基的效果,粗多糖对羟基自由基的极其显著清除效果不是精多糖的作用。
2.2.3 对还原力的影响
天然化合物还原能力可以作为评价羟自由基清除能力的一项重要指标,还原能力越强,其羟自由基清除能力越强[30]。
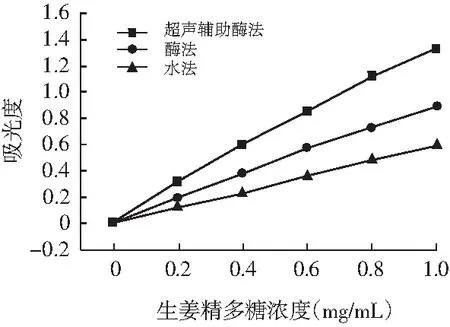
图5 不同提取方式对生姜粗多糖还原力的影响Fig.5 The effect of crude polysaccharides on reducing power by different extraction ways
由图5可知,对于不同提取方式的生姜多糖其还原能力随生姜多糖浓度的增大而增大,并具有一定的线性关系,其中超声辅助酶法>酶法>水法。这表明不同方式提取的生姜多糖还原能力效果显著,其中超声辅助酶法提取的还原能力最强,在浓度为1 mg/mL时吸光度为1.38。

图6 不同提取方式对生姜精多糖还原力的影响Fig.6 The effect of pure polysaccharides on reducing power by different extraction ways
由图6可知,在还原力测定实验中,与粗多糖相比,3种生姜精多糖的还原能力不显著,在浓度为1 mg/mL时其吸光度仅为0.15左右,说明生姜精多糖不与反应体系中的物质反应,在700 nm波长处没有吸收。
3 讨论
在DPPH自由基清除实验中,生姜粗、精多糖均具显著的抗氧化性,说明粗多糖中的多糖发挥了清除DPPH自由基的作用。由于粗多糖中含有少量姜酚和姜黄酮等物质,而姜酚和姜黄酮具有高的清除自由基的能力[31,32],所以开始时羟基自由基清除生姜粗多糖的DPPH自由基清除能力高于精多糖。但当生姜粗多糖溶液达到一定浓度后,其清除DPPH自由基的有效基团被包埋在内,无法外露产生作用,所以会出现下降现象。在羟基自由基清除实验和还原力实验中,生姜粗多糖表现出很强的抗氧化性,而生姜精多糖的抗氧化性不显著,说明粗多糖中发挥清除羟基自由基和还原能力的可能是除多糖外的其他成分,也可能是多糖与其他成分协同作用的结果[33],但具体机理有待进一步研究。与生姜粗多糖相比,精多糖的制备时间相对较长,制备工艺也相对复杂,这也对其抗氧化能力造成了一定的影响。另外,酶法提取的生姜多糖其得率、纯度高,抗氧化性能高,从能源角度和工业成本可以考虑其为较佳的提取方式。
4 结论
经超声辅助酶法、酶法和水法3种方式提取生姜粗多糖和纯化后生姜精多糖。结果表明3种不同方式提取的生姜粗多糖对DPPH自由基、羟基自由基的清除能力强,差异性不显著(P<0.05);还原能力与粗多糖的浓度具有线性关系,其中超声辅助酶法>酶法>水法,差异性显著(P<0.05);而生姜精多糖只对DPPH自由基有显著影响,对羟基自由基清除效果和还原能力不显著。
[1]Valko M,Leibfritz D,Moncol J,et al.Free radicals and antioxidants in normal physiological functions and human disease[J].The International Journal of Biochemistry & Cell Biology,2007,39(1):44-84.
[2]赵虹,骆庆和,殷明,等.氧化应激与阿尔茨海默病[J].中国老年学,2013,33(16):4090-4093.
[3]张翠利,付丽娜,杨小云,等.活性氧自由基与细胞衰老关系的研究进展[J].广州化工,2015(19):5-7.
[4]赵保路.自由基、营养、天然抗氧化剂与衰老[J].生物物理学报,2010(1):26-36.
[5]贾天华,崔红.核桃楸皮的抗衰老自由基机制研究[J].中国药物经济学,2013(3):212-213.
[6]农石生,龚子龙,周金花,等.板蓝根抗氧化成分及抗氧化性能研究[J].中国野生植物资源,2017(3):18-22.
[7]钟灵,王振富,文德鉴.黄芪多糖抗衰老作用的实验研究[J].中国应用生理学杂志,2013(4):350-352.
[8]陈玉琴,南海娟,刘坤峰.蕨菜多糖提取及抗氧化特性[J].北方园艺,2014(14):128-132.
[9]包瑛,马岳,李雅双,等.大白桩菇多糖的结构鉴定及清除自由基活性[J].食品科学,2016(6):71-76.
[10]段晋宁,肖旺,曾建红,等.莪术多糖对糖尿病大鼠血糖、抗脂质过氧化作用的影响与单糖组分分析[J].时珍国医国药,2016(3):569-572.
[11]夏树林,吴庆松.生姜多糖的提取及其抗疲劳作用[J].江苏农业科学,2014(4):240-242.
[12]宋琳琳,沙靖全,张磊,等.生姜粗多糖的提取及对脑缺血再灌注损伤大鼠的保护作用[J].辽宁中医杂志,2015(12):2433-2435.
[13]刘杭达,马千苏,王傑,等.紫山药粗多糖提取工艺的优化及其抗氧化性的研究[J].食品工业科技,2015(23):208-213.
[14]马利华,秦卫东,贺菊萍,等.复合酶法提取生姜多糖[J].食品科学,2008(8):369-371.
[15]邓胜国,尹爱武,陈铁壁.生姜多糖的提取工艺及其抗氧化活性研究[J].湖南科技学院学报,2013(4):66-70,73.
[16]刁文超,王然,王凤舞,等.超声波协同复合酶法提取南瓜多糖工艺优化[J].食品科学,2012(18):14-20.
[17]王宪泽,王保莉,冯炘.生物化学实验技术原理和方法[M].北京:中国农业出版社,2002:75-77.
[18]冯鑫,夏宇,陈贵堂,等.生姜皮多糖的分离纯化及其结构组成分析[J].食品科学,2017(6):185-190.
[19]许海顺,蒋剑平,徐攀,等.红参多糖抗氧化活性的研究[J].浙江中医药大学学报,2011(6):909-912.
[20]滕利荣,孟庆繁,刘培源.酶法提取百合多糖及其体外抗氧化活性[J].吉林大学学报(理学版),2003,41(4):538-542.
[21]陈石良,孙震,谷文英.灰树花深层发酵菌丝体多糖的酶法提取及其抗肿瘤作用[J].无锡轻工大学学报,2000,19(4):336-339.
[22]Zhang Y,Wang Z Y,Chen X Q.Ultrasound associated extraction of seed oil of Korean pine[J].Journal of Forestry Research,2005,16(2):140-142.
[23]赵玉红,王静,金秀明.超声波辅助酶法提取榛子壳色素工艺条件的研究[J].中国调味品,2010,35(4):110-114.
[24]巴特.大枣多糖提取纯化工艺研究进展[J].农业科技与装备,2015(11):52-54.
[25]郑德勇,安鑫南.植物抗氧化剂的研究概况与发展趋势[J].林产化学业,2004(3):113-118.
[26]Bondet V,Brand W,Berset C.Kinetics and mechanisms of antioxidant activity using the DPPH free radical method [J].Food Science and Technology,1997,30:609-615.
[27]Khaskheli S G,Zheng W,Sheikh S A,et al.Characterization ofAuriculariaauriculapolysaccharides and its antioxidant properties in fresh and pickled product[J].International Journal of Biological Macromolecules,2015,81:387-395.
[28]王金玺,顾林,孔凡伟,等.鸡腿菇粗多糖的体外抗氧化性[J].食品科学,2012(13):79-82.
[29]Rollet-Labelle E,Grange M J,Elbim C,et al.Hydroxyl radical as a potential intracellular mediator of polymorphonuclear neutrophil apoptosis[J].Free Radical Biology & Medicine,1998,24:563-572.
[30]Shimada K,Fujikawa K,Yahara K,et al.Antioxidative properties of xanthan on the autoxidation of soybean oil in cyclodextrin emulsion[J].Agric.Food Chem.,1992,40:945-948.
[31]马建苹.生姜中七个新的六氢姜黄素类化合物的NMR研究[A].中国物理学会波谱专业委员会.第十三届全国波谱学学术会议论文摘要集[C].中国物理学会波谱专业委员会,2004:2.
[32]莫开菊,柳圣,程超.生姜黄酮的抗氧化活性研究[J].食品科学,2006(9):110-115.
[33]娜日苏.天然植物多糖及复合多糖的研究进展[J].赤峰学院学报(自然科学版),2009(1):68-72.
