强直性脊柱炎患者外周血单个核细胞、血清SPARC表达变化及意义
2018-03-19王丽亚杨清锐菏泽医学专科学校山东菏泽74000山东大学附属省立医院
王丽亚,杨清锐(菏泽医学专科学校,山东菏泽74000;山东大学附属省立医院)
强直性脊柱炎(AS)是一种以慢性炎症为主的全身性疾病,主要累及骶髂关节和脊柱中轴关节[1]。富含半胱氨酸酸性分泌蛋白(SPARC)是Termine等[2]在1981年于牛骨中初步鉴定的一种非胶原成分,是一种富含半胱氨酸的小分子糖蛋白,也被称作骨连接蛋白、基底膜40蛋白(BM40)。SPARC作为一种可由许多细胞分泌的非结构性细胞外间质蛋白,与骨形成、伤口愈合、血管生成和胚胎发育等均存在密切关系[3]。SPARC可调节细胞外基质(ECM)分泌,影响树突状细胞迁移和T细胞启动抗原特异性免疫反应,增加转化生长因子β(TGF-β)活性,进而抑制免疫炎症反应[4,5]。Sharma等[6]首先发现,SPRAC是引起脊柱关节病的固有免疫系统的组成部分。但目前尚缺乏SPARC与AS关系的相关研究。本研究观察AS患者外周血单个核细胞、血清SPARC表达变化,并探讨其在AS病情进展中的作用。
1 资料与方法
1.1 临床资料 选择2015年12月~2016年11月山东大学附属省立医院风湿免疫科收治的AS患者70例作为观察组,男66例、女4例,年龄(33.36±9.39)岁,病程(8.23±6.57)年。患者均符合1984年修订的纽约AS诊断标准[10],排除其他自身免疫性疾病、肝脏和肾脏疾病、感染、恶性肿瘤和血管疾病等。选择同期体检健康志愿者70例作为对照组,男60例、女10例,年龄(31.01±8.27)岁。两组性别构成比、年龄具有可比性。本研究通过山东大学附属省立医院医学伦理委员会审核,受试者及家属均签署知情同意书。
1.2 外周血单个核细胞分离及SPARC mRNA表达检测 收集两组空腹肘静脉血3 mL,采用Ficoll梯度离心法分离外周血单个核细胞,从界面收集细胞,Hank液洗涤3次。加入细胞裂解液,采用TRIzol法提取外周血单个核细胞中的总RNA,逆转录合成cDNA。引物由上海生工生物工程股份有限公司合成,SPARC上游引物:5′-TCGCCTGAGGCTGTAACTGA-3′,下游引物:5′-GGGAGGGTGAAGAAAAGGAG-3′,引物长度:406 bp;内参β-actin 上游引物:5′-GGCTACAGCTTCAC-CACCAC-3′,下游引物:5′-AGGAAGGAAGGCTG-GAAGAG-3′,引物长度:212 bp。采用Roche480实时荧光定量PCR系统进行PCR反应。PCR反应体系:上游引物0.4 μL,下游引物0.4 μL,SYBR Green 10 μL,DEPC 7.2 μL,cDNA 2.0 μL。PCR反应条件:94 ℃预变性5 min,94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸30 s,共39个循环;72 ℃延伸5 min。采用2-ΔΔCt法计算SPARC mRNA相对表达量。
1.3 血清SPARC表达检测 采用ELISA法。收集两组空腹肘静脉血3 mL于含有血清分离胶的无菌促凝试管中。静置半小时后采用离心机1 000 r/min离心20 min,取上层血清,- 80 ℃冰箱保存。采用抗人SPARC ELISA试剂盒检测血清SPARC蛋白表达,严格按照试剂盒说明书操作。
1.4 观察组外周血单个核细胞、血清SPARC表达与病情相关指标的相关性分析 记录观察组Bath强直性脊柱炎疾病活动指数(BASDAI),并检测其血细胞沉降率(ESR)及CRP。BASDAI包括疲劳、脊柱痛、外周关节痛、局限性压痛以及晨僵持续时间和程度共6个项目,每个项目10分,6个项目总分除以5即为BASDAI。抽取观察组晨起空腹肘静脉血,采用魏式法检测ESR,免疫比浊法检测CRP。采用Spearman相关分析法分析观察组外周血单个核细胞、血清SPARC表达与BASDAI、ESR、CRP的关系。
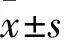
2 结果
2.1 两组外周血单个核细胞、血清SPARC表达比较 观察组外周血单个核细胞中SPARC mRNA相对表达量为22.706±2.704,对照组为24.035±2.590,两组比较P<0.01。观察组血清SPARC表达为(1 287.690±486.101)ng/dL,对照组为(1 490.530±503.459)ng/dL,两组比较P<0.01。
2.2 观察组外周血单个核细胞SPARC表达与BASDAI、ESR、CRP的关系 观察组BASDAI为(4.76±1.48)分,ESR为(31.39±18.02)mm/h,CRP为(28.53±15.70)mg/L。观察组外周血单个核细胞SPARC表达与BASDAI、ESR、CRP均呈负相关关系(r分别为- 0.372、- 0.362、- 0.399,P均<0.01)。
2.3 观察组血清SPARC表达与BASDAI、ESR、CRP的关系 观察组血清SPARC表达与BASDAI、ESR、CRP均呈负相关关系(r分别为- 0.285、- 0.332、- 0.560,P<0.05或<0.01)。
3 讨论
SPARC是一种能结合细胞外基质中糖和胶原等物质的特殊型分泌性糖蛋白,其本身并不参与细胞外结构组成,而是通过与细胞膜受体、蛋白酶和生长因子等相互作用,调节细胞外基质成分、细胞形态和黏附性,从而发挥多种生物学活性[7,8,11]。目前发现,SPARC能够抑制细胞周期、调节细胞分化、抑制某些细胞因子生成;可参与机体炎症反应、血管生成、伤口愈合、肿瘤迁移等生理病理过程,参与多种疾病的发生与发展[3,6]。研究发现,SAPRC基因纯合子突变与成骨不全症密切相关,可导致人类发生严重的骨质疏松[12];成骨障碍患者的成骨细胞中SPARC表达明显减低[13]。Zhao等[14]发现,SPARC基因敲除小鼠较野生型小鼠骨密度明显降低,并且小梁骨骨量丢失更快,说明SPARC是影响骨细胞分化和成骨细胞活性的重要因子。
研究证实,免疫炎症性反应在AS的发生、发展过程中具有重要作用。TNF-α是公认的参与AS发病的促炎因子之一[15],其不仅直接参与关节滑膜组织炎症反应,也可促进破骨细胞的溶骨作用,增加骨吸收,促进成纤维细胞增生,造成关节破坏及关节强直[16]。研究表明,SPARC与TGF-β相互作用,可抑制TNF-α产生,进而减轻体内炎症反应并促进成骨细胞增殖和分化[7]。本研究结果显示,观察组外周血单个核细胞、血清SPARC表达均明显低于对照组,且均与疾病活动指标BASDAI、ESR及CRP呈负相关关系,提示SPARC可抑制AS患者体内的炎症反应,在一定程度上与疾病活动密切相关。许敬人等[16]发现,提高AS伴骨质疏松患者血清SPARC水平有助于减轻其免疫炎症反应,同时可改善脊柱、关节活动功能,增加骨生成,减少骨吸收,最终提高骨密度。
综上所述,AS患者外周血单个核细胞、血清SPARC表达均降低,SPARC表达检测有助于判断患者病情活动,但其具体作用机制尚需进一步研究证实。
参考文献:
[1] Braun J, Sieper J. Ankylosing spondylitis[J]. Lancet, 2007,369(9570):1379-1390.
[2] Cheng L, Sage EH, Yan Q. SPARC fusion protein induces cellular adhesive signaling[J]. PLoS One, 2013,8(1):53202.
[3] Brekken RA, Sage EH. SPARC, a matricellular protein: at the crossroads of cell-matrix communication[J]. Matrix Biol, 2001,19(8):816-827.
[4] Brune K, Hong SM, Li A, et al. Genetic and epigenetic alterations of familial pancreatic cancers[J]. Cancer Epidemiol Biomarkers Prev, 2008,17(12):3536-3542.
[5] Sangaletti S, Gioiosa L, Guiducci C, et al. Accelerated dendritic-cell migration and T-cell priming in SPARC-deficient mice[J]. J Cell Sci, 2005,118(16):3685-3694.
[6] Sharma SM, Choi D, Planck SR, et al. Insights in to the pathogenesis of axial spondyloarthropathy based on gene expression profiles[J]. Arthritis Res Ther, 2009,11(6):R168.
[7] van der Linden CJ, Breslau PJ, de Jong PC, et al. Prospective study on the incidence of complications of right heart catheterization[J]. Neth J Surg, 1984,36(5):127-129.
[8] Delany AM, Hankenson KD. Thrombospondin-2 and SPARC/osteonectin are critical regulators of bone remodeling[J]. J Cell Commun Signal, 2009,3(3-4):227-238.
[9] Jundt G, Berghauser KH, Termine JD, et al. Osteonectin--a differentiation marker of bone cells[J]. Cell Tissue Res, 1987,248(2):409-415.
[10] Mendoza-Londono R, Fahiminiya S, Majewski J, et al. Recessive osteogenesis imperfecta caused by missense mutations in SPARC[J]. Am J Hum Genet, 2015,96(6):979-985.
[11] Machado DR, Kessler CB, Adams DJ, et al. Accentuated osteoclastic response to parathyroid hormone undermines bone mass acquisition in osteonectin-null mice[J]. Bone, 2008,43(2):264-273.
[12] Sonel B, Tutkak H, Duzgun N. Serum levels of IL-1 beta, TNF-alpha, IL-8, and acute phase proteins in seronegative spondyloarthropathies[J]. Joint Bone Spine, 2002,69(5):463-467.
[13] Azuma Y, Kaji K, Katogi R, et al. Tumor necrosis factor-alpha induces differentiation of and bone resorption by osteoclasts[J]. J Biol Chem, 2000,275(7):4858-4864.
[14] Zhao YM, Ge LH, Grigoriadis AE. Effect of TNF-alpha on murine osteoclast differentiation[J]. Beijing Da Xue Xue Bao Yi Xue Ban, 2005,37(4):433-435.
[15] 许敬人,张春燕,茅惠明,等.补肾通督方对强直性脊柱炎患者血清TNF-α、TGF-β1及骨代谢的影响[J].上海中医药大学学报,2008,23(1):33-35.
[16] 许敬人,林研,张春燕,等.综合疗法对强直性脊柱炎伴骨质疏松患者血清富含半胱氨酸的酸性蛋白酶的影响[J].中国中西医结合杂志,2013,31(4):466-470.
