异荭草素对鼠伤寒沙门氏菌的抑制作用及机理研究
2018-03-16高春霞刘俊义谢从坤
高春霞,刘俊义,谢从坤,邓 红,李 涵,袁 莉
(陕西师范大学食品工程与营养科学学院,陕西西安 710062)
0 引言
异荭草素(Isoorientin),又名3',4',5,7-四羟基-6-吡喃葡萄糖基黄酮,是一种天然的黄酮类物质,其结构式如图1,因最早从荭草中分离发现而得名[1]。异荭草素主要存在于玉米、黑荞麦、竹笋、苦菜、山楂、百香果、西番莲等食物中[2-3]。研究发现,异荭草素具有清除自由基[4]、抑制癌细胞增殖[5-6]、抗氧化[7-8]、抗炎[9-10]、保肝[11-13]、调节免疫能力[14]等生物活性。天然抗菌成分一般为多酚或黄酮类物质,提取物己经广泛用于抑菌剂[15],异荭草素作为一种水溶性黄酮,其对微生物的作用至今鲜有报道。试验以鼠伤寒沙门氏菌为供试菌,通过研究异荭草素对鼠伤寒沙门氏菌的抑菌效果、抑菌圈大小、最小抑菌浓度、生长曲线、蛋白质含量、细胞膜通透性及核酸含量等方面的变化来阐述异荭草素的抑菌效果及作用机制,为开发高效低毒的抗菌药物提供理论依据。
异荭草素结构式见图1。
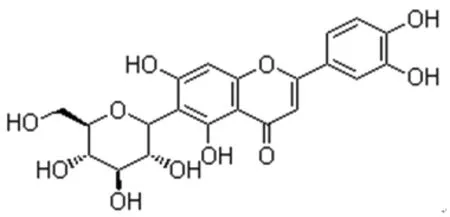
图1 异荭草素结构式
1 材料与方法
1.1 试验菌株
鼠伤寒沙门氏菌(Salmonella typhimurium),陕西师范大学食品微生物专业实验室提供。
1.2 主要试剂
异荭草素,江苏永健医药科技有限公司提供,含量99%;NA培养基:蛋白胨、牛肉膏、氯化钠、琼脂粉分析纯试剂,均购于西安晶博化玻仪器供应站;AO,EB双染试剂盒,购于上海七海复泰生物科技有限公司;考巴斯亮蓝G-250,购于西安晶博化玻仪器供应站。
1.3 主要仪器
GHP-9270型隔水式恒温培养箱,上海申贤恒温设备厂产品;THZ-C型恒温振荡器,江苏省太仓市实验设备厂产品;Multiskan Go型全波长酶标仪,美国热电公司产品;DDSJ-308A型电导率仪、超净工作台,哈尔滨东联电子技术开发有限公司产品;BS-224-S型电子分析天平,赛多利斯科学仪器有限公司产品;LDZX-50KB型上海申安立式灭菌器、DF-101S型恒温磁力搅拌器,巩义市予华仪器有限责任公司产品;徕卡Leica AF6000型荧光显微镜系统。
1.4 试验方法
1.4.1 异荭草素抑菌效果的测定
采用滤纸片扩散法[16-17]进行测定。准确吸取100 μL受试菌悬液注入到冷凝培养基平板表面,并在平板表面等距贴放4~5个滤纸片(121℃,30 min灭菌),中间滤纸片添加无菌水为空白,两边滤纸片分别添加5 μL的一定浓度异荭草素溶液,于37℃条件下恒温培养24 h。用十字交叉法测量抑菌圈直径,重复3次,结果用mm表示。抑菌率的计算公式为:

1.4.2 异荭草素对菌体生长曲线的影响
采用分光光度法测定异荭草素对鼠伤寒沙门氏菌生长速度的影响[18-19]。其方法为:取出处于对数生长期的细菌,并分别加入异荭草素使其终浓度为1 mmol/L,以转速180 r/min摇床37℃的条件恒温培养,每隔2 h取样测量OD600,连续测定24 h,以时间为横坐标,以OD600值为纵坐标,用蒸馏水代替异荭草素溶液作为对照试验,绘制出异荭草素作用下鼠伤寒沙门氏菌的生长曲线。
1.4.3 异荭草素对菌体细胞膜通透性的影响
通过相对电导率法[20]和AO-EB染色法[21]测定电导率,从而测定异荭草素对菌体细胞膜通透性的影响。
(1) 测定相对电导率。用PBS清洗活化后的菌体并使之混匀。并分别加入异荭草素使其终浓度为1 mmol/L。取3 mL,以转速3 000 r/min离心15 min,取上清液待用。菌悬液置于37℃,120 r/min的摇床中,每隔2 h取1次,离心,取上清液3 mL测此时电导率;然后100℃热死处理,离心测定上清液的电导率值,以蒸馏水替代异荭草素溶液作为空白对照[17]。
其相对渗透率的计算公式为:
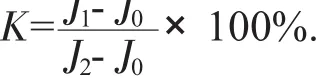
式中:K——某时间电解质相对渗透率,%;
J0——零时间电导率,ms/cm;
J1——某时刻的电导率,ms/cm;
J2——煮沸20 min,冷却至室温后电导率,ms/cm。
(2) AO-EB染色法。PBS清洗活化后处于生长期的菌体,取5 mL,以转速3 000 r/min离心5 min,取上清,PBS重悬,重复2次;并分别加入异荭草素使其终浓度为1 mmol/L,混匀;放入培养箱中37℃振荡保存6 h;取出后离心,弃PBS,各加入10 μL AO、EB染液,取10 μL样品置于载玻片,盖上盖玻片,置于荧光显微镜下观察并采集图片。以蒸馏水代替异荭草素溶液作为空白对照。
1.4.4 异荭草素对菌体可溶性蛋白质的影响
用考马斯亮蓝比色法[22]测定异荭草素对受试菌菌体可溶性蛋白质含量的影响[18]。其方法为:菌体活化后用PBS清洗3次,混匀。加入并分别加入异荭草素,使其终浓度为1 mmol/L。菌悬液置于37℃,120 r/min的摇床中培养,每隔2 h取样,离心,取上清液,加入考马斯亮蓝试剂于595 nm处测样品管的吸光值,通过标准曲线(图2)查得待测样品的蛋白质含量。以时间为横坐标,蛋白含量为纵坐标,绘制蛋白含量变化曲线,以蒸馏水作为空白对照。
蛋白质标准曲线见图2。
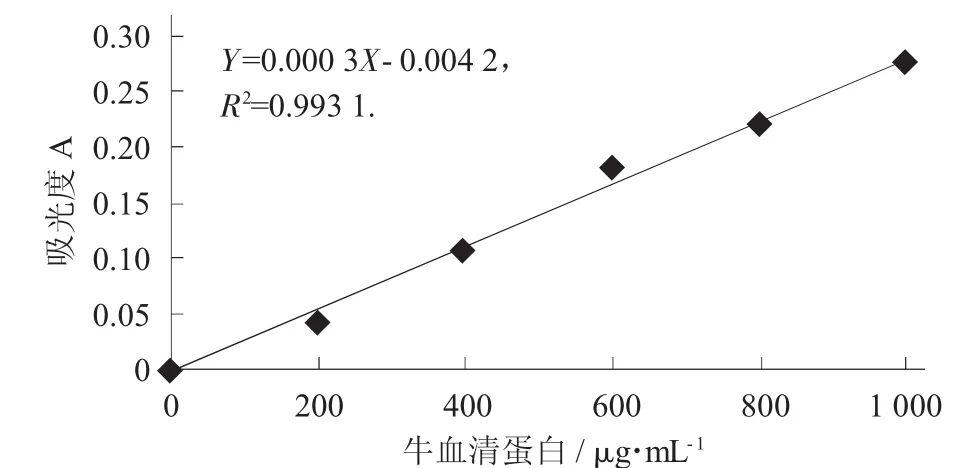
图2 蛋白质标准曲线
1.4.5 异荭草素对鼠伤寒总核酸泄露的影响
用PBS清洗活化后处于生长期的受试菌株,并分别加入异荭草素使其终浓度为1 mmol/L,混匀,37℃,100 r/min环境下恒温培养。每2 h取样1次,将取样液3 000 r/min离心15 min,取上清液加入96孔板用酶标仪测量260 nm下的吸光度并记录数据,以蒸馏水作对照组,每组平行3次,取平均值[23]。
2 结果与讨论
2.1 异荭草素对鼠伤寒沙门氏菌抑菌效果的测定结果
异荭草素对鼠伤寒沙门氏菌抑菌效果见图3,异荭草素对鼠伤寒沙门氏菌DIZ的检测结果(X±s,n=5) 见表 1。

图3 异荭草素对鼠伤寒沙门氏菌抑菌效果
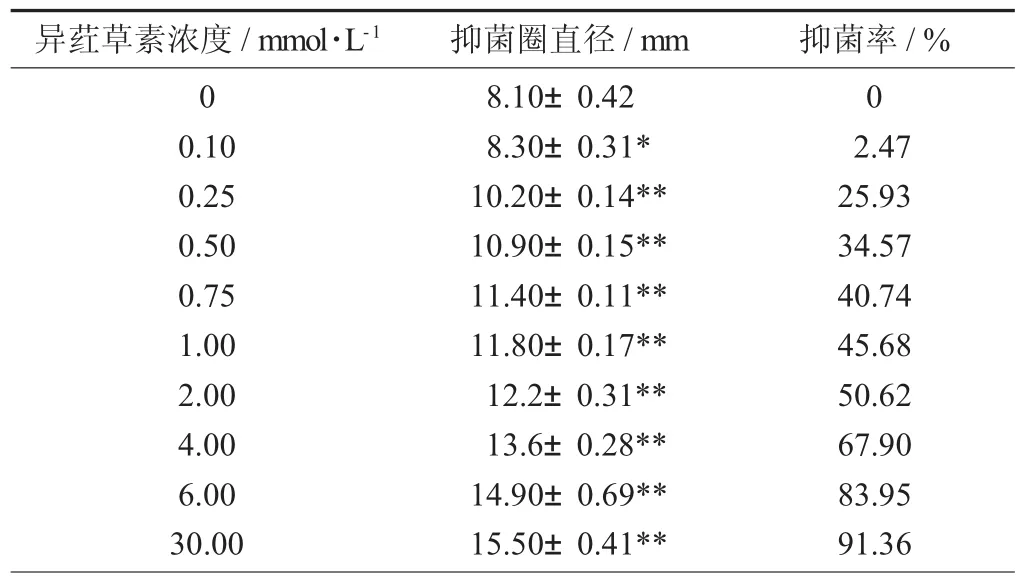
表1 异荭草素对鼠伤寒沙门氏菌DIZ的检测结果(X±s,n=5)
由表1可知,异荭草素对鼠伤寒沙门氏菌有一定的抑制效果,且随着异荭草素浓度的增加,抑菌效果有一定的增强。当异荭草素的浓度增加到30 mmol/L时,抑菌圈直径和抑菌率达到最大,抑菌圈直径为15.5±0.41 mm,抑菌率为91.36%。这说明异荭草素有着一定的抑菌能力,且高浓度的异荭草素对鼠伤寒沙门氏菌有着较强的抑制作用。
2.2 异荭草素对鼠伤寒沙门氏菌菌体生长曲线影响的结果
按照分光光度法测定异荭草素对鼠伤寒沙门氏菌生长速度的影响。
异荭草素对鼠伤寒沙门氏菌生长曲线的影响见图4。
由图4可以看出,随着时间的增加,空白和加药组的吸光度值都是不断增加的,但增加的速度有所差别,空白组在0~14 h内,吸光值不断增加,在14~26 h内吸光值趋于平稳,说明在有限的生存空间和营养条件下,细菌的数量已经达到了最大值。而加药组,在0~2 h内,细菌生长速度与空白组相差不大,在2~18 h内吸光度值不断升高,但细菌生长速度远远低于空白组,这说明异荭草素破坏了细菌正常的生长周期和细菌的细胞分裂;18~26 h内,吸光度值趋于平稳,在16~26h内空白组与加药组的吸光度值之差逐渐减小。加药组与空白组相比结果可以说明异荭草素对鼠伤寒沙门氏菌的的菌体生长周期及细胞分裂有一定的抑制作用[24],且随着抑菌时间的增加,抑制作用逐渐降低。
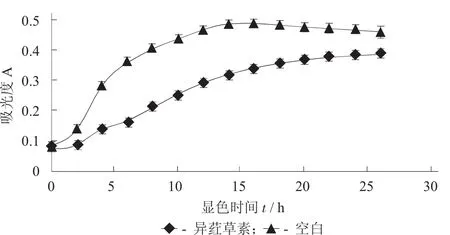
图4 异荭草素对鼠伤寒沙门氏菌生长曲线的影响
2.3 异荭草素对鼠伤寒沙门氏菌菌体细胞膜通透性的影响结果
按照相对电导率法进行试验,异荭草素对受试菌电导率的影响试验。
异荭草素对鼠伤寒沙门氏菌电导率的影响见图5。
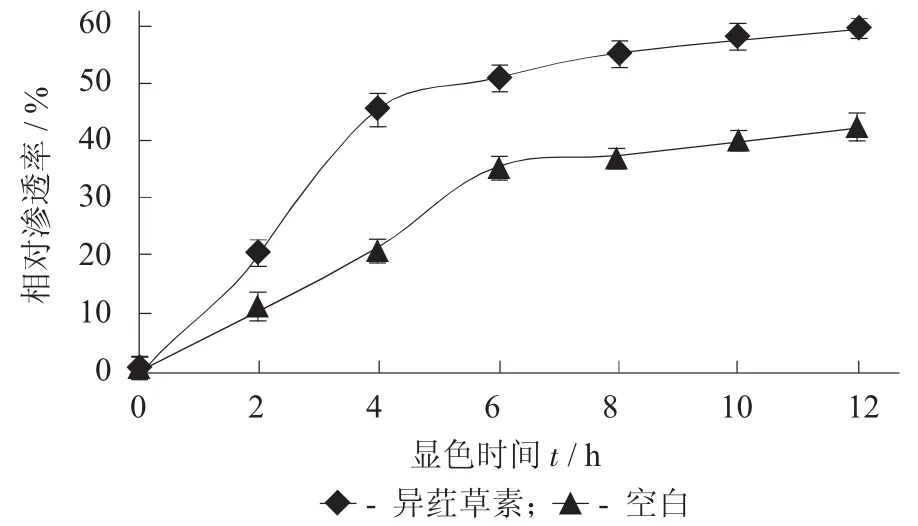
图5 异荭草素对鼠伤寒沙门氏菌电导率的影响
由图5可以看出,加入异荭草素的受试菌体细胞的相对渗透率明显高于对照组。随着异荭草素对菌体作用时间的延长,受试菌体细胞的相对渗透率持续增加,且处理2 h后受试菌体细胞的相对渗透率变化的速率明显升高,说明经过异荭草素处理的菌体细胞随着作用时间的延长,细胞内K+,Na+等电解质的渗出量不断增大,这些离子的丢失导致细胞内稳定的环境被破坏、细胞膜的流动性降低、多种代谢途径受阻和多种酶的活性受到影响,以及细胞内外渗透压的调节能力下降,使细胞失水或吸胀,从而起到抑菌作用[25]。8 h后相对渗透率逐渐持平,达到稳定状态。
AO-EB荧光染色结果见图6。

图6 AO-EB荧光染色结果
吖啶橙(AO)能透过胞膜完整的细胞,嵌入细胞核DNA,使之发出明亮的绿色荧光。溴乙锭(EB) 仅能透过胞膜受损的细胞,嵌入核DNA,发橘红色荧光。因此,可以根据AO/EB荧光标记观察细胞形态和膜完整性。异荭草素对鼠伤寒沙门氏菌形态的影响如图6所示。对照组菌体呈绿色,具有完整的膜结构;异荭草素处理组部分菌体呈橘红色荧光,该结果可进一步证明,异荭草素处理可通过破坏细菌的细胞膜完整性,进而抑制细菌生长。
2.4 异荭草素对鼠伤寒沙门氏菌菌体可溶性蛋白质的影响测定结果
按照考马斯G250法测定,异荭草素对菌体可溶性蛋白质的影响测定结果。
异荭草素对鼠伤寒沙门氏菌蛋白的影响见图7。
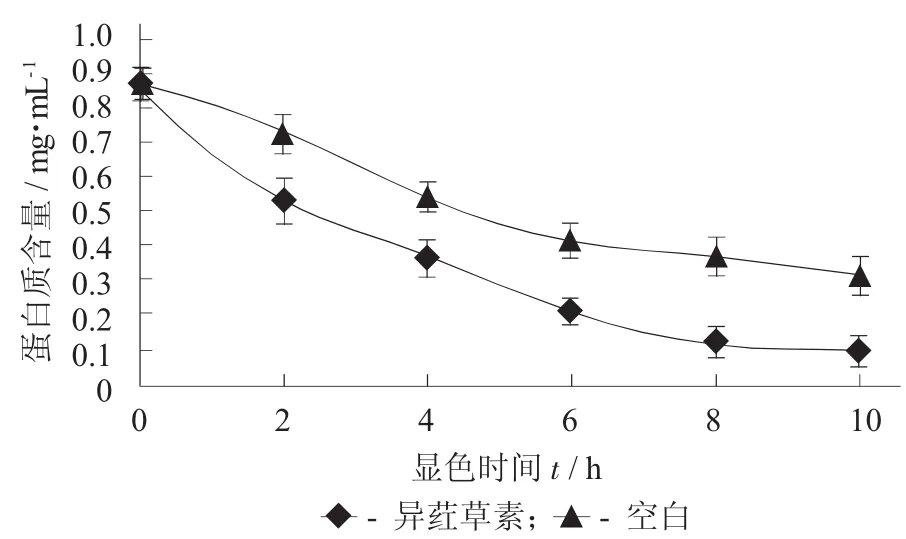
图7 异荭草素对鼠伤寒沙门氏菌蛋白的影响
菌体内的可溶性蛋白主要是参与代谢的各种酶类,菌体在生长过程中会产生分泌性蛋白,这些蛋白会通过渗透作用穿过细胞膜进入到菌液中,测量其含量可了解菌体细胞内总代谢的变化[26-27]。由图7可知,经异荭草素处理后,受试菌液中可溶性蛋白质含量下降。处理2 h后可溶性蛋白质含量下降较为明显,处理8 h后,受试菌液中可溶性蛋白质含量基本保持不变,其原因可能为随着处理时间的增加异荭草素的抑菌效果降低,同时有部分菌体继续生长代谢产生可溶性蛋白。研究表明,异荭草素可抑制受试菌体中蛋白质的合成,进而产生抑菌作用,当处理时间为8 h时抑制效果最为明显。
2.5 异荭草素对鼠伤寒沙门氏菌总核酸泄露的影响测定结果
异荭草素对鼠伤寒沙门氏菌总核酸的影响见图8。
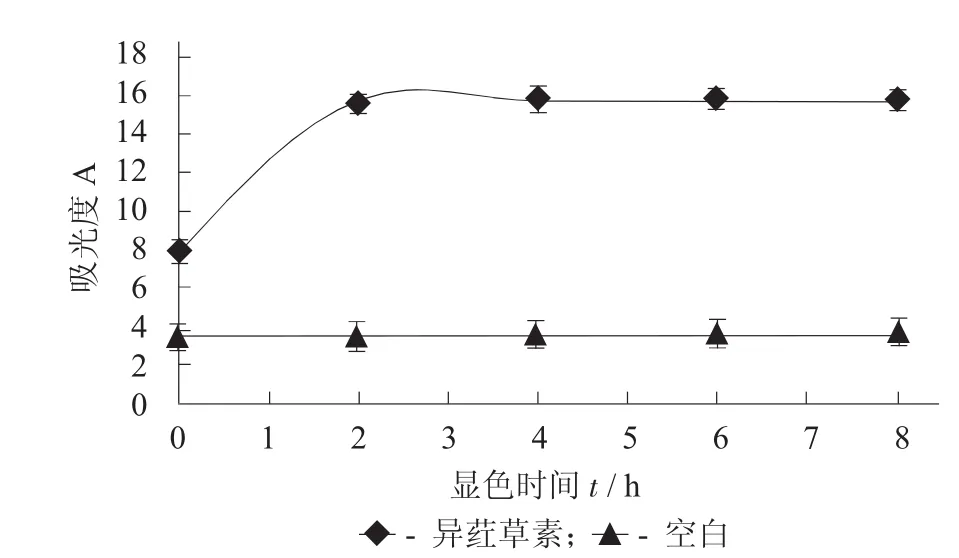
图8 异荭草素对鼠伤寒沙门氏菌总核酸的影响
由图8可以看出,空白组菌液中核酸含量相当且始终保持不变,而异荭草素处理组菌液中吸光度值逐渐增加,且在作用后2 h达到最大值,之后趋于稳定。结果表明,异荭草素作用可严重破坏细菌细胞膜通透性和完整性,使细菌内部的核酸穿过细胞膜进入到细菌外部菌液中。
3 结论
滤纸片法试验结果表明,异荭草素鼠伤寒沙门氏菌有较强的抑制效果,且异荭草素浓度与对鼠伤寒沙门氏菌的抑菌效果有正相关关系。通过测定菌体生长曲线、电导率、生长代谢、细胞膜通透性、菌体蛋白质含量和菌体总核酸的泄露,初步弄清了异荭草素对菌体细胞的抑制机制。异荭草素不仅使菌体蛋白质合成的速度受到抑制,菌体总核酸泄露严重,还使菌体细胞膜的通透性发生变化,最终导致受试菌体内电解质渗漏,细菌增殖被抑制,菌体死亡。
[1]窦妍,翟延君,佟苗苗,等.HPLC测定不同采收期荭草中荭草素、异荭草素的含量 [J].中国实验方剂学杂志,2012,18 (2):62-64.
[2]Tunalier Z,Kosar M,Kupeli E,et al.Antioxidant,antiinflammatory,anti-nociceptive activities and composition of Lythrum salicaria L.extracts[J].Ethnopharmacol,2007(3):539-547.
[3]Yong-Chun J L,Y Yuan K.A novel high-performance liquid chromatography fingerprint approach to discriminate Phyllostachys pubescens from China[J].Pharmacogn Mag,2012(8):42-48.
[4]Zeraik M L,Yariwake J H,Wauters J N,et al.Analysis of passion fruit rinds (passiflora edulis):isoorientin quantification by hptlc and evaluation of antioxidant(radical scavenging) capacity[J].Quimica Nova,2012,35 (3):541-545.
[5]Yuan L,Wang J,Wu W Q,et al.Effect of isoorientin on intracellular antioxidant defence mechanisms in hepatoma and liver cell lines[J].Biomedicine&Pharmacotherapy,2016 (5):356-362.
[6]Yuan L,Wang J,Xiao H F,et al.MAPK signaling path-ways regulate mitochondrial-mediated apoptosis induced by isoorientin in human hepatoblastoma cancer cells[J].Food and Chemical Toxicology,2013,53 (3):62-68.
[7]Deepha V,Praveena R,Sadasivam K.DFT studies on antioxidant mechanisms, electronic properties, spectroscopic(FT-IR and UV) and NBO analysis of C-glycosyl flavone,an isoorientin[J].Journal of Molecular Structure,2015 (10):131-142.
[8]Lim J H,Park H S,Choi J K,et al.Isoorientin induces Nrf2 pathway-driven antioxidant response through phosphatidylinositol 3-kinase signaling[J].Archives of Pharmacal Research,2007,30(12):1 590-1 598.
[9]Lee W,Ku S K,Bae J S.Vascular barrier protective effects of orientin and isoorientin in LPS-induced inflammation in vitro and in vivo[J].Vascular Pharmacology,2014,62 (1):3-14.
[10]Sumalatha M,Munikishore R,Rammohan A,et al.Soorientin, a selective inhibitor of Cyclooxygenase-2 (COX-2)from the tubers of Pueraria tuberosa[J].Natural Product Communications,2015,10 (10):1 703-1 704.
[11]Huang Q F,Zhang S J,Zheng L,et al.Protective effect of isoorientin-2''-O-alpha-L-arabinopyranosyl isolated from Gypsophila elegans on alcohol induced hepatic fibrosis in rats[J].Food and Chemical Toxicology, 2012, 50(6):1 992-2 001.
[12]Lin X,Chen Y X,Lv S J, et al.Gypsophila elegans isoorientin attenuates CCl4-induced hepatic fibrosis in rats via modulation of NF-kappa B and TGF-beta 1/Smad signaling pathways[J].International Immunopharmacology,2015,28 (1):305-312.
[13]Yuan L,Han X,Li W F,et al.Isoorientin prevents hyperlipidemia and liver injury by regulating lipid meta-bolism,antioxidant capability,and inflammatory cytokine release in high-fructose-fed mice[J].Journal of Agricultural and Food Chemistry,2016,64 (13):2 682-2 689.
[14]Alonso-Castro A J,Zapata-Bustos R,Gomez-Espinoza G,et al.Isoorientin Reverts TNF-alpha-Induced Insulin Resistance in adipocytes activating the insulin signaling pathway[J].Endocrinology,2012 (11):5 222-5 230.
[15]陆至科.竹叶生物活性成分提取分离及其抗菌活性研究[D].株洲:中南林学院,2004.
[16]刘晓莉,姜少娟.陈艾抑菌活性的初步研究 [J].安徽农业科学,2010,38(35):20 023-20 024.
[17]唐金花.苦参等中草药的抑菌作用、机制研究及对鸡大肠杆菌病的防治效果分析 [D].辽宁:辽宁师范大学,2006.
[18]黄聪华.芒萁抑菌有效成分的提取及抑菌机理研究 [D].广州:广东工业大学,2013.
[20]Li L,Song X,Yin Z.Q,et al.The antibacterial activity and action mechanism of emodin from Polygonum cuspidatum against Haemophilus parasuis in vitro[J].Microbiological Research,2016(5):139-145.
[21]张新虎,何静,沈慧敏.苍耳提取物对番茄灰霉病菌的抑制作用及抑菌机理初探 [J].草业学报,2008,17(3):99-104.
[22]刘伟.姜酚抑菌作用及姜醋-壳聚糖复合膜性质与应用研究 [D].北京:中国农业大学,2015.
[23]涂璇,薛秀园,涂国全.红谷霉素对金黄色葡萄球菌抑菌机制的研究 [J].天然产物研究与开发,2011,23(1):153-158.
[24]侯媛媛.大黄和黄芩抑菌活性物质追踪及其抑菌机理研究 [D].上海:上海海洋大学,2015.
[25]蒲忠慧.青刺果体外抑菌活性及其活性物质的分离纯化与作用机制研究 [D].雅安:四川农业大学,2009.
[26]刘笑宇.肉桂精油的抑菌作用、抑菌机理及其在酱牛肉防腐中的应用 [D].上海:上海应用技术学院,2015.
[27]云宝仪,周磊,谢鲲鹏,等.黄芩素抑菌活性剂其机制的初步研究 [J].药学学报,2012,47(12):1 587-1 592.◇
