氧化大豆分离蛋白对鲤鱼肌原纤维蛋白乳化性和凝胶性的影响
2018-03-16李艳青陈洪生俞龙浩王鹤霖郭希娟
李艳青,陈洪生,俞龙浩,杨 楠,王鹤霖,郭希娟
(黑龙江八一农垦大学食品学院,黑龙江大庆 163319)
我国淡水鱼资源极为丰富,但加工利用率不足1%,由于淡水鱼自身营养成分特点,导致了较难凝胶化,因此限制了淡水鱼糜制品的开发。为了加大淡水鱼的开发利用,提高其凝胶性能,目前常用亲水胶体和淀粉作为填充物,但过量添加不但降低了鱼糜制品营养特性,还会影响口感[1]。大豆分离蛋白作为一种植物蛋白,因胆固醇含量低、营养价值高等特点,受到了消费者的青睐,同时因其良好的功能性质和较低的成本,而常作为非功能性填充料或功能性添加剂广泛应用于食品加工中[2]。因此,将大豆分离蛋白用于淡水鱼糜制品既可以作为填充物又可以强化营养,有较好的应用前景[3]。
试验以我国主要淡水鱼品种鲤鱼为研究对象,分析大豆分离蛋白经过适当氧化变性处理后对肌原纤维蛋白乳化性能和凝胶性质的影响,为大豆分离蛋白在鱼糜制品中的合理应用及改善淡水鱼糜品质提供理论参考。
1 材料与方法
1.1 材料与试剂
新鲜活鲤鱼,购于大庆农贸市场,宰杀后取白色肌肉待用;所用天然大豆分离蛋白、化学试剂均为分析纯,购于大庆博远试剂公司。
1.2 仪器设备
TA-XT plus型质构分析仪,英国Stable Micro System公司产品;CR-410型色彩色差仪,日本KONICA MINOLTA产品;UV-6000型紫外分光光度计,上海元析仪器有限公司产品;T18型匀浆机,德国IKA公司产品。
1.3 试验方法
1.3.1 鲤鱼肌原纤维蛋白的提取及氧化大豆分离蛋白制备
肌原纤维蛋白提取参照Chin K B等人[4]和Jiang X J等人[5]的方法,并进行适当修改。将鱼肉搅碎,加入4倍体积的20 mmol/L的冰磷酸盐缓冲溶液(pH值7.5),经3次漂洗、冷冻离心(8 000 g,10 min) 后所得沉淀为肌原纤维蛋白样品,用双缩脲法测定其蛋白含量。
氧化大豆分离蛋白制备:取大豆分离蛋白经羟自由基氧化系统(氧化系统含FeCl31 mmol/L,抗坏血酸0.1 mmol/L和H2O21 mmol/L) 氧化5 h后冻干,粉碎备用。
1.3.2 试验设计
将上述提取的鲤鱼肌原纤维蛋白分别加入10%,20%,30%,40%,50%的天然大豆分离蛋白(对照)和项目自制的氧化大豆分离蛋白,测定其乳化性和凝胶性。
1.3.3 肌原纤维蛋白乳化性的测定
肌原纤维蛋白的乳化性质的测定采用浊度法[6]。肌原纤维蛋白匀浆液的乳化活性EAI(m2/g)和乳化稳定性ESI(%),分别由下面公式来表示:
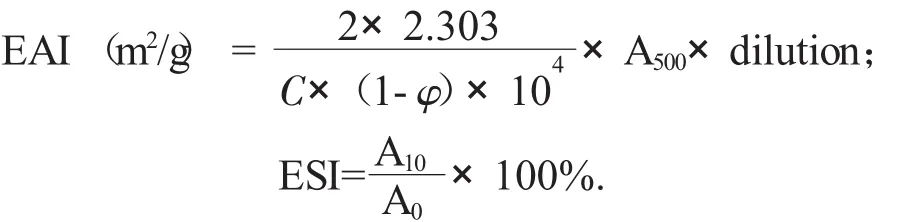
式中:A500——500 nm处的吸光度;
φ——油相体积分数(V/V) (φ=0.25);
C——蛋白质浓度,mmol/L;
A0,A10——乳状液在0,10 min的吸光度。
1.3.4 肌原纤维蛋白凝胶的制备及质地分析
将氧化后肌原纤维蛋白稀释到40 mg/mL,于80℃下水浴30 min后形成凝胶置于4℃过夜后备用。
测量质构时,先取出样品,在室温下放置30 min后,再利用物性分析仪进行测量。测定模式选择测试前速度5mm/s,测试速度1mm/s,测试后速度5mm/s,下压距离10 mm,引发力5 g,探头型号P/0.5。
1.3.5 凝胶保水性的测定
参照Salvador P等人[7]的方法并进行适当修改。称取5 g鲤鱼肌原纤维蛋白凝胶样品,经离心后,称量离出水质量。凝胶持水性(Water-Holding Capacity,WHC)利用下式计算。每个样品重复3次,取平均结果。

1.3.6 凝胶白度的测定
凝胶的白度值用日本CR-410型色彩色差仪测定其L*值、a*值和b*值。计算公式按Park J[8]的方法来计算,公式如下:
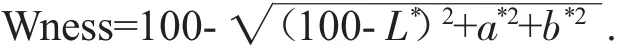
2 结果与分析
2.1 对鲤鱼肌原纤维蛋白乳化性的影响
乳化能力 (EAI) 和乳化稳定性 (ESI) 是衡量蛋白质溶液与添加油脂之间的作用能力,对鱼糜制品的保油能力有极大的影响[9]。
添加大豆分离蛋白对鲤鱼肌原纤维蛋白乳化活性和乳化稳定性的影响见图1。
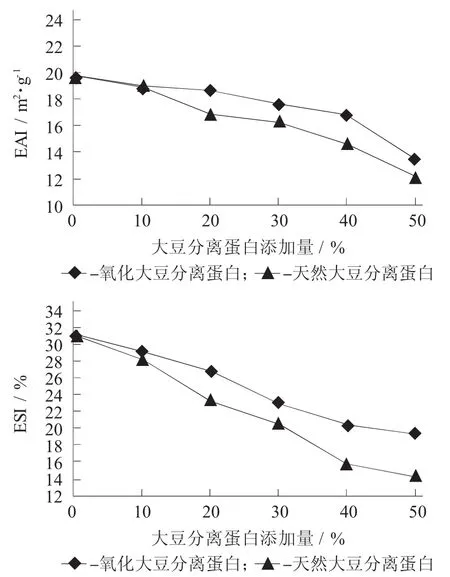
图1 添加大豆分离蛋白对鲤鱼肌原纤维蛋白乳化活性和乳化稳定性的影响
由图1可以看出,随着2种大豆分离蛋白添加量的增加,鲤鱼肌原纤维蛋白的乳化能力和乳化稳定性均呈下降趋势,说明大豆分离蛋白的加入破坏了肌原纤维蛋白形成乳浊液的能力,但少量添加氧化大豆分离蛋白对肌原纤维蛋白乳化能力破坏较小,可能是由于适度氧化会导致大豆分离蛋白疏水基团的暴露,可以与肌原纤维蛋白相互作用形成相对较稳定的体系。而随着氧化的大豆分离蛋白添加量的增加,这种稳定的状态被破坏,从而导致乳化活力和乳化稳定性的下降[10]。
2.2 对鲤鱼肌原纤维蛋白凝胶性的影响
2.2.1 对鲤鱼肌原纤维蛋白凝胶质地的影响
添加大豆分离蛋白对鲤鱼肌原纤维蛋白凝胶硬度和弹性的影响见图2。

图2 添加大豆分离蛋白对鲤鱼肌原纤维蛋白凝胶硬度和弹性的影响
添加2种大豆分离蛋白后鲤鱼肌原纤维蛋白形成凝胶的硬度均有所下降,并随着大豆分离蛋白添加量的增加下降越来越严重,可能是由于大豆分离蛋白添加量过大,稀释了肌原纤维蛋白的浓度,影响了蛋白质之间的交互作用,因此导致凝胶硬度下降。但添加大豆分离蛋白后,肌原纤维蛋白凝胶的弹性变化趋势稍有不同,表现在当氧化大豆分离蛋白添加量小于20%时,凝胶的弹性略有上升,随后呈下降趋势。肌原纤维蛋白加入少量氧化后的大豆分离蛋白后,凝胶弹性的增加可能是由于氧化后大豆分离蛋白形成衍生物与鲤鱼肌原纤维蛋白通过二硫键或其他的化学键结合,形成了一种更有弹性的网状结构。
2.2.2 对鲤鱼肌原纤维蛋白凝胶保水性的影响
添加大豆分离蛋白对鲤鱼肌原纤维蛋白凝胶保水性的影响见图3。
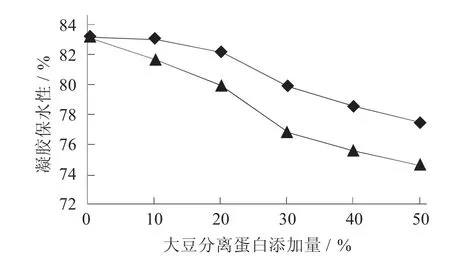
图3 添加大豆分离蛋白对鲤鱼肌原纤维蛋白凝胶保水性的影响
由图3可以看出,鲤鱼肌原纤维蛋白凝胶保水能力随着大豆分离蛋白的增加均有所降低,但添加氧化大豆分离蛋白和天然大豆分离蛋白后的凝胶保水性下降程度不同,且差异显著(p<0.05),添加氧化大豆分离蛋白的蛋白凝胶保水性一直优于添加天然大豆分离蛋白的凝胶保水性,且当氧化大豆分离蛋白的添加量小于20%时,凝胶的保水性变化差异不大。
凝胶保水性的降低与凝胶结构的变化是密不可分的。凝胶中很多水是通过氢键结合至肽键的C=O和N-H基团,以水合的形式与带电基团缔合,或广泛地存在于通过氢键形成的水-水网[11]。当向肌原纤维凝胶中添加大豆分离蛋白后,大豆分离蛋白稀释了肌原纤维蛋白浓度,并阻碍了水分与肌原纤维蛋白之间氢键的形成,因此导致试验结果中凝胶保水性的下降,但少量添加氧化大豆分离蛋白,凝胶保水性下降不明显,还有待于进一步研究原因。
2.3 对鲤鱼肌原纤维蛋白凝胶白度值的影响
添加大豆分离蛋白对鲤鱼肌原纤维蛋白凝胶白度值的影响见图4。
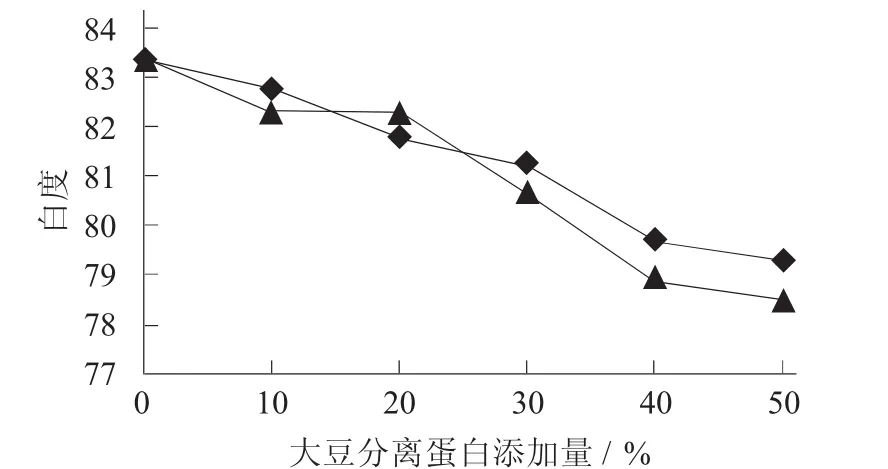
图4 添加大豆分离蛋白对鲤鱼肌原纤维蛋白凝胶白度值的影响
在凝胶白度值的试验中发现,随着大豆分离蛋白添加量的增加,鲤鱼肌原纤维蛋白凝胶的白度呈降低趋势。当添加量小于30%时,添加天然大豆分离蛋白和氧化后的大豆分离蛋白的差异不显著(p<0.05);当添加量大于30%时,添加氧化大豆分离蛋白的凝胶白度值下降比较严重,可能是由于氧化引起了大豆分离蛋白自身颜色的改变,所以添加量过大时会影响到鲤鱼肌原纤维蛋白凝胶的白度值,因此为提高鱼糜凝胶白度值,要合理控制大豆分离蛋白的添加量。
3 结论
试验将经自由基氧化系统氧化后的大豆分离蛋白和天然大豆分离蛋白添加到鲤鱼肌原纤维蛋白中,测定其蛋白乳化性和凝胶性。结果表明,添加2种大豆分离蛋白均会引起肌原纤维蛋白质乳化活性和乳化稳定性的降低,鲤鱼肌原纤维蛋白凝胶的保水性、硬度和弹性降低。但少量添加(≤20%)氧化大豆分离蛋白对肌原纤维蛋白质功能性破坏相对较小,在实际生产中可以适量添加到鱼糜制品中,提高产品品质。
[1]王玲娣,张坤生,任云霞.大豆分离蛋白对鲢鱼肌原纤维蛋白凝胶特性的影响 [J].食品研究与开发,2011,32(10):30-33.
[2]金牧,何志勇,熊幼翎,等.改性大豆分离蛋白对法兰克福香肠品质的影响 [J].食品与机械,2010,26(1):1-4.
[3]王苑.不同处理方式对肌原纤维蛋白和大豆分离蛋白混合凝胶特性的影响 [D].南京:南京农业大学,2007.
[4]Chin K B,Go M Y,Xiong Y L.Konjac flour improved textural and water retention properties of transglutaminasemediated, heat-induced porcine myofibrillar protein gel:Effect of salt level and transglutaminase incubation[J].Meat Science,2009(3):565-572.
[5]Jiang X J,Zhang Z J,Cai H N,et al.The effect of soybean trypsin inhibitor on the degradation of myofibrillar proteins by an endogenous serine proteinase of crucian carp[J].Food Chemistry,2006(4):498-503.
[6]Agyare K K,Addo K,Xiong Y L.Emulsifying and foaming properties of transglutaminase-treated wheat gluten hydrolysate as influenced by pH,temperature and salt[J].Food Hydrocolloids,2009,23 (1):72-81.
[7]Salvador P,Toldrà M,Saguer E,et al.Microstructurefunction relationships of heat-induced gels of porcine haemoglobin[J].Food Hydrocolloids,2009,23(7):1 654-1 659.
[8]Park J.Functional protein additives in surimi gels[J].Journal of Food Science,1994,59 (3):525-527.
[9]莫重文.蛋白质化学与工艺学 [M].北京:化学工业出版社,2007:82-90.
[10]Karim A A,Bhat R.Fish gelatin:properties,challenges,and prospects as an alternative to mammalian gelatins[J].Food Hydrocolloids,2009,23 (3):563-576.
[11]Owen R.Fennema著.食品化学 [M].第3版.王璋,许时婴,江波,等译.北京:中国轻工业出版社,2003:123-140.◇
