αGVHD小鼠靶器官组织TLR4/MyD88/NF-κB信号通路蛋白表达变化及意义
2018-03-15江洋洋涂三芳吴远彬李玉华
江洋洋,涂三芳,吴远彬,李玉华
(1南方医科大学珠江医院,广州510282;2广东省中医院)
异基因骨髓移植(allo-BMT)是治疗白血病、淋巴瘤等恶性肿瘤的重要方法[1]。但移植物抗宿主病(GVHD)是阻碍allo-BMT发展的一个巨大障碍[2]。近年来,从天然免疫出发探索GVHD治疗的新靶点是国内外研究的热点[3,4]。研究证实,Toll样受体(TLRs)及其相关信号通路在免疫反应的诱发阶段发挥关键作用,而髓样分化蛋白88(MyD88)分子作为其最重要的信号接头分子,在TLR家族多个亚型的信号传递中均发挥举足轻重的作用。与其他TLR亚型活化诱发炎症过程相似,TLR4通过识别硫酸乙酰肝素[5]和细菌脂多糖[6]等移植前预处理损伤引发的内、外源性危险信号,使抗原提呈细胞(APCs)或组织上皮细胞质内的MyD88配体分子及下游一系列效应分子被激活,最终导致核转录因子κB(NF-κB)转录增强,引发炎性瀑布效应。目前对发生GVHD病变的靶器官组织中TLR4信号通路关键分子的表达情况及意义报道较少。2015年1月~2017年1月我们进行本研究,旨在探讨allo-BMT后急性移植物抗宿主病(aGVHD)小鼠模型靶器官组织TLR4/MyD88/NF-κB信号通路蛋白的表达变化及意义。
1 材料与方法
1.1 材料 SPF级C57BL/6(H-2Kb)雄性小鼠15只,6~8周龄,体质量17~20 g;SPF级BALB/c(H-2Kd)雌性小鼠35只,7~8周龄,体质量18~20 g;SPF级BALB/c(H-2Kd)雄性小鼠15只,7~8周龄,体质量18~20 g;均购自南方医科大学实验动物中心。动物分笼饲养、自然光照,动物房内温度(22±2)℃,相对湿度50%左右。小鼠饲料、垫料及饮用水均经过高压灭菌,从预处理前1周开始在小鼠饮用水中加入庆大霉素(320 mg/L)进行肠道准备。白舒非(中国协和发酵麒麟制药有限公司);环磷酰胺(美国Baxter公司);兔抗TLR4多克隆抗体,兔抗MyD88、NF-κB p65、NF-κB p50单克隆抗体(美国Abcam公司);山羊抗兔IgG/HRP聚合物(上海碧云天生物技术有限公司);DAB显色试剂盒(武汉博士德生物技术有限公司);TRIzol、逆转录试剂盒(美国Sigma公司);实时荧光定量试剂盒(美国Thermo Fisher Scientific公司);聚合酶链反应(PCR)引物由上海英潍捷基公司合成。
1.2 小鼠allo-BMT后aGVHD模型建立及鉴定
1.2.1 建模方法 取30只BALB/c雌性小鼠为受鼠,15只建立aGVHD模型(aGVHD组):移植前5~8天腹腔注射白舒非17.5 mg/(kg·d),移植前3~4天腹腔注射环磷酰胺100 mg/(kg·d)进行预处理,移植当天经尾静脉注射C57BL/6雄性小鼠骨髓细胞1.5×107个/只+脾脏细胞2×107个/只。15只建立同基因骨髓移植(Syn-BMT)对照组(Syn-BMT组):经尾静脉注射BALB/c雄性小鼠骨髓细胞1.5×107个/只。
1.2.2 模型鉴定 ①一般情况:aGVHD组移植后6天开始出现精神萎靡、弓背姿势、翘毛,并逐渐加重;体质量进行性下降;肛周皮肤轻度破溃并逐渐加重,部分出现腹泻、血便。移植后8天开始出现腹部脱毛并逐渐加重,14天时大部分小鼠全身多处脱毛,以腹部明显。移植后6天小鼠开始出现死亡(3只),80%(12只)的小鼠在30天内死亡,并于37天内全部死亡,中位生存时间为15天。Syn-BMT组移植后2天内体质量逐渐下降,移植3天后体质量开始逐渐上升,于14天左右体质量上升至正常小鼠水平;且活动正常,无弓背姿势,无肛周皮肤破溃,无脱毛等aGVHD表现;中位生存时间为60天。②病理学观察:移植后7天,分别取两组(各取5只小鼠)肝、肠、脾及皮肤组织行HE染色,镜下观察。结果显示,与Syn-BMT组相比,aGVHD组镜下肝脏血管周围炎症细胞浸润,汇管区扩张,淋巴细胞浸润明显,部分肝细胞变性坏死,结构破坏;肠道隐窝细胞坏死,肠黏膜固有层水肿,部分糜烂、溃疡甚至黏膜剥脱,淋巴细胞浸润,绒毛变钝,凹陷减少;脾脏嗜酸性粒细胞浸润,脾索、脾窦组织增生,浆细胞浸润,纤维组织增生明显;皮肤表皮坏死,真皮层水肿,淋巴细胞浸润,皮肤附属器明显减少。上述结果提示,典型的aGVHD模型建立。
1.3 肝、肠、脾及皮肤组织TLR4、MyD88、NF-κB p50及NF-κB p65 mRNA表达检测 采用实时荧光定量PCR法。两组移植后第14天分别取5只存活小鼠,处死后取肝、肠、脾及皮肤组织,提取组织RNA,紫外分光光度仪检测其纯度,5%琼脂糖电泳鉴定条带正确。使用逆转录试剂盒将RNA逆转录为cDNA,加入各待测目的基因及管家基因引物进行扩增反应。各基因引物序列(5′-3′)分别为:β-actin上游引物CGTTGACATCCGTAAAGAC,下游引物TGGAAGGTGGACAGTGAG,产物长度201 bp;NF-κB p50 上游引物ATGGCAGACGATGATCCCTA-C,下游引物CGGAATCGAAATCCCCTCTGTT,产物长度167 bp;NF-κB p65上游引物TGCGATTCCGCTATAAATGCG,下游引物ACAAGTTCATGTGGATGAGGC,产物长度178 bp;MyD88上游引物TCATGTTCTCCATACCCTTGGT,下游引物AAACTGCGAG-TGGGGTCAG,产物长度175 bp;TLR4上游引物ATGGCATGGCTTACACCACC, 下游引物GAGGCCAAT-TTTGTCTCCACA,产物长度129 bp。PCR反应条件:95 ℃预变性10 min,95 ℃ 15 s、60 ℃ 1 min(40个循环)。采用2-ΔΔCT法计算各基因mRNA相对表达量。
1.4 小鼠肝、肠、脾及皮肤组织中TLR4、MyD88、NF-κB p50及NF-κB p65蛋白表达检测 ①免疫组化法:取1.3中两组肝、肠、脾及皮肤组织置于多聚甲醛中固定,石蜡包埋并切片,3% H2O2室温封闭10 min,热修复抗原,滴加5%牛血清白蛋白(BSA)封闭液室温封闭30 min;滴加一抗(TLR4抗体稀释100倍、NF-κB p50抗体稀释250倍、NF-κB p65抗体稀释250倍、MyD88抗体稀释250倍),4 ℃过夜;PBS清洗后滴加生物素化山羊抗兔IgG,37 ℃孵育30 min;DAB溶液显色,苏木素复染;脱水,透明,封片,镜检。细胞膜(TLR4)、细胞质(MyD88)、细胞核(p65,p50)呈棕黄色且背景清晰者为阳性,统计阳性表达率。②Western blotting法:采用蛋白提取试剂盒提取各组肝、肠、脾及皮肤组织中的蛋白,BCA法测定蛋白浓度。10% SDS-PAGE凝胶电泳,蛋白分离后电转移至PVDF膜上,5%脱脂奶粉封闭2 h,洗净封闭液后加一抗(TLR4抗体稀释1∶500,MyD88抗体稀释1∶1 000,NF-κB p65和NF-κB p50抗体稀释1∶1 000)恒温摇床4 ℃孵育过夜,加入羊抗兔二抗(稀释1∶10 000)摇床常温孵育1h,洗涤后使用增强化学发光(ECL)显色试剂盒及X线片曝光显影,应用凝胶成像分析系统摄像分析。采用图像软件Image J分析结果,TLR4、MyD88、NF-κB p65和NF-κB p50条带与对应的β-actin条带灰度值的比值作为蛋白相对表达量。
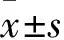
2 结果
2.1 两组各组织TLR4、MyD88、NF-κB p50及NF-κB p65 mRNA表达比较 aGVHD组肝、肠、脾和皮肤组织中TLR4、MyD88、NF-κB p50及NF-κB p65 mRNA相对表达量均高于Syn-BMT组(P均<0.05)。见表1。
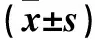
表1 两组各组织TLR4、MyD88、NF-κB p50及NF-κB p65mRNA相对表达量比较
注:与Syn-BMT组同组织比较,*P<0.05。
2.2 两组各组织中TLR4、MyD88、NF-kBp50及NF-kBp65蛋白表达比较 aGVHD组肝、肠、脾和皮肤组织中TLR4、MyD88、NF-κB p50及NF-κB p65阳性表达率及蛋白相对表达量均高于Syn-BMT组(P均<0.05)。见表2、3。
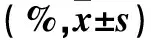
表2 两组各组织TLR4、MyD88、NF-κB p50及NF-κB p65蛋白阳性表达率比较
注:与Syn-BMT组同组织比较,*P<0.05。
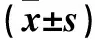
表3 两组各组织TLR4、MyD88、NF-κB p50及NF-κB p65蛋白相对表达量比较
注:与Syn-BMT组同组织比较,*P<0.05。
3 讨论
GVHD是allo-BMT后最主要的并发症,病死率高。在造血干细胞移植前,放疗或化疗等预处理、感染及患者基础疾病等因素导致的血管内皮及上皮损伤均可引发损伤相关分子(DAMPs)大量释放;亦会使患者肠道菌群失衡并释放大量病原体相关分子(PAMPs)[7]。PAMPs及DAMPs是诱发GVHD启动最重要的两种危险信号,分别被模式识别受体分子(PRRs)中不同种类的TLRs识别,通过非MyD88依赖性及MyD88依赖性两种信号途径向下游传导信号,最终使细胞质中NF-κB入核增加,转录增强,释放更多的促炎性因子,进而产生“细胞因子风暴”效应[8]。大多数PRRs存在于受者与供者的抗原提呈细胞(APC)中,包括树突状细胞(DC)亚群、中性粒细胞、单核细胞、巨噬细胞和自然杀伤细胞等,而一些则分布在上皮细胞和器官实质细胞。研究表明,同种异体活化T细胞和自体活化T细胞激活均是引起GVHD的重要原因[9,10],提示T细胞激活可能是引起GVHD的主要原因。抗原提呈细胞表面表达多种TLRs受体,当TLRs受体与其配体结合后,使细胞表面的共刺激分子和MHC分子表达上调,促进APC成熟并分泌更多的细胞因子,导致T细胞激活[11],引发T细胞对宿主靶组织和器官的攻击。TLRs及其相关信号通路在免疫反应的诱发阶段发挥关键作用。在GVHD过程中,抗原提呈细胞上的TLR4可结合多种内、外源性危险信号。MyD88分子作为其最重要的信号接头分子,在TLR4信号传递过程中发挥举足轻重的作用。TLR4依赖于其配体蛋白进行信号传导,最终激活NF-κB转录。由此可见,放化疗等预处理损伤免疫细胞、内皮细胞及肠道上皮细胞,导致肠道菌群移位并释放大量炎症因子,使TLR4/MyD88/NF-κB信号通路在天然免疫细胞中激活。此通路活化后组织细胞的炎性内环境进一步恶化,天然免疫及获得性免疫系统被同时激活。
关于TLR4/MyD88/NF-κB信号通路蛋白在GVHD肝、肠、脾、皮肤等靶器官组织中的表达水平以往研究中甚少报道,且在国际上仍颇具争议。有研究表明,宿主TLR4在诱导组织保护因子和对抗肠道损伤中发挥重要作用[12]。在日本有研究者将受体小鼠TLR4基因敲除,并与野生型小鼠进行比较,表明受鼠TLR4可起到抗肠上皮凋亡,防止GVHD的发生[13]。此外,有研究者在移植前预防性使用抗生素,以减弱宿主肠道内PAMPs产生,减少TLR4活化,最终可延缓GVHD进展[14]。还有研究发现,使用内源性TLR4激动剂使宿主细胞TLR4表达增强可促进GVHD进展[15]。另一方面,意大利学者报道,TLR4基因敲除受鼠与野生型小鼠的生存率及临床评分并无差异,提示受者TLR4在GVHD的发病中并无重要作用[16]。本研究结果显示,aGVHD模型小鼠肝、肠、脾和皮肤组织中TLR4/MyD88/NF-κB信号通路蛋白在基因水平和蛋白水平均表达上调,提示该信号通路可能参与了aGVHD的发病过程,TLR4、MyD88、NF-κB可能成为GVHD的治疗靶点,但该通路参与GVHD发生、发展的分子生物学机制仍需进一步探讨。
[1] Copelan EA. Hematopoietic stem-cell transplantation [J]. N Engl J Med, 2006,354(17):1813-1826.
[2] Magenau J, Runaas L, Reddy P. Advances in understanding the pathogenesis of graft-versushost disease[J]. Br J Haematol, 2016,173(2):190-205.
[3] Gupta V, Ball SE, Sage D, et al. Marrow transplants from matched unrelated donors for aplastic anaemia using alemtuzumab, fludarabine and cyclophosphamide based conditioning[J]. Bone Marrow Transplant, 2005,35(5):467-471.
[4] Weisdorf D. Graft vs. host disease: pathology, prophylaxis and therapy: GVHD overview[J]. Best Pract Res Clin Haematol, 2008,21(2):99-100.
[5] Brennan TV, Lin L, Huang X, et al. Heparan sulfate, an endogenous TLR4 agonist, promotes acute GVHD after allogeneic stem cell transplantation[J]. Blood, 2012,120(14):2899-2908.
[6] Shin OS, Harris JB. Innate immunity and transplantation tolerance: the potential role of TLRs/NLRs in GVHD[J].Korean J Hematol, 2011,46(2):69-79.
[7] Zeiser R, Penack O, Holler E, et al. Danger signals activating innate immunity in graft-versus-host disease[J]. J Mol Med (Berl), 2011,89(9):833-845.
[8] Roach JM, Racioppi L, Jones CD, et al. Phylogeny of Toll-like receptor signaling: adapting the innate response[J]. PLoS One, 2013,8(1):e54156.
[9] Lee SJ, Vogelsang G, Flowers ME. Chronic graft-versus-host disease[J]. Biol Blood Marrow Transplant, 2003,9(4):215-233.
[10] Hess A, Thoburn C, Chen W, et al. Autoreactive T-Cell subsets in acute and chronic syngeneic graft-versus-host disease[J]. Transplant Proc, 2001,33(1-2):1754-1756.
[11] Shin OS, Harris JB. Innate immunity and transplantation tolerance: the potential role of TLRs/NLRs in GVHD[J]. Korean J Hematol, 2011,46(2):69-79.
[12] Fukata M, Michelsen KS, Eri R, et al. Toll-like receptor-4 is required for intestinal response to epithelial injury and limiting bacterial translocation in a murine model of acute colitis[J]. Am J Physiol Gastrointest Liver Physiol, 2005,288(5):1055-1065.
[13] Imado T, Iwasaki T, Kitano S, et al. The protective role of host Toll-like receptor-4 in acute graft-versus-host disease[J].Transplantation, 2010,90(10):1063-1070.
[14] Rakoff-Nahoum S, Paglino J, Eslami-Varzaneh F, et al. Recognition of commensal microflora by toll-like receptors is required for intestinal homeostasis[J]. Cell, 2004,118(2):229-241.
[15] Brennan TV, Lin L, Huang X, et al. Heparan sulfate, an endogenous TLR4 agonist, promotes acute GVHD after allogeneic stem cell transplantation[J]. Blood, 2012,120(14):2899-2908.
[16] Calcaterra C, Sfondrini L, Rossini A, et al. Critical role of TLR9 in acute graft-versus-host disease[J]. J Immunol, 2008,181(9):6132-6139.
