羧甲基化灵芝多糖预处理对大鼠脑缺血再灌注损伤的影响及其机制
2018-03-15李亚巍陈丽红韩丽琴周大朴刘盼金瑛朱文赫
李亚巍,陈丽红,韩丽琴,周大朴,刘盼,金瑛,朱文赫
(1吉林医药学院,吉林吉林132013;2吉林市儿童医院)
脑缺血再灌注损伤是指缺血脑组织在恢复血液灌注后其生理功能不但未能恢复,反而进一步加重。脑缺血再灌注损伤是多种脑血管疾病的诱因,其发生机制目前尚未完全阐明[1]。灵芝是多孔菌科真菌赤芝或紫芝的干燥子实体,具有滋补固本、强健体魄等功效[2,3]。灵芝的活性成分包括灵芝多糖(GLP)、灵芝酸和腺苷等[4],其中GLP是一种由葡萄糖、肽多糖、杂多糖等组成的混合物[5],具有提高人体免疫力、抗病毒、抗肿瘤、抗氧化、保护神经细胞、调节血脂、降血糖、抗糖尿病等多种药理作用[6]。多糖的分子修饰有很多种方式,例如羧甲基化、硫酸酯化、烷基化、乙酰化等,其中羧甲基化修饰不仅能增大多糖的溶解度和电负性,还能提高其活性,且具有制备过程简单、成本低及无毒等优点[7]。目前国内外已有关于GLP对脑缺血再灌注损伤影响的报道[8],但关于羧甲基化灵芝多糖(CM-GLP)对脑缺血再灌注损伤的影响鲜见报道。为此,我们于2016年12月~2017年5月进行了如下研究。
1 材料与方法
1.1 材料 实验动物:清洁级雄性SD大鼠100只,2~3月龄,体质量200~250 g,购于吉林大学基础医学院医学实验动物中心,动物合格证号:SCXK-吉2008-0005。大鼠适应性喂养1周后进行实验,饲养条件:室温18~28 ℃、相对湿度62%~80%。主要药物:灵芝干燥子实体购于吉林市中药材市场,按照既往文献[9]的方法提取GLP;尼莫地平购于天津金耀药业有限公司。主要试剂:超氧化物歧化酶(SOD)、丙二醛(MDA)试剂盒以及TNF-α、IL-1、IL-6、NF-κB ELISA试剂盒均购于南京建成生物工程研究所;热休克蛋白70(HSP70)、磷酸化丝氨酸/苏氨酸蛋白激酶(p-Akt)抗体均购于美国Santa Cruza公司。其他试剂均为国产分析纯。主要仪器:550型酶标仪购于美国Bio-Rad公司,UV-4802型紫外可见分光光度计购于上海UNICO仪器有限公司,TGL-16G台式高速离心机购于上海安亭科学仪器厂,MTN-658自动生化分析仪购于长春市曼特诺医疗器械有限公司。
1.2 CM-GLP的制备及验证
1.2.1 CM-GLP的制备 根据文献[9]方法,精确称取适量一步醇沉的GLP,80 ℃干燥过夜后,置于平底烧瓶中。室温条件下缓慢加入氢氧化钠溶液(4.5 mol/L),搅拌溶解,碱化处理1 h。将42.5 g 氯乙酸溶于200 mL异丙醇中,边搅拌边缓慢滴加至反应液中,滴完后迅速升温至60 ℃反应2 h。将上层醇液倒出,下层水相中加入4倍体积的95%乙醇醇沉,并用少量水溶解。加入盐酸将反应体系pH值调至中性,再次加入4倍体积的95%乙醇醇沉,95%乙醇洗涤两次,最后经流水透析48 h,冷冻干燥后得到CM-GLP。
1.2.2 CM-GLP的验证 根据文献[9]方法,采用红外光谱检测CM-GLP的羧甲基化情况。红外光谱图显示,CM-GLP光谱中保留了GLP的红外特征吸收峰:3 321.81 cm-1为O-H的伸缩振动吸收峰,2 922.31 cm-1为C-H的伸缩振动吸收峰,1 031 cm-1左右的吸收峰为糖环上C-O-C醚键的不对称伸缩振动吸收峰,构成糖类的特征吸收峰;由于多糖分子间和分子内氢键的影响,C=O的非对称振动吸收峰向波数略低的方向移动,即1 594.03 cm-1为-COO-的非对称伸缩振动吸收峰,1 413.56 cm-1和1 376.81 cm-1为-COO-的对称伸缩振动吸收峰;证明羧甲基取代成功。证实成功制备CM-GLP。CM-GLP的红外光谱见图1。
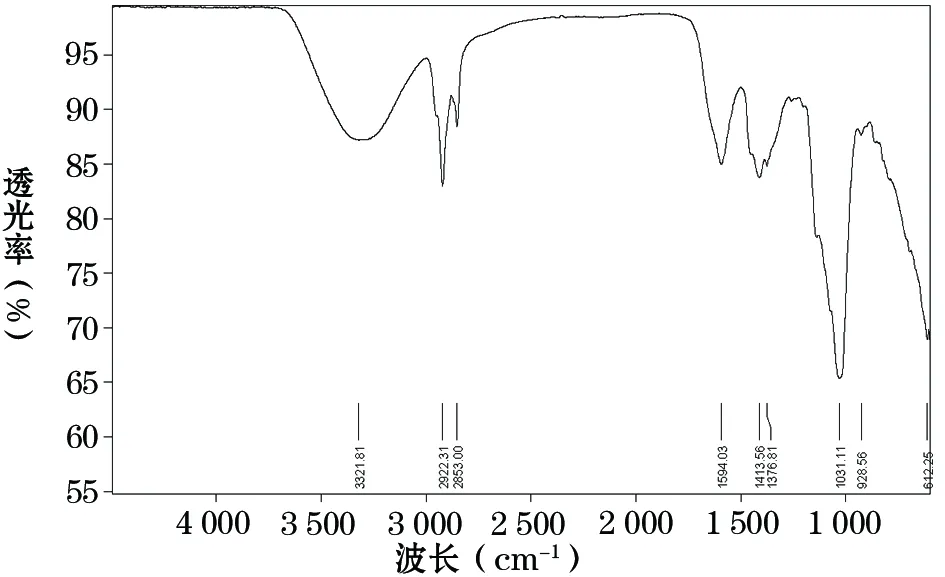
图1 CM-GLP的红外光谱图
1.3 造模与分组处理 将100只SD大鼠随机分为假手术组、模型组、GLP组、CM-GLP组及尼莫地平组,每组20只。GLP组腹腔注射GLP 40 mg/(kg·d),CM-GLP组腹腔注射CM-GLP 40 mg/(kg·d),尼莫地平组腹腔注射尼莫地平1 mg/(kg·d),假手术组和模型组腹腔注射等体积生理盐水。各组用药均为1次/d,连续注射7 天。除假手术组外,其余各组均于末次给药2 h采用改良线栓法[10]建立脑缺血再灌注模型。方法如下:5%水合氯醛腹腔注射麻醉,分离右侧颈总动脉、颈外动脉和颈内动脉;用动脉夹夹住颈总动脉近心端,远心端处用手术线打结,将颈总动脉剪开一切口;将顶端钝圆的MACO栓线插入颈内动脉18 mm,遇到阻力停止,手术线固定栓线、缝合。缝合2 h后轻轻提拉所留线头至略有阻力,以实现再灌注。假手术组只进行麻醉和血管分离,不结扎血管及插入栓线。
1.4 相关指标观察
1.4.1 神经功能缺损评分 各组脑缺血再灌注24 h进行神经功能缺损评分。评分标准:神经功能正常为0分;提尾时左侧前肢屈曲为1分;向瘫痪侧转圈为2分;向左侧倾斜为3分;肢体不能自由活动,意识丧失为4分;死亡为5分。神经功能缺损评分越高说明大鼠行为障碍越严重。
1.4.2 脑组织含水量 采用干湿法。各组随机选取10只大鼠,断头取脑后称量其湿质量,将脑组织于100 ℃温度下烘干24 h,称量其干质量。脑组织含水量=(湿质量-干质量)/湿质量×100%。
1.4.3 脑组织SOD活性、MDA表达 采用ELISA法。各组取剩余10只大鼠,断头取脑后取梗死侧脑组织,剪碎后分为两部分,一部分用于SOD活性、MDA表达检测,另一部分用于以下实验。取部分剪碎后的梗死侧脑组织,冰冷生理盐水中进行匀浆,制成10%脑组织匀浆液。采用冷冻离心机于-4 ℃条件下3 000 r/min离心15 min,吸取上清液,-80 ℃保存备用。严格按照试剂盒说明书进行操作。
1.4.4 脑组织NF-κB、TNF-α、IL-1和IL-6表达 采用ELISA法。取部分剪碎后的梗死侧脑组织,加入预冷的PBS进行匀浆。采用冷冻离心机于-4 ℃条件下10 000 r/min离心15 min,吸取上清液,-80 ℃保存备用。严格按照试剂盒说明书进行操作。
1.4.5 脑组织HSP-70、p-Akt表达 采用Western blotting法。取部分剪碎后的梗死侧脑组织,加入预冷的PBS进行匀浆。0.25%胰酶消化,1 000 r/min离心10 min。收集细胞,PBS冲洗2次,加入PIPA细胞裂解液置冰浴裂解,4 ℃条件下12 000 r/min离心5 min,收集上清。经BCA法进行蛋白定量后,取等量样品以12% SDS-PAGE进行电泳。电泳后将蛋白转印至硝酸纤维素膜上,5%脱脂奶粉封闭1 h,加入HSP70和p-Akt一抗(稀释倍数均为1∶100)孵育过夜,加入过氧化酶标记的二抗封闭液孵育1 h。ECL显影,采用化学发光成像系统检测条带灰度值。以β-actin为内参,目的蛋白条带灰度值与内参蛋白条带灰度值的比值表示目的蛋白相对表达量。
2 结果
2.1 各组神经功能缺损评分比较 假手术组、模型组、GLP组、CM-GLP组及尼莫地平组神经功能评分分别为0、(3.88±0.15)、(2.92±0.26)、(2.51±0.37)、(2.20±0.71)分;模型组明显高于假手术组,GLP给药组、CM-GLP组及尼莫地平组均低于模型组,且CM-GLP组及尼莫地平组较模型组降低更明显(P均<0.01)。
2.2 各组脑组织含水量及SOD活性、MDA表达比较 模型组脑组织含水量及MDA表达均高于假手术组,SOD活性低于假手术组(P均<0.01)。GLP组、CM-GLP组及尼莫地平组脑组织含水量、MDA表达均低于模型组,且CM-GLP组及尼莫地平组降低更明显(P<0.05或<0.01)。模型组、GLP组、CM-GLP组及尼莫地平组脑组织SOD活性依次升高,组间两两比较P<0.05或<0.01。见表1。
表1 各组脑组织含水量及SOD活性、MDA表达比较
注:与假手术组比较,*P<0.01;与模型组比较,#P<0.05,△P<0.01;与GLP组比较,▽P<0.05,▲P<0.01;与CM-GLP组比较,▼P<0.05。
2.3 各组脑组织NF-κB、TNF-α、IL-1和IL-6表达比较 模型组脑组织NF-κB、TNF-α、IL-1和IL-6表达均高于假手术组(P均<0.01)。GLP组、CM-GLP组及尼莫地平组脑组织NF-κB、TNF-α、IL-1和IL-6表达均低于模型组,且CM-GLP组及尼莫地平组降低更明显(P<0.05或<0.01)。尼莫地平组脑组织IL-1表达低于CM-GLP组(P<0.05)。见表2。
2.4 各组脑组织HSP-70、p-Akt蛋白相对表达量比较 模型组脑组织HSP-70、p-Akt蛋白相对表达量均低于假手术组(P均<0.01)。GLP组、CM-GLP组及尼莫地平组脑组织HSP-70、p-Akt蛋白相对表达量均高于模型组,且CM-GLP组及尼莫地平组升高更明显(P<0.05或<0.01)。见表3。
表2 各组脑组织NF-κB、TNF-α、IL-1和IL-6表达比较
注:与假手术组比较,*P<0.01;与模型组比较,#P<0.05,△P<0.01;与GLP组比较,▽P<0.05,▲P<0.01;与CM-GLP组比较,▼P<0.05。
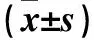
表3 各组脑组织HSP-70、p-Akt蛋白相对表达量比较
注:与假手术组比较,*P<0.01;与模型组比较,#P<0.05,△P<0.01;与GLP组比较,▽P<0.05。
3 讨论
自由基过度形成、兴奋性氨基酸毒性作用、细胞内钙超载以及炎性反应等均与脑缺血再灌注损伤的发生密切相关[11]。天然来源的多糖具有毒性低、毒副反应小等优势,但同样存在很多缺点,如水溶性差、一些多糖活性较弱等,使得多糖的使用和推广受到限制。采取一定的方法对多糖结构进行适当修饰,从而获得活性更强、应用范围更广的多糖衍生物逐渐成为医药领域的研究热点之一。本研究结果显示,CM-GLP、GLP均能明显降低脑缺血再灌注损伤大鼠的神经功能缺损评分、降低脑含水量,且CM-GLP对脑缺血再灌注损伤大鼠的神经功能改善作用更明显,其作用与尼莫地平效果相当。
脑缺血再灌注损伤发生过程中,体内自由基的清除功能减弱,氧自由基产生明显增加,进而产生了大量MDA,导致细胞膜的结构和功能被破坏。SOD作为体内一种重要的自由基清除剂,当自由基增多时SOD的消耗也会随之增加,活性显著下降[12]。本研究结果显示,CM-GLP、GLP均能显著升高脑缺血再灌注损伤大鼠脑组织SOD活性、抑制MDA表达,且CM-GLP作用更明显。NF-κB是许多信号通路中的下游分子,同时也会参与脑缺血过程的炎症反应[13]。脑缺血过程中,活化的NF-κB会被结合到参与炎症反应的基因启动子上,如TNF-α、IL-1、IL-6等。上述炎症因子被激活后,将进一步加重神经细胞的变性和坏死,最终导致脑组织损伤加重。本研究结果显示,CM-GLP、GLP均能明显降低脑缺血再灌注损伤大鼠脑组织NF-κB、TNF-α、IL-1、IL-6表达,且CM-GLP作用更明显;提示CM-GLP能降低炎性细胞因子表达,减轻脑缺血再灌注后继发的炎症反应,从而发挥对神经细胞的保护作用。HSP70是一种能够调控细胞生长和对抗应激损伤的重要调控蛋白[14],正常脑组织中HSP70基因表达非常低;而在脑缺血损伤状态下,受损细胞中的蛋白会诱导HSP70表达。因此,HSP70表达升高对脑缺血神经具有一定的保护作用[15]。目前研究认为,HSP70通过磷脂酰肌醇-3-激酶/Akt(PI3K/Akt)[16]介导的Akt磷酸化(p-Akt)阻止神经细胞凋亡,从而保护大脑组织免受损伤[17]。本研究结果显示,CM-GLP能明显升高脑缺血再灌注损伤大鼠脑组织p-Akt及HSP-70蛋白表达,且作用效果优于GLP。提示CM-GLP可能通过调控HSP70/PI3K/Akt信号通路而发挥神经细胞保护作用。
综上所述,CM-GLP预处理可减轻大鼠脑缺血再灌注损伤,其机制可能与调控HSP70/PI3K/Akt信号通路、减轻再灌注后继发的炎症反应有关。CM-GLP的神经保护作用优于GLP,可能与-CH2COO-基团的引入有关。羧甲基基团的引入不仅能够显著改善多糖在水溶液中的溶解度,并且可以使多糖在水溶液中的链构象发生改变,使其具有某种特定的结构而提高其生物活性。本研究为灵芝多糖相关药品及保健品的进一步研究开发提供了理论依据。
[1] 周佳丽,徐晓玉.中药防治脑缺血再灌注损伤的研究进展[J].中国药房,2007,18(18):1419-1421.
[2] Ginerlarza EM, Máez S, Ginerpons RM, et al. On the anti-inflammatory and anti-phospholipase A(2) activity of extracts from lanostane-rich species[J]. J Ethnopharmacol, 2000,73(1):61-69.
[3] Oh KW, Lee CK, Kim YS, et al. Antiherpetic activities of acidic protein bound polysacchride isolated from Ganoderma lucidum alone and in combinations with acyclovir and vidarabine[J]. J Ethnopharmacol, 2000,72(1):221-227.
[4] Xie YZ, Li SZ, Yee A, et al. Ganoderma lucidum, inhibits tumour cell proliferation and induces tumour cell death[J]. Enzyme Microb Techy, 2006,40(1):177-185.
[5] 张萍,李静,吕兴萍,等.赤灵芝多糖硫酸酯化初步研究[J].江苏农业科学,2013,4(1):211-213.
[6] 李晓冰,赵宏艳,郭栋.灵芝多糖药理学研究进展[J].中成药,2012,34(2):332 -335.
[7] 孙志涛,陈芝飞,郝辉,等.羧甲基化黄芪多糖的制备及其保润性能[J].天然产物研究与开发,2016,28(9):1427-1433.
[8] 时冉冉,陈娇,宗自卫.灵芝多糖抗肿瘤作用的免疫分子机制研究[J].生物技术世界,2016,16(2):317-317.
[9] 芦昶彤,侯佩,孙志涛,等.灵芝多糖的羧甲基化修饰及其保润性能研究[J].郑州轻工业学院学报自然科学版,2015,30(5-6):49-53.
[10] Garcia JH, Yoshida Y, Chen H, et al. Progression from ischemic injury to infarct following middle cerebral artery occlusion in the rat[J]. Am J Pathol, 1993,142(2):623-635.
[11] 刘筱蔼,吴伟康.中药防治脑缺血再灌注损伤的研究[J].中国中西医结合杂志,2001,21(10):794 -796.
[12] 洪森荣,尹明华.银杏叶提取物对缺血/再灌注小鼠脑细胞凋亡的保护作用[J].中草药,2007,38(12):1864-1867.
[13] 余浩佳,冯向营,辛世萌,等.丁苯酞注射液预处理通过NF-κB信号通路对大鼠脑缺血再灌注损伤的保护作用[J].中风与神经疾病杂志,2015,32(12):1119-1121.
[14] Eroglu B, Kimbler DE, Pang J, et al. Therapeutic inducers of the HSP70/HSP110 protect mice against traumatic brain injury[J]. J Neurochem, 2014,130(5):626-641.
[15] Jäättelä M. Heat shock proteins as cellular life guards[J]. Ann Med, 1999,31(4):261-271.
[16] Brunet A, Datta SR, Greenberg ME. Transcription-dependent and -independent control of neuronal survival by the PI3K-Akt signaling pathway[J]. Curr Opin Neurobiol, 2001,11(3):297.
[17] Marte BM, Downward J. PKB/Akt: connecting phosphoinositide 3-kinase to cell survival and beyond [J]. Trends Biochem Sci, 1997,22(9):355-358.
