荧光碳点的制备及其肿瘤诊断和治疗中的应用研究进展
2018-03-15吕春祥李利平
吕春祥, 李利平
(1. 中国科学院 山西煤炭化学研究所,中国科学院炭材料重点实验室,山西 太原030001; 2. 碳纤维制备技术国家工程实验室,山西 太原030001; 3. 中国科学院大学,北京100049; 4. 山西医科大学,山西 太原030001)
1 前言
碳点(Carbon dots, 简称CDs)是一种尺寸小于10 nm的碳纳米粒子,因其具有良好的荧光性能,也被称为荧光碳点。自2004年Xu等[1]用电泳的方法纯化单层碳纳米管时首次被发现,到2006年被Sun等[2]正式命名为碳点,碳点的发展已有十余年,其概念也发生了拓展,成为了一类荧光碳纳米材料的统称。与有机荧光染料相比,碳点的激发和发射光谱宽且连续,呈现一元激发、多元发射的特性[3];荧光稳定性高,耐光漂白,可以实现活体组织内的长期标记;且发射波长可调。与传统半导体量子点相比,碳点的生物相容性良好且毒性低,不含重金属元素。上述特点使得碳点成为一种理想的有机荧光染料和无机量子点的替代品,在生物医学领域具有很大的发展潜力。
目前报道的碳点种类繁多,包括碳纳米点、石墨烯量子点和聚合物点。不同方法制备得到的碳点的发光机理不尽相同,且目前对于碳点的发光机理没有统一的解释。可能的发光机理主要是碳核本征态的发光(量子尺寸效应)、缺陷态的发光(表面缺陷态、边缘态、杂原子掺杂等)和分子态发光[4-6]。
近年来,关于碳点的报道呈现爆发式的增长,大致分为两个阶段,第一阶段是关于碳点的制备方法,第二阶段是关于碳点应用领域的拓展。本文从制备工艺的角度对碳点的制备进行阐述,综述碳点在肿瘤诊断和治疗中最新的应用研究,同时对未来研究方向进行展望。
2 碳点的制备
从材料的角度,碳点的制备方法主要分为自上而下法和自下而上法两大类。自上而下法,如电弧放电法[7]、激光刻蚀法[8]、电化学氧化法[9]等,是由大尺寸的前驱体材料经过化学或物理或两者兼具的方法将其转变成小尺寸的碳点;自下而上法,如模板法[10]、微波法[11]、溶剂热法[12]等,则是将小分子的前驱体材料经过聚合、炭化等过程制备碳点。传统的分类方法为研究者提供制备碳点的思路,针对不同的前驱体材料,根据其尺寸大小,选择不同的制备方法。而在本工作中,我们将从制备碳点的宏观工艺路线角度进行分类阐述。
2.1 多步法工艺路线合成碳点
最初制备荧光碳点的方法是借助于有机小分子或者聚合物分子对碳纳米材料表面进行功能化修饰[2, 8]。诸如这样的功能化修饰的方法赋予了碳点更加优异的荧光性能和更高的量子效率[13, 14]。
Wang等[13]利用低聚物氨基化的聚乙二醇(PEG1500N)修饰激光刻蚀的碳纳米粒子,呈现出多色发射,最强的荧光发射波段位于绿光区域。碳纳米粒子先在硝酸中氧化处理,在其表面引进羧基官能团,利用羧基与PEG1 500N在典型的酰胺化反应条件下反应,所得产品通过水相的凝胶柱进行分离,得到一部分荧光量子效率高达60%的绿色荧光碳点。利用PEG1 500N修饰的碳点与商用的CdSe/ZnS量子点的荧光性能相当[15]。
2.2 一步法工艺路线合成碳点
多步法制备碳点的制备过程繁琐复杂,严重限制了碳点的实际应用。近年,通过研究者们的不懈努力,不断地简化制备碳点的制备工艺,提高碳点的荧光性能。多数研究者们选择将碳点中碳核的形成以及碳点的表面修饰或者杂原子掺杂融合在一步完成[16-18],即合成碳点的一步法工艺路线孕育而生。
一步法工艺路线合成碳点的关键在于:前驱体的选择、制备方法的选择以及反应过程的控制。
2.2.1 前驱体的选择
前驱体的选择,可以是一种碳源,也可以是混合碳源。前者在炭化过程中进行部分炭化,残留官能团起到表面修饰的作用;而后者可以选择前驱体中的一种或多种炭化成核,其余的成分将起到表面修饰和掺杂的作用[19, 20]。
Yang等[21]以柠檬酸为碳源,以PEG为表面钝化剂,利用乙二胺提供氮源,以一步水热法合成CDs@PEG,主要表现蓝光发射,其量子效率高达75%。Lei等[22]将间苯二胺,磷酸和乙二胺混合成均匀的溶液,利用微波法一步法加热40 s得到N,P-CDs,呈现出两个荧光发射中心,分别位于450 nm和510 nm处,前者发出明亮的蓝光,量子效率可达51%,后者发出明亮的绿光,量子效率可达38%。
一步法工艺路线合成碳点的文献已报道很多,是目前主流且重要的制备工艺。适用于此类方法的碳前驱体非常广泛,除了化学试剂外,还可以是生物质碳源。如Shi等[23]报道的以植物花瓣为碳源,制备得绿色荧光碳点(如图1 a);Zhu等[24]以豆浆为碳源,制备得蓝色荧光碳点(如图1 b);Sahu等[25]以橘汁为碳源,制备的荧光碳点的量子效率高达26%(如图1 c);Wang等[26]利用蛋清和蛋黄为碳源,利用等离子体发生器制备出蓝光发射的碳点(如图1 d);Zhang等[27]同样以蛋清为碳源,一步水热法同时完成炭化、掺杂氮和表面功能化修饰的过程,制备的蓝色荧光碳点的量子效率高达61%(如图1e);Wu等[12]以桑蚕丝为碳源,制备得含氮的碳点,其量子效率为13.9%(如图1f)。以上以生物质为碳源一步法制备得到量子效率较高的荧光碳点,是由于生物质本身是一种富含O、N、S等元素的前驱体材料,在炭化过程中,一步法完成了碳核的形成及杂原子的掺杂。
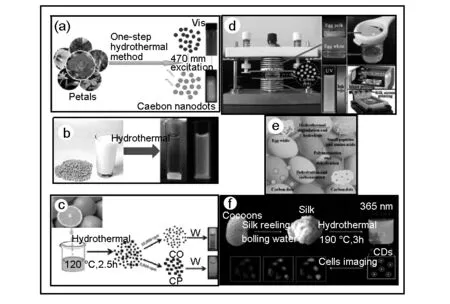
图 1 生物质为碳源的合成示意图[12,24-27]
2.2.2 制备方法及反应过程控制
一步法工艺路线中,常用的方法主要有微波辐照法、热处理法、水热法等。
微波辐照法是一种相对简单、耗时较少的制备碳点的方法。例如,Zhu等[11]将糖类和PEG-200溶于水形成透明均一的溶液后,置于微波炉中反应2~10 min,通过调节微波辐照的时间,形成不同炭化度的碳点溶液。近日,Sun等[28]采用一步微波法制备得到主-客体碳点材料G@CDots,其中G代表的是客体荧光染料,如甲酚紫(CV)、尼罗蓝(NB)和酞菁锌(ZnPc)。主-客体结构是一种新的碳点结构,与内嵌富勒烯的概念类似(如图2),是将具有红外/近红外的荧光物质嵌在碳点内部。在报道中,Sun等以合成CV@CDots为例,将CV溶于乙醇中,与低聚物PEGs混合后,除去其中的乙醇溶剂,混合物在微波炉中辐照直到预期的炭化程度。客体材料的引入不仅改善碳点的光学性能且拓展了碳点的应用领域。主-客体结构为材料的设计和合成提供了一种全新的思路,以期得到1+1>2的效果。

图 2 (a)主-客体碳点,(b)为富勒烯[11]
在热化学反应过程中,是利用热能代替了微波的辐照对碳源进行炭化,也可以说更精准的控制反应过程。Stan等[29]以N-羟基丁二酰亚胺为前驱体,在氮气氛围中加热至180 ℃,反应30 min后即得到多色发射的荧光碳点。值得注意的是,在此实验中,反应的温度和时间均未达到可使N-羟基丁二酰亚胺完全炭化的条件。研究者进行了对比实验,发现延长反应时间以及增加反应温度后得到的碳点的荧光量子效率大大降低,说明在180 ℃反应30 min后得到的碳点表面有部分未被完全炭化的基团,它们在碳点的发光效率中起到了重要的作用。Dong等[20]将柠檬酸和支化的聚乙烯亚胺的混合前驱体材料在较低的反应温度下进行炭化,前者的炭化温度较低(<200 ℃)容易被炭化形成碳核的部分,而支化的聚乙烯亚胺中胺类部分则可以修饰碳点的表面,最后利用这种方法所制备得到的碳点(BPEI-CQDs)量子效率可高达42.5%。
水热法被认为是热处理方法的一种非常重要的变体形式,区别只在于前驱体的炭化过程是在溶液中完成[30, 31]。关于水热法制备碳点的报道较多,例如,Yang等[32]以壳聚糖为碳源,在180 ℃下水热反应同时实现了炭化和对碳点的表面修饰,制备出了氨基功能化的碳点,量子效率可高达43%。Yang等[33]以葡萄糖和磷酸二氢钾为前驱体,利用水热法一步实现碳点的形成及表面钝化的过程,利用磷酸二氢钾的含量调节碳点的发光状态。当葡萄糖和磷酸二氢钾的摩尔比为1∶36时,所制备碳点主要表现为蓝光发射;当两者的摩尔比为1∶26时,所制备碳点表现为绿光发射,表明磷酸二氢钾在碳点的发光过程中起到了很重要的作用。
2.3 宏量工艺路线合成碳点
碳点的量产是实现其应用的必备条件。目前已报道的很多方法是可以实现碳点的量产的,但事实上关于宏量制备碳点的工作却很少。本小节是从碳点的产率以及量产角度进行阐述。
Hsu等[34]报道的利用咖啡渣作为碳源,制备得蓝光碳点(制备过程如图3a),其量子效率为3.8%,产率为9%~15%,大约1 g的咖啡渣可以制备得到120 mg的碳点粉末;Chen等[35]利用一步法在油酸中炭化蔗糖得到量子效率较高(QY = 21.6%)的荧光碳点,产率高达41.8%,实现了碳点的克级制备(如图3b);Yang等[36]是将中国墨水溶解在HCl中,回流6 h后得到30~50 nm的纳米粒子(CNP),再将CNP加入混酸(HNO3和H2SO4)和强氧化剂(NaClO3)中,保持低温反应5 h,用冰氨水中和多余的酸,通过过滤和透析得到氧化的碳点,再用维生素C还原,转移至水热反应釜中在240 ℃条件下反应12 h,从氧化碳点到碳点的过程中,产率可达78%,N-doped CQDs的合成过程示意图如图3c;Zhang等[37]选择了价格低廉(1 g蜂花粉0.07元人民币)且可再生的蜂花粉为碳源(如图3d),提出了一种绿色环保、简单易行的制备方法,实现了高产率、可量产的碳点的制备,产率可达30%,10 g的蜂花粉可制备出至少3 g的碳点,且随着反应时间的不同和蜂花粉的种类的不同,其量子产率可达6.1%~12.8%。
最近,笔者课题组[38]利用熔盐法选用不同的碳源宏量制备出一系列高产率、尺寸分布较窄的荧光碳点。与已报道的方法相比,熔盐法是一种条件温和易行、可实现大批量制备的、具有普适性的一种方法;在熔融状态下有着良好的热传递能力;熔盐在碳点形成过程中起到了“陷域”作用,熔盐包覆在碳点表面起到物理阻隔作用,避免了碳点的团聚,得到的碳点的尺寸分布较窄;所选混合盐在水中有良好的水溶性,碳点的后处理可通过一步透析将盐介质以及低分子量的产物透析除去,完成碳点的纯化过程。
综上所述,多步法制备碳点是最早制备荧光碳点的方法,而一步法制备碳点是目前碳点最主流且最重要的制备方法,其将碳核的形成及表面修饰或与杂原子掺杂融合在一步中实现,简化了制备工艺,且有效提高碳点的荧光性能;实现碳点的宏量制备是碳点走向实际应用的必备条件,开发绿色、可行、可实现宏量制备高性能荧光碳点的方法是目前碳点重要的研究方向之一。

图 3 (a)以咖啡渣为碳源合成碳点的示意图; (b)油浴法以蔗糖为碳源合成碳点示意图; (c)以墨水为碳源制备N-doped CQDs的过程; (d)以蜂花粉为碳源制备碳点的示意图[34-37]Fig. 3 Diagram for the synthesis of CDs using (a) Coffee ground; (b) Sucrose; (c) Chinese ink; (d) Bee pollens as precursors[34-37].
3 红光/近红外荧光碳点的制备
在红光区及近红外区域(近红外Ⅰ区,650~950 nm;近红外Ⅱ区,1 000~1 700 nm),生物样品对光的吸收、散射和自发荧光背景都比较低,近红外光源能在生物组织内达到最大穿透深度,并能进行深层组织成像,因而称此波段范围为“近红外组织透明窗口”[39]。而目前报道的碳点的发光主要集中在蓝光和绿光段发射,对组织和细胞存在损伤,在组织内的穿透力差且会产生背景荧光干扰(如图4)[40]。因此考虑到碳点未来的实际应用,制备近红外发射的碳点已经是大势所趋。
传统制备得到的碳点普遍存在荧光发射依赖于激发波长的现象,往往会随着激发波长向长波长方向移动荧光强度明显减弱,虽荧光发射光谱可以覆盖到近红外区域,但其量子效率很低,很难被实际应用。
近年,Lin课题组[40]研发出一种具有依赖性行为的碳点,但随着激发波长的改变,发射强度并未明显降低。此类碳点的报道较少。研究者通过在甲酰胺溶剂中微波加热柠檬酸,得到“真正”的全波谱发光的碳点,命名为F-CDs。F-CDs的吸收光谱覆盖整个可见光区域,但是主要存在三个主要的最佳发射峰,分别位于466,555和637 nm,且在360, 450和540 nm的激发波长下,得到对应的量子效率分别为11.9%、16.7%和26.2%。
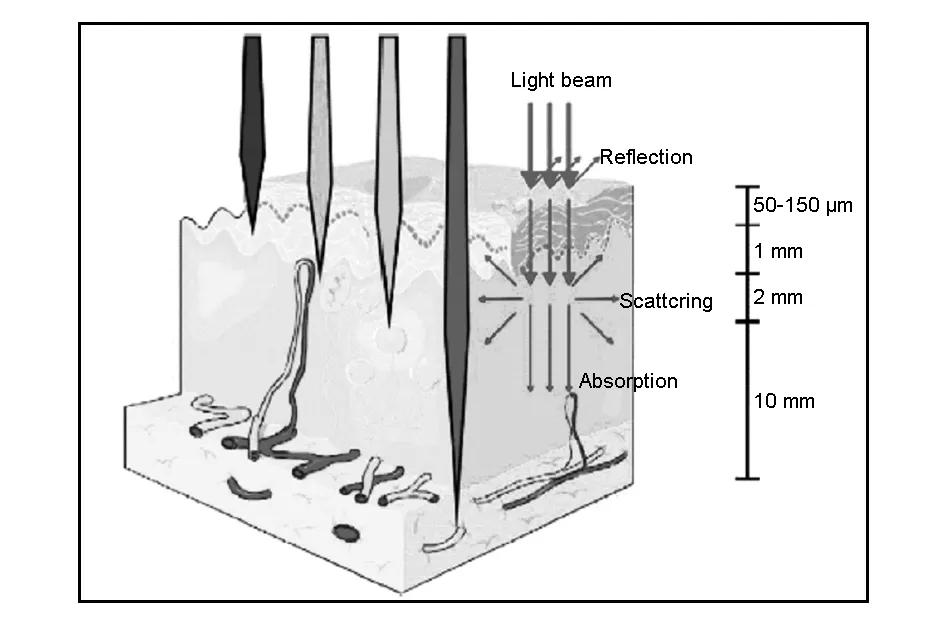
图 4 不同波长的组织穿透力的示意图[40]Fig. 4 The visualization of light penetration through the tissues according to its wavelength[40].
另一种类型的近红外荧光碳点的发射行为不依赖于激发波长,其量子效率一般较高,在生物医学领域具有很大的应用前景和发展潜力。例如,Xiong等[41]以尿素和对苯二胺为碳源,采用水热法制备出全波谱发光的碳点。通过硅胶柱层析利用不同极性的溶剂得到不同荧光发射的碳点,每一种被分离出来的荧光碳点的荧光发射行为均不依赖于激发波长。其中近红外发射的碳点的量子效率高达24%,成功将其应用在体外细胞实验和体内活体实验中,可明显观察到近红外发射的碳点在活体组织内有很强的穿透力,且没有表现出明显的生理毒性。
Jiang等[42]以对苯二胺为碳源,在乙醇溶剂中溶剂热加热到180 ℃反应12 h,将反应的产物在硅胶柱中分离后得到可溶于大多数溶剂的碳点,命名为p-CDs。p-CDs的最佳发射峰位在604 nm,且在365 nm的激发波长下的量子效率为20.6%,在510 nm的激发波长下的量子效率高达26.1%。成功应用于体外细胞的单光子和双光子的荧光成像。Tan等[43]采用电化学的方法,在K2S2O8的电解液中刻蚀石墨得到红光发射的石墨烯量子点(RF-GQDs)。当激发波长在500 nm时,其位于610 nm的荧光发射峰强度达到最大。RF-GQDs在近红外有荧光发射,可能是由于碳点中存在大的sp2结构降低了禁带宽度,使其荧光发射波长发生红移。
笔者课题组[44]以生物质菠菜为前驱体材料,采用一步溶剂热法控制反应过程,制备得到最佳发射波长位于680 nm的近红外荧光碳点,并成功将其应用在细胞成像和活体成像中。
近红外发射的荧光碳点是目前的研究热点也是难点,报道的相关工作仍然较少,且在碳点的前驱体的选择上仍然偏重于化工原料,有待于开发绿色环保的前驱体材料,以及新的制备方法。
4 碳点在肿瘤诊断和治疗中的应用
碳点因其优异的荧光性能、可调的发射波长、良好的生物相容性、低毒性以及表面易修饰的特征,使其在诊断和治疗方面的应用备受关注。
诊断是决定临床治疗效果的关键所在,目前碳点有望实现临床诊断肿瘤的成像技术主要有荧光成像、核磁共振成像(MRI)和光声成像等。
与传统的荧光染料和半导体量子点相比,碳点在荧光成像中有望替代两者而成为新一代的荧光探针。Jiang等[42]利用三种不同结构的苯二胺为前驱体制备得到红、绿、蓝三色荧光碳点,表现出优异的转换性能,并在人乳腺癌细胞中实现多色成像。Tao等[45]对裸鼠皮下注射荧光碳点后明显的观察到活体近红外荧光成像,且与背景荧光有很明显的衬度,有效避免自荧光干扰。碳点在细胞成像和活体成像中均表现出潜在的应用价值。
MRI成像的图像的分辨率较高,可对人体组织做出形态和功能两方面的诊断评价。碳点因其表面富含含氧官能团,有很强的螯合力,通过负载顺磁性的金属离子(如Gd3+,Fe3+,Mn2+等),制备出新型的核磁造影剂,利用碳点在肿瘤血管的高通透性和高滞留效应(EPR效应),被动向肿瘤位置富集,提高了核磁造影剂的靶向效应。Xu等[31]水热处理混合物柠檬酸、乙二胺和氯化钆,得到Gd-CQDs,在其表面修饰RGD肽作为靶向分子,成功实现对脑胶质瘤细胞的靶向核磁成像和荧光成像。本课题组[38]利用柠檬酸为碳源,采用熔盐法宏量制备出的荧光碳点作为载体,在其表面负载Gd3+后,成功制备得到的核磁造影剂的驰豫效率高达22.45 mM-1·s-1,高于目前报道的大部分的碳点基的核磁造影剂。值得注意的是,负载Gd3+后的碳点仍呈现出优异的荧光性能,因此Gd-CQDs通常可以实现核磁共振成像和荧光成像的双模态成像,为临床提供更精准的诊断手段。
光声成像是一种非入侵式和非电离式的新型医学成像技术,结合了光学成像的高选择性和超声成像中的深穿透性的优点,可得到高分辨率和高对比度的组织成像[46]。对于肿瘤治疗,除了传统的化学疗法、手术疗法、放射疗法以外,光热治疗和光动力治疗是近年新出现的治疗癌症的方法。与传统的治疗方法相比,光热治疗和光动力治疗均为低创伤性治疗,具有靶向性,可以实现准确定位癌细胞,而对正常细胞没有损伤,使得这些新型的治疗癌症的方法具有很大的临床应用潜力。
在传统的临床中,对于肿瘤的诊断和治疗往往是两个独立的过程,诊断不能为治疗提供实时的影像信息,增加治疗难度。2002年Pharma Netics公司首次提出诊疗一体化的概念,开辟新的理念,随着纳米技术的发展,使得癌症的诊疗一体化成为可能[47]。
近期Ge课题组[48]以聚噻吩苯丙酸为前驱体,水热制备得到的碳点在350~600 nm的激发光下实现了近红外荧光成像,在671 nm的激发光源下,实现了光声成像和光热治疗。碳点在671 nm的激发光下的光热转换效率为38.5%。研究者在小鼠体内建立HeLa肿瘤模型,待肿瘤长至25 mm3,静脉注射碳点,通过活体荧光成像发现碳点通过实体瘤的高通透性和滞留效应靶向到肿瘤位置,然后利用671 nm的激光器(功率2 W cm-2)照射肿瘤位置10 min,利用红外热成像仪观察到肿瘤位置的温度达到58.4 ℃,而对照组中未加入碳点的肿瘤位置的温度为39.5 ℃,说明碳点在热形成过程中起到很关键的作用,而在肿瘤位置当温度高于50℃时,肿瘤细胞将产生不可逆转的损害[49]。为了进一步确定光热治疗的效果,研究者监测了小鼠的存活率以及肿瘤的生长率,发现只注射了碳点或者只利用激光器照射的对照组的小鼠的肿瘤组织继续生长,而实验组在肿瘤位置中显示烧伤,肿瘤的生长受到严重的阻碍,烧伤部分的皮肤在16天以后完全恢复。而组织切片后的实验结果发现在心脏、肝脏、脾脏、肺和肾脏处,没有出现明显的炎性反应,说明碳点的光热治疗没有明显的副作用。
随后,Ge等[50]又以聚噻吩苯甲酸为前驱体,通过水热法合成红光发射的碳点(PBA-C-dots),不仅具有良好的水溶性、耐光漂白且具有光热和光动力的治疗效果。在635 nm的激发光源下,光热转换效率为36.2%,单线态氧的产率为27%,PBA-C-dots实现了荧光成像引导下的光热和光动力的双模态治疗,在肿瘤的诊疗一体化中表现出潜在的应用价值。
5 总结和展望
碳点作为一种新型的荧光碳纳米材料,因其具有优异的荧光性质、良好的生物相容性、较低的毒性以及易于功能化的特征,在生物医学领域的应用崭露头角。经过十余年的发展,碳点在简化制备工艺的同时,优化荧光性能,且拓展了其在生物医学领域的应用。红光和近红外荧光碳点是碳点中最具潜力实现临床转化的材料,然而仍存在一些限制因素,比如红光和近红外荧光的碳点目前处于探索初期,相关报道较少,前驱体的选择多为化学试剂,碳点制备工艺和后处理工艺较为繁琐;其发射波长仍然较短;与传统半导体量子点相比,荧光量子效率偏低。因此,在未来的工作中应加大红光和近红外荧光碳点的研发力度,分析其发光机理,为制备近红外一区、二区的高量子效率的荧光碳点起理论指导的作用,与此同时改进制备工艺。碳点在肿瘤诊疗一体化中的应用也处于起步阶段,其光热转化效率、单线态氧的产率仍需进一步提高。另外,碳点因其表面富含官能团,还可起到载体作用,如碳点负载金属离子,实现多模态成像;碳点载药,实现靶向治疗肿瘤;也可实现多模态成像引导下的多模态治疗。碳点在生物医学领域展示出良好的发展前景。
[1] Xu X, Ray R, Gu Y, et al. Electrophoretic analysis and purification of fluorescent single-walled carbon nanotube fragments[J]. J Am Chem Soc, 2004, 126(40): 12736-12737.
[2] Sun Y P, Zhou B, Lin Y, et al. Quantum-sized carbon dots for bright and colorful photoluminescence[J]. J Am Chem Soc, 2006, 128(24): 7756-7757.
[3] Wu X, Liu H, Liu J, et al. Immunofluorescent labeling of cancer marker Her2 and other cellular targets with semiconductor quantum dots[J]. Nat Biotechnol, 2003, 21(1): 41-46.
[4] Zhu S, Wang L, Zhou N, et al. The crosslink enhanced emission (CEE) in non-conjugated polymer dots: From the photoluminescence mechanism to the cellular uptake mechanism and internalization[J]. Chem Commun, 2014, 50(89): 13845-13848.
[5] Dong Y, Pang H, Yang H B, et al. Carbon-based dots co-doped with nitrogen and sulfur for high quantum yield and excitation-independent emission[J]. Angew Chem Int Edit, 2013, 52(30): 7800-7804.
[6] Yuan Y H, Liu Z X, Li R S, et al. Synthesis of nitrogen-doping carbon dots with different photoluminescence properties by controlling the surface states[J]. Nanoscale, 2016, 8(1): 294-297.
[7] Xiaoyou X, Robert R, Yunlong G, et al. Electrophoretic analysis and purification of fluorescent single-walled carbon nanotube fragments[J]. J Am Chem Soc, 2004, 126(40): 12736-12737.
[8] Cao L, Wang X, Meziani M J, et al. Carbon dots for multiphoton bioimaging[J]. J Am Chem Soc, 2007, 129(37): 11318-11319.
[9] Lu J, Yang J X, Wang J, et al. One-pot synthesis of fluorescent carbon nanoribbons, nanoparticles, and graphene by the exfoliation of graphite in ionic liquids[J]. ACS Nano, 2009, 3(8): 2367-2375.
[10] Bourlinos A B, Stassinopoulos A, Anglos D, et al. Photoluminescent carbogenic dots[J]. Chem Mater, 2008, 20(14): 4539-4541.
[11] Zhu H, Wang X, Li Y, et al. Microwave synthesis of fluorescent carbon nanoparticles with electrochemiluminescence properties[J]. Chem Commun, 2009, (34): 5118-5120.
[12] Wu Z L, Zhang P, Gao M X, et al. One-pot hydrothermal synthesis of highly luminescent nitrogen-doped amphoteric carbon dots for bioimaging from Bombyx mori silk-natural proteins[J]. J Mater Chem B, 2013, 1(22): 2868-2873.
[13] Wang X, Cao L, Yang S T, et al. Bandgap-like strong fluorescence in functionalized carbon nanoparticles[J]. Angew Chem Int Edit, 2010, 122(31): 5438-5442.
[14] Anilkumar P, Wang X, Cao L, et al. Toward quantitatively fluorescent carbon-based “quantum” dots[J]. Nanoscale, 2011, 3(5): 2023-2027.
[15] Yang S T, Wang X, Wang H, et al. Carbon dots as nontoxic and high-performance fluorescence imaging agents[J]. J Phys Chem C, 2009, 113(42): 18110-18114.
[16] Zheng X T, Ananthanarayanan A, Luo K Q, et al. Glowing graphene quantum dots and carbon dots: properties, syntheses, and biological applications[J]. Small, 2015, 11(14): 1620-1636.
[17] Miao P, Han K, Tang Y, et al. Recent advances in carbon nanodots: synthesis, properties and biomedical applications[J]. Nanoscale, 2015, 7(5): 1586-1595.
[18] Zhao A, Chen Z, Zhao C, et al. Recent advances in bioapplications of C-dots[J]. Carbon, 2015, 85: 309-327.
[19] Bhunia S K, Saha A, Maity A R, et al. Carbon nanoparticle-based fluorescent bioimaging probes[J]. Sci Rep, 2013, 3(3): 1473.
[20] Dong Y, Wang R, Li H, et al. Polyamine-functionalized carbon quantum dots for chemical sensing[J]. Carbon, 2012, 50(8): 2810-2815.
[21] Lei Y, Weihua J, Lipeng Q, et al. One pot synthesis of highly luminescent polyethylene glycol anchored carbon dots functionalized with a nuclear localization signal peptide for cell nucleus imaging[J]. Nanoscale, 2015, 7(14): 6104-6113.
[22] Sun X, Brückner C, Lei Y. One-pot and ultrafast synthesis of nitrogen and phosphorus co-doped carbon dots possessing bright dual wavelength fluorescence emission[J]. Nanoscale, 2015, 7(41): 17278-17282.
[23] Lihong S, Yanyan L, Xiaofeng L, et al. Facile and eco-friendly synthesis of green fluorescent carbon nanodots for applications in bioimaging, patterning and staining[J]. Nanoscale, 2015, 7(16): 7394-7401.
[24] Zhu C, Zhai J, Dong S. Bifunctional fluorescent carbon nanodots: green synthesis via soy milk and application as metal-free electrocatalysts for oxygen reduction[J]. Chem Commun, 2012, 48(75): 9367-9369.
[25] Sahu S, Behera B, Maiti T K, et al. Simple one-step synthesis of highly luminescent carbon dots from orange juice: application as excellent bio-imaging agents[J]. Chem Commun, 2012, 48(70): 8835-8837.
[26] Wang J, Wang C F, Chen S. Amphiphilic egg-derived carbon dots: rapid plasma fabrication, pyrolysis process, and multicolor printing patterns[J]. Angew Chem Int Edit, 2012, 51(37): 9297-9301.
[27] Zhang Z, Sun W, Wu P. Highly photoluminescent carbon dots derived from egg white: facile and green synthesis, photoluminescence properties, and multiple applications[J]. ACS Sustain Chem Eng, 2015, 3(7): 1412-1418.
[28] Sun Y P, Wang P, Lu Z, et al. Host-guest carbon dots for enhanced optical properties and beyond[J]. Sci Rep, 2015, 5: 12354.
[29] Stan C, Albu C, Coroaba A, et al. One step synthesis of fluorescent carbon dots through pyrolysis of N-hydroxysuccinimide[J]. J Mater Chem C, 2015, 3(4): 789-795.
[30] Wang C, Xu Z, Cheng H, et al. A hydrothermal route to water-stable luminescent carbon dots as nanosensors for pH and temperature[J]. Carbon, 2015, 82: 87-95.
[31] Xu Y, Jia X-H, Yin X-B, et al. Carbon quantum dot stabilized gadolinium nanoprobe prepared via a one-pot hydrothermal approach for magnetic resonance and fluorescence dual-modality bioimaging[J]. Anal Chem, 2014, 86(24): 12122-12129.
[32] Yang Y, Cui J, Zheng M, et al. One-step synthesis of amino-functionalized fluorescent carbon nanoparticles by hydrothermal carbonization of chitosan[J]. Chem Commun, 2012, 48(3): 380-382.
[33] Yang Z-C, Wang M, Yong A M, et al. Intrinsically fluorescent carbon dots with tunable emission derived from hydrothermal treatment of glucose in the presence of monopotassium phosphate[J]. Chem Commun, 2011, 47(42): 11615-11617.
[34] Hsu P-C, Shih Z-Y, Lee C-H, et al. Synthesis and analytical applications of photoluminescent carbon nanodots[J]. Green Chem, 2012, 14(4): 917-920.
[35] Chen B, Li F, Li S, et al. Large scale synthesis of photoluminescent carbon nanodots and their application for bioimaging[J]. Nanoscale, 2013, 5(5): 1967-1971.
[36] Yang S, Sun J, Li X, et al. Large-scale fabrication of heavy doped carbon quantum dots with tunable-photoluminescence and sensitive fluorescence detection[J]. J Mater Chem A, 2014, 2(23): 8660-8667.
[37] Zhang J, Yuan Y, Liang G, et al. Scale-up synthesis of fragrant nitrogen-doped carbon dots from bee pollens for bioimaging and catalysis[J]. Adv Sci, 2015, 2(4): 1-6.
[38] Li L, Lu C, Li S, et al. A high-yield and versatile method for the synthesis of carbon dots for bioimaging applications[J]. J Mater Chem B, 2017, 5(10): 1935-1942.
[39] Jiang W, Singhal A, Kim B Y S, et al. Assessing near-infrared quantum dots for deep tissue, organ, and animal imaging applications[J]. Jala-J Lab Autom, 2008, 13(3): 6-12.
[40] Agostinis P, Berg K, Cengel K A, et al. Photodynamic therapy of cancer: an update[J]. CA-CANCER J CLIN, 2011, 61(4): 250-281.
[41] Pan L, Sun S, Zhang A, et al. Truly fluorescent excitation-dependent carbon dots and their applications in multicolor cellular imaging and multidimensional sensing[J]. Adv Mater, 2015, 27(47): 7782-7787.
[42] Ding H, Yu S-B, Wei J-S, et al. Full-color light-emitting carbon dots with a surface-state-controlled luminescence mechanism[J]. ACS Nano, 2015, 10(1): 484-491.
[43] Jiang K, Sun S, Zhang L, et al. Red, green, and blue luminescence by carbon dots: Full-color emission tuning and multicolor cellular imaging[J]. Angew Chem Int Edit, 2015, 54(18): 5360-5363.
[44] Xiaoyun T, Yunchao L, Xiaohong L, et al. Electrochemical synthesis of small-sized red fluorescent graphene quantum dots as a bioimaging platform[J]. Chem Commun, 2015, 51(13): 2544-2546.
[45] Li L, Zhang R, Lu C, et al. In situ synthesis of NIR-Light emission carbon dots derived from spinach for bio-imaging application[J]. J Mater Chem B, 2017, 5(35): 7328-7334.
[46] Tao H, Yang K, Ma Z, et al. In vivo NIR fluorescence imaging, biodistribution, and toxicology of photoluminescent carbon dots produced from carbon nanotubes and graphite[J]. Small, 2012, 8(2): 281-290.
[47] Hannah A, Luke G, Wilson K, et al. Indocyanine green-loaded photoacoustic nanodroplets: dual contrast nanoconstructs for enhanced photoacoustic and ultrasound imaging[J]. Acs Nano, 2014, 8(1): 250-259.
[48] Barreto J A, O'malley W, Kubeil M, et al. Nanomaterials: applications in cancer imaging and therapy[J]. Adv Mater, 2011, 23(12): 18-40.
[49] Ge J, Jia Q, Liu W, et al. Red-emissive carbon dots for fluorescent, photoacoustic, and thermal theranostics in living mice[J]. Adv Mater, 2015, 27(28): 4169-4177.
[50] Liu Y, Ai K, Liu J, et al. Dopamine-melanin colloidal nanospheres: an efficient near-infrared photothermal therapeutic agent for in vivo cancer therapy[J]. Adv Mater, 2013, 25(9): 1353-1359.
[51] Ge J, Jia Q, Liu W, et al. Carbon dots with intrinsic theranostic properties for bioimaging, red-light-triggered photodynamic/photothermal simultaneous therapy in vitro and in vivo[J]. Adv Healthc Mater, 2016, 5(6): 665-675.
