La1-xSrxCoO3(x=0,0.2,0.4,0.6,0.8)钙钛矿型氧化物的催化性能及改性
2018-03-14于文婉黄红霞
于文婉 黄红霞 王 成
(桂林理工大学,广西电磁化学功能物质重点实验室,桂林 541004)
0 引 言
全球能源危机和环境污染越发严峻,开发高效、经济、环保的可持续新型绿色能源势在必行。绿色新能源中的金属-空气电池是最有潜力的电池,具有成本低、无污染、效率高、理论能量密度高、放电稳定等优点,但是其实际工作电压和比能量通常较低,这是由于无论是氧析出还是氧还原反应,都需要克服较高的活化能,减小电极极化,因此空气电极所负载的催化剂是影响电池的电化学性能的核心部分[1-4]。目前铂、铱及其氧化物作为催化材料在可充电金属空气电池中表现出极好的氧还原反应和析氧反应催化性能[5-8]。但是这些材料成本高,资源稀缺限制了其大规模的商业化。因此,非贵金属催化剂近几年来成为人们日益关注的研究热点。如今,钙钛矿氧化物(ABO3)是一种很有前途的替代贵金属的电催化材料,其A位是稀土元素,B位是过渡金属元素,理想的结构是立方的,它的优点是在保持晶体的结构下可以通过在A、B位上合理替换不同的阳离子,对物理化学性质进行调控从而提高其催化性能。钙钛矿氧化物通过改变A位的掺杂可影响对O2的吸附,而改变B位掺杂则影响吸附O2的活性[9]。何伟等[10]采用表面活性剂聚乙二醇-200辅助溶胶-凝胶法制备了LaMnO3,制得的LaMnO3为纳米级别,具有良好的氧还原电催化性能,并且充放电性能优异。Sun等[11]制备出B位掺杂Ni的La0.6Sr0.4Co1-xNixO3钙钛矿氧化物,将其应用于锂空气电池当中,发现B位掺杂Ni有效的提高了其对氧还原/氧析出反应的催化性能,并能抑制放电过程中阻抗的增加,促进放电过程中放电产物的分解。目前LaCoO3型钙钛矿氧化物,在氧还原反应和析氧反应中均有优异的催化活性,是极具有潜力的催化材料[12-13]。研究发现,将LaCoO3的A位部分掺杂Sr,增加了晶格氧空位,部分Co3+转变为Co4+,有利于提高电导率和对氧的双效催化性能[14]。单一的钙钛矿氧化物作为空气电极催化剂,与其他贵金属催化剂相比电子电导率仍普遍较低,导致电极氧析出和氧还原反应的极化增大,催化性能还是不够优秀。为了设计出具有更高催化活性的催化剂,可通过添加另一种催化剂与钙钛矿氧化物协同催化来达到目的。Luo等[15]制备出NiCo2O4的表面复合改性的La0.8Sr0.2MnO3纳米棒应用于锂空气电池当中,NiCo2O4弥补了La0.8Sr0.2MnO3在析氧反应中相对较差的催化活性,比容量可达7 992 mAh·g-1,同时得到了卓越的充放电循环性能。
本文采用溶胶-凝胶法,制备了一系列的钙钛矿型氧化物 La1-xSrxCoO3(x=0,0.2,0.4,0.6,0.8),应用于双效氧电极中,研究掺杂不同替代量的Sr对其形貌结构及催化活性的影响,筛选出在氧还原和氧析出反应中表现出最佳双功能催化活性和稳定性的催化剂。由于La1-xSrxCoO3在氧析出反应中的催化能力较弱,电导率低,而α-MnO2在氧析出反应中催化活性普遍较高[16],为进一步提高La1-xSrxCoO3的氧析出催化活性,将制备的α-MnO2纳米管与其复合作为双功能催化剂进行研究。
1 实验部分
1.1 仪器和试剂
X′Pert3 Powder型多功能X-射线衍射仪 (荷兰Panalytical公司);场发射扫描电子显微镜(日立高新技术公司);NOVA 1200e型比表面积分析仪 (美国Quantachrome公司);CHI 660E型电化学工作站 (上海辰华仪器公司);
六水合硝酸镧 (天津市光复精细化工研究所),硝酸锶(西陇化工股份有限公司),六水合硝酸钴(西陇化工股份有限公司),一水合柠檬酸(西陇化工股份有限公司),高锰酸钾(西陇化工股份有限公司),氨水(西陇化工股份有限公司),盐酸(西陇化工股份有限公司),无水乙醇(西陇化工股份有限公司),异丙醇(西陇化工股份有限公司),碳黑Vulcan XC-72R(深圳鹏翔运达机械科技有限公司),以上均为分析纯。乙炔黑(工业品,深圳鹏翔运达机械科技有限公司);聚四氟乙烯(60%悬浮溶液,美国3M公司);
1.2 实验方法
1.2.1 La1-xSrxCoO3钙钛矿型氧化物的制备
按照化学计量比称取 La(NO3)3·6H2O、Sr(NO3)3、Co(NO3)2·6H2O 后,在去离子水中溶解。 将金属离子总物质的量的1.5倍的一水合柠檬酸溶于适量去离子水后缓慢倒入硝酸盐混合溶液中,持续搅拌使其充分混合。通过氨水将溶液调节成一定的pH值,随后恒温水浴加热下将混合溶液中多余的水分蒸掉,最终形成透明的凝胶后放进鼓风干燥箱中干燥一夜。将干燥后的样品在350℃下预煅烧30 min,将其研磨后继续在800℃下煅烧3 h,并再次研磨得到钙钛矿型催化剂。
1.2.2 α-MnO2的制备
采用水热合成法来制备 α-MnO2[17]。首先将0.225 g KMnO4加入到20 mL去离子水中溶解,再加入 HCl(37%(w/w))0.5 mL,将混合溶液充分搅拌 30 min后倒入不锈钢反应釜中。随后将反应釜放入干燥箱内,在140℃下加热12 h。当反应釜取出冷却至室温后,将所得产物过滤并用无水乙醇和去离子水洗涤数次。最后将产物在60℃下干燥一整夜后研磨即得α-MnO2粉末。
1.2.3 双功能氧电极的制备
将质量比为 1∶1∶2 的催化剂、PTFE(60%(w/w)悬浮水溶液)和碳黑(VXC-72R)混合在异丙醇溶液中,将混合物球磨30 min,再超声30 min,使其充分混合均匀。将该溶液加热蒸发成糊状并搅拌直到结成一种弹性的团状。最后在辊压机上压制成0.2 mm的薄膜,随后干燥得到催化层。其中催化剂分为2种,一种是单一的催化剂La1-xSrxCoO3或α-MnO2,另一种是其中催化性能最好的La0.6Sr0.4CoO3分别与20%,40%,60%,80%(w/w)的 α-MnO2球磨混合作为催化剂,按照 m球∶m料∶m乙醇=20∶1∶10 的比例球磨,转速为 300 r·min-1,球磨 30 min,分别记为 20%M-LSC、40%M-LSC、60%M-LSC、80%M-LSC。 根据制备催化层相同的方法,制作由质量比为7∶3的乙炔黑和聚四氟乙烯悬浮液组成防水层,厚度为0.5 mm。将防水层、镍网(集流体)、催化层在15 MPa的压力下压1 min形成电极片,随后放进干燥箱内干燥,最终将该电极在340℃下煅烧30 min除掉有机溶剂,最后裁剪成工作面大约为1 cm×1 cm的电极片,即得到双效氧电极。
1.3 样品的表征
使用X射线衍射仪对制得的α-MnO2和钙钛矿型催化剂样品进行分析,以Cu靶为辐射源,λ=0.154 056 nm,管电压为40 kV,管电流为40 mA,扫速为 0.656 5°·s-1,α-MnO2样品的扫描范围为 10°~80°, 钙钛矿样品的扫描范围为 20°~80°。 采用 X′Pert HighScore Plus软件对样品的衍射图进行晶相鉴定,分析确定催化剂的晶体结构,并计算出钙钛矿的粒径大小。利用比表面积分析仪以氮气为吸附质对钙钛矿粉体的比表面积进行检测分析。通过场发射扫描电子显微镜,扫描电压为5 kV,对催化剂样品的微观形貌、颗粒分散和粒径大小情况等进行观察对比,并对样品进行元素分析。
道路工程建设中会不断形成大量的项目建设、立项、规划、设计施工、监督管理和验收竣工等文件资料,一定要按照科学的方法对这些相应的技术文件进行归档分类,以便于为了将来在道路工程建设的维修养护、监控管理和改扩建设等方面提供翔实而准确的原始数据和记录。同时,还能进一步优化道路的规划和检修方案,以节省大量的人力、物力和财力资源及成本。
1.4 电化学性能测试
采用三电极体系对制得的双效氧电极进行电化学性能测试,将制备的双效氧电极固定在测试装置上,然后让其在6 mol·L-1的KOH电解液中浸泡48 h以上,目的是使电解液能充分渗透到双效氧电极的催化活性层。以双效催化氧电极为研究电极,Hg/HgO为参比电极,铂片为对电极,使用CHI660 E电化学工作站对其进行阳极极化曲线、阴极极化曲线、稳态恒电流测试。
2 结果与讨论
2.1 La1-xSrxCoO3钙钛矿型氧化物的结构表征
图1为A位由不同含量Sr替代La的钙钛矿型氧化物 La1-xSrxCoO3(x=0,0.2,0.4,0.6,0.8)的 XRD图。如图1所示,LaCoO3钙钛矿的衍射峰与标准卡(PDF No.48-0123)的标准峰吻合,且 La1-xSrxCoO3系列所有样品的XRD图基本一致,晶型完整,均没有其他杂质峰出现。图中可看出主峰强度随Sr掺杂量增加而减弱,说明Sr掺杂导致样品结晶度降低。同时Sr的掺杂使衍射峰向左偏移,2θ角度逐渐变小,根据布拉格定律λ=2dsinθ,λ固定不变,θ变小则d变大,说明样品的晶格参数变大。这是由于Sr2+半径大于La3+半径,当Sr取代部分La时,从而A位离子半径随之增加。以上结果表明,掺杂的Sr已全部进入晶格内,得到单一完整的钙钛矿相,无其他杂质存在。

图 1 La1-xSrxCoO3 (x=0,0.2,0.4,0.6,0.8)钙钛矿型氧化物的XRD图Fig.1 XRD patterns of La1-xSrxCoO3(x=0,0.2,0.4,0.6,0.8)perovskite oxide powders
为研究Sr掺杂对钙钛矿型氧化物La1-xSrxCoO3(x=0,0.2,0.4,0.6,0.8)的形貌影响, 对样品进行了SEM测试,如图2所示。从图中可看出,所合成的样品均为纳米级,样品形貌为不规则块状结构,且均有团聚现象出现。随着Sr的掺杂量增加,样品颗粒先减小再增大,团聚情况逐渐加剧,块与块之间结合越来越紧密。当x=0.4时,可明显看出样品颗粒相对最小,颗粒分布较为均匀。
如表1所示,根据Scherrer公式[18]计算出La1-xSrxCoO3(x=0,0.2,0.4,0.6,0.8)钙钛矿型氧化物样品的晶粒大小在17~50 nm之间,进一步证明A位Sr的掺杂可影响钙钛矿氧化物的颗粒尺寸大小。当x=0.4时,晶粒尺寸最小,与SEM测试结果一致。对样品进行了氮气吸附脱附测试,可知随着Sr掺杂量的增加,样品的比表面积先增大后减小,说明晶粒尺寸的减小有利于增大样品的比表面积,同时样品的团聚情况也是影响比表面积的因素之一。此外,通过 EDS 测试对 La1-xSrxCoO3(x=0,0.2,0.4,0.6,0.8)钙钛矿型氧化物进行了元素分析,其原子分布如表2所示,结果表明每个样品的各离子的物质的量比基本都是理论值。

图2 La1-xSrxCoO3钙钛矿型氧化物的SEM图Fig.2 SEM images of La1-xSrxCoO3perovskite oxides

表1 La1-xSrxCoO3(x=0,0.2,0.4,0.6,0.8)钙钛矿型氧化物的粒径R和比表面积SBETTable 1 Particle sizes and surface areas of La1-xSrxCoO3(x=0,0.2,0.4,0.6,0.8)perovskite oxides
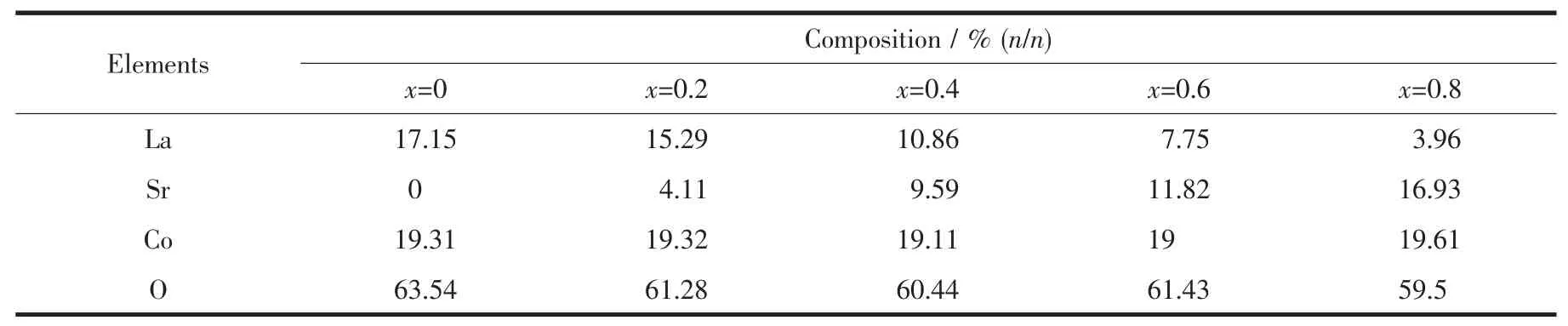
表2 La1-xSrxCoO3(x=0,0.2,0.4,0.6,0.8)钙钛矿型氧化物化学成分的EDS分析Table 2 Chemical Compositions of La1-xSrxCoO3(x=0,0.2,0.4,0.6,0.8)perovskite oxides by EDS
2.2 α-MnO2的结构表征
图3为α-MnO2的XRD图,从图中可看出所有的衍射峰与标准卡(PDF No.44-0141)一致,且没有出现杂质峰,即证明所得样品为纯四方相的α-MnO2。图4为α-MnO2的SEM图,从图中可看出α-MnO2为不规则的纳米管状,与报道相符[17]。

图 3 α-MnO2的 XRD 图Fig.3 XRD pattern of α-MnO2powders

图 4 α-MnO2的 SEM图Fig.4 SEM image of α-MnO2
2.3 La1-xSrxCoO3钙钛矿型氧化物电化学性能的表征
2.3.1 稳态极化曲线分析
为了研究不同含量Sr替代部分La对钙钛矿型氧化物 La1-xSrxCoO3(x=0,0.2,0.4,0.6,0.8)的氧还原/氧析出催化性能的影响,将其应用于双效氧电极当中,进行稳态极化曲线测试。图5为La1-xSrxCoO3和无催化剂双效电极的阳极极化曲线,可以看出加入钙钛矿催化剂La1-xSrxCoO3后,增强了双效氧电极氧析出反应的活性,通过改变不同含量的Sr掺杂对La1-xSrxCoO3对氧析出催化性能有很大的影响。在小电流密度50 mA·cm-2下,随着Sr掺杂量的增加,双效电极的极化程度逐渐减小,说明对氧析出反应的催化活性逐渐增加,当Sr掺杂量为x=0.8时,La0.2Sr0.8CoO3双效氧电极的极化最小,催化活性最高。但在较大电流密度下,当Sr的掺杂量为x=0.4时,双效电极表现出最佳的催化活性,当电压为1 V时最大电流密度为0.303 A·cm-2。随着Sr掺杂量的进一步增加,对氧析出活性反而下降。

图 5 La1-xSrxCoO3 (x=0,0.2,0.4,0.6,0.8)和无催化剂电极的阳极极化曲线Fig.5 Anodic polarization curves of La1-xSrxCoO3(x=0,0.2,0.4,0.6,0.8)and non-catalyzed electrodes

图 6 La1-xSrxCoO3 (x=0,0.2,0.4,0.6,0.8)和无催化剂电极的阴极极化曲线Fig.6 Cathodic polarization curves of La1-xSrxCoO3(x=0,0.2,0.4,0.6,0.8)and non-catalyzed electrodes
在碱性介质中,普遍认为钙钛矿型双效氧电极氧还原反应按照二电子反应进行,会产生中间体HO2-,需在催化剂作用下进一步分解成OH-,氧析出反应则是氧还原反应的逆向过程,最终产物生成O2[19-22]。从稳态极化曲线测试结果可看出,Sr的掺杂成功改善了LaCoO3的氧析出和氧还原的催化活性,这归咎于影响钙钛矿结构的电催化性能的重要一点是B离子价态,Sr掺杂引起了Co元素的价态变化,使部分Co3+转变成Co4+,同时增加了氧空位浓度,对氧分子吸附和脱附的能力有所改善,提高OH-和催化剂表面之间的电子转移,从而使催化活性显著提高[14,20]。从表1看出,少量的Sr掺杂减小了样品的颗粒尺寸,增大了其比表面积,当Sr掺杂量为x=0.4时粒径最小,比表面积最大,电化学测试结果证明其催化性能最佳,说明比表面积的增大导致反应活性点增加,因此加快了反应速率。但过多的Sr掺杂增大了样品粒径,比表面积相对减小,电催化性能变差,说明比表面积的减小引起催化剂中的电催化活性中心的相对数量减少,因而比表面积减小是导致催化活性降低的原因之一。
2.3.2 稳态恒电流测试

图 7 钙钛矿 La1-xSrxCoO3(x=0,0.2,0.4,0.6,0.8)和无催化剂电极的稳态恒电流曲线Fig.7 Galvanostatic curves of La1-xSrxCoO3(x=0,0.2,0.4,0.6,0.8)and non-catalyzed electrodes
图 7 为 La1-xSrxCoO3(x=0,0.2,0.4,0.6,0.8)钙钛矿型氧化物和无催化剂的双效氧电极分别在阴极模式和阳极模式下,按照50 mA·cm-2恒电流密度测试电极的电压变化,研究电极的稳定性能。从图中可知,无催化剂的电极稳定性最差,加入La1-xSrxCoO3催化剂后稳定性均有所改善。整体上看,阴极模式均比阳极模式下测试的电极电压趋于稳定所用的时间长,说明电极的阴极稳定性比阳极稳定性略差。当Sr掺杂量x=0.4时,无论在阴极模式还是在阳极模式下,其双效电极均表现出极佳的稳定性,电压在最短的时间内趋于稳定,并且电压读数无明显抖动。
综合以上结果,采用溶胶凝胶法制备的一系列La1-xSrxCoO3钙钛矿型氧化物中,相比较下La0.6Sr0.4CoO3具有最好的氧析出/氧还原催化性能,同时展现出优秀的催化稳定性,是极具有潜力的双效催化剂。
2.4 α-MnO2/La0.6Sr0.4CoO3电化学性能的表征
2.4.1 稳态极化曲线分析
由于La0.6Sr0.4CoO3钙钛矿型氧化物表现出最佳的双效催化性能及稳定性,所以将其与α-MnO2混合协同催化,进一步提高在双效氧电极中的催化性能。图8为La0.6Sr0.4CoO3与不同质量比的α-MnO2混合制备出的双效氧电极的阳极极化曲线图。从图看出单一钙钛矿双效氧电极的起峰电位为0.589 V,而单一α-MnO2双效氧电极的起峰电位为0.613 V,且电极极化程度最差,说明α-MnO2的氧析出催化性能没有La0.6Sr0.4CoO3的催化性能好。α-MnO2添加量分别为20%、40%、60%、80%的双效电极,起峰电位分别为 0.510、0.550、0.607、0.575 V, 除 60%MLSC电极起峰电位较高外,大部分表现出比La0.6Sr0.4CoO3双效电极更好的氧析出催化活性,其极化程度有所降低。但是随着极化电压逐渐升高,添加α-MnO2的电极极化程度急速加剧,仅α-MnO2添加量为40%的电极比单一La0.6Sr0.4CoO3电极的极化要小,当电压为1 V时,电流密度从303.7 mA·cm-2提高到 362.8 mA·cm-2。

图 8 La0.6Sr0.4CoO3、α-MnO2和 α-MnO2/La0.6Sr0.4CoO3电极的阳极极化曲线Fig.8 Anodic polarization curves of La0.6Sr0.4CoO3,α-MnO2,and α-MnO2/La0.6Sr0.4CoO3electrodes
图9为La0.6Sr0.4CoO3钙钛矿型氧化物与不同质量比的α-MnO2混合制备出双效氧电极的阴极极化曲线图。从图中看出,α-MnO2双效氧电极的氧还原性能比氧析出性能要好,在小电流密度下,与La0.6Sr0.4CoO3双效电极相比极化小,但电流密度较大时电极极化加剧,反而比La0.6Sr0.4CoO3电极氧还原活性要差。整体来看,40%M-LSC双效电极极化程度明显降低,具有极好的氧还原活性,有效提高了单一La0.6Sr0.4CoO3催化剂电极的氧还原性能。

图 9 La0.6Sr0.4CoO3,α-MnO2和 α-MnO2/La0.6Sr0.4CoO3电极的阴极极化曲线Fig.9 Cathodic polarization curves of La0.6Sr0.4CoO3,α-MnO2and α-MnO2/La0.6Sr0.4CoO3electrodes

图10 La0.6Sr0.4CoO3,40%M-LSC电极的稳态恒电流曲线Fig.10 Galvanostatic curves of La0.6Sr0.4CoO3and 40%M-LSC electrodes
2.4.2 稳态恒电流测试
为研究添加α-MnO2协同催化对双效氧电极的稳定性的影响,在50 mA·cm-2电流密度下,分别在阴极模式和阳极模式中对40%M-LSC双效电极进行了1 000 s的恒电流测试。从测试结果可看出,在阳极模式下,α-MnO2的添加对电极的稳定性几乎没有影响,电极电压趋于稳定的时间略有增加,电压没有明显抖动。在阴极模式下,40%M-LSC双效电极电压稳定所需的活化时间少,电压平稳,证明稳定性要比La0.6Sr0.4CoO3电极要好。
3 结 论
本文采用溶胶-凝胶法制备出La1-xSrxCoO3(x=0,0.2,0.4,0.6,0.8)钙钛矿型氧化物,通过 XRD 测试结果显示其主峰位置相对于标准LaCoO3钙钛矿型氧化物的主峰有明显的左移,证明已成功的将Sr掺杂到晶格当中。Sr的掺杂影响了LaCoO3的微观形貌和粒径大小,随着Sr掺杂含量的增加,其粒径先变小再增大,团聚情况逐渐严重,其中La0.6Sr0.4CoO3的粒径最小,比表面积相对较大。
La1-xSrxCoO3作为双效氧电极的催化剂时,A位掺杂Sr改善了对氧分子吸附和脱附的能力,提高OH-和催化剂表面之间的电子转移,从而使双功能氧电极的极化变小,优化了电极的性能。其中La0.6Sr0.4CoO3在氧还原/氧析出反应中的催化活性更具优势,同时在50 mA·cm-2电流密度下,有效的提高了双效氧电极的稳定性,是具有潜力和前景的双功能催化剂。
通过La0.6Sr0.4CoO3钙钛矿型氧化物中添加α-MnO2制备出复合催化剂,在双效氧电极中进行协同催化,当α-MnO2的添加为 40%时,与单一La0.6Sr0.4CoO3双效氧电极相比,表现出更好的氧还原/氧析出反应活性,并优化了氧还原反应的稳定性,说明了复合的催化剂比单一的催化剂的催化活性要好。
[1]Zhou K Y,Chen G Y,Liu J A,et al.RSC Adv.,2016,6(93):90069-90075
[2]Senthilkumar B,Khan Z,Park S,et al.J.Power Sources,2016,311:29-34
[3]WANG Ying(王瀛),ZHANG Li-Min(张丽敏),HU Tian-Jun(胡天军).Acta Chim.Sinica(化学学报),2015,73(4):316-325
[4]Prabu M,Ramakrishnan P,Shanmugam S.Electrochem.Commun.,2014,41:59-63
[5]Zhang L,Roling L T,Wang X,et al.Science,2015,349(6246):412-416
[6]Greeley J,Stephens I E,Bondarenko A S,et al.Nat.Chem.,2009,1(7):552-556
[7]Hu W,Wang Y,Hu X,et al.J.Mater.Chem.,2012,22(13):6010-6016
[8]Reier T,Oezaslan M,Strasser P.ACS Catal.,2012,2(8):1765-1772
[9]Kim C H,Qi G,Dahlberg K,et al.Science,2010,327(5973):1624-1627
[10]HE Wei(何伟),ZHAO Fang-Xia(赵芳霞),XIAO You(肖酉),et al.Battery Bimon.(电池),2017,47(2):76-79
[11]Sun N,Liu H,Yu Z,et al.Ionics,2016,22(6):869-876
[12]Singh R N,Tiwari S K,Sharma T,et al.J.New Mater.Electrochem.Syst.,1999,2(1):65-69
[13]Müller S,Striebel K,Haas O.Electrochim.Acta,1994,39(11/12):1661-1668
[14]Wang P,Yao L,Wang M,et al.J.Alloys Compd.,2000,311(1):53-56
[15]Luo Y,Lu F,Jin C,et al.J.Power Sources,2016,319:19-26[16]Selvakumar K,Kumar S M S,Thangamuthu R,et al.Int.J.Hydrogen Energy,2014,39(36):21024-21036
[17]Xiao W,Wang D,Lou X W.J.Phys.Chem.C,2010,114(3):1430-1434
[18]Scherrer P.Nachr.Ges.Wiss.Gttingen,1918,2:96-100
[19]Shao Y,Park S,Xiao J,et al.ACS Catal.,2012,2(5):844-857
[20]Suntivich J,Gasteiger H A,Yabuuchi N,et al.Nat.Chem.,2011,3(8):546-550
[21]Bockris J O,Otagawa T.J.Phys.Chem.,1983,87(15):2960-2971
[22]Tanaka H,Misono M.Curr.Opin.Solid State Mater.Sci.,2001,5(5):381-387
