肝豆扶木汤对TX小鼠肝纤维化TGF-β1/Smad信号通路的影响
2018-03-14,,,,
,,,,
肝豆状核变性(hepatolenticular degeneration,HLD),即Wilson病(Wilson disease,WD),是一种以进行性铜代谢障碍为特征的常染色体隐性遗传疾病,临床表现为锥体外系症状、角膜色素环、肝硬化及肾功能损害等[1]。由于铜离子在体内沉积的速度、部位和程度不同,临床表现具有多样性,但无论是脑型、肝型还是其他类型,肝纤维化几乎是每一个WD病人肝脏的主要病理改变[2]。肝纤维化是发展成肝硬化的必经阶段,肝硬化以及在其基础上的合并症是WD病人死亡的最主要原因,抗纤维化治疗可以阻止乃至逆转肝纤维化进展[3-4]。
研究表明,目前临床所用西药对WD所致的肝纤维化多无逆转作用,且常用的金属络合剂如青霉胺等长期应用后安全性差,不良反应多。而传统中药治疗WD疗效显著,不良反应小,安全性高。肝豆扶木汤(gandoufumutang,GDFMT)是我科治疗WD肝纤维化的效方,临床疗效显著[5]。转化生长因子-β1(TGF-β1)是促进肝纤维化发展重要的细胞因子之一[6-7]。本研究采用肝豆扶木汤治疗WD肝纤维化动物模型——TX小鼠,观察其肝纤维化血清指标及肝组织TGF-β1、Smad2和Smad7蛋白的表达,探讨肝豆扶木汤治疗WD肝纤维化的作用机制。
1 材料与方法
1.1 实验动物与药物 TX小鼠种鼠从美国 Jackson 实验动物中心引进,饲养于安徽中医药大学教育部重点实验室动物房,SPF级,并进行传代繁殖。以基因检测结果选取子代雄性TX小鼠24只,正常对照组DL小鼠8只。
肝豆扶木汤(由何首乌、三七、郁金、白芍、枸杞、土茯苓、柴胡等中药组成),由安徽中医药大学第一附属医院提供,每剂生药重156 g;青霉胺,规格每片0.125 g,购于上海医药集团有限公司信谊制药总厂,批号:H31022286。
1.2 主要仪器与试剂 透明质酸(HA,南京森贝生物),层粘连蛋白(LN,上海酶联生物),Ⅲ型前胶原(PC-Ⅲ,伊莱特生物),Ⅳ型胶原(C-Ⅳ,上海古朵生物),TGF-β1和Smad7(北京博奥森生物),Smad2(美国Bioworld),JW3021HR型离心机(安徽嘉文),ZT-12M型自动脱水机(湖北孝感亚光),YB-7B型石蜡包埋机(湖北孝感亚光),RM2135型切片机(德国Leica),科力飞QP-B型切片漂烘仪(合肥电子科学研究所),HEAL FORCE NW 10UF型纯水仪(香港力康生物),88-1型搅拌器(常州国华),JD801型生物显微摄像系统(江苏省捷达)。
1.3 实验方法
1.3.1 动物分组 24只TX小鼠随机分为模型组、青霉胺组、GDFMT组,每组8只,正常对照组DL小鼠8只。
1.3.2 给药方法 青霉胺组研成粉剂,用蒸馏水配成混悬液按0.1 g/kg (按70 kg体重成人日用量的9倍计算)灌胃;GDFMT组按20.1 g/kg(按70 kg体重成人日用量的9倍计算)灌胃,正常对照组和模型组均用等量生理盐水灌胃,每组每天灌胃1次,连续28 d。
1.3.3 标本采集 灌胃4周结束后用3.3%的水合氯醛(1 mL/100 g)腹腔注射麻醉处死小鼠,腹主动脉取血,离心提取血清,剪取肝脏,制备石蜡切片,组织切片厚度4 μm ,二甲苯脱蜡,梯度酒精脱水,一抗4 ℃孵育,聚合物增强剂室温孵育15 min~20 min,辣根酶标记聚合物室温孵育15 min~20 min,DAB显色,苏木素复染,封片,镜下观察。
1.3.4 肝纤维化血清学指标 按照试剂盒的操作步骤进行竞争性放免分析法检测血清HA、LN、PC-Ⅲ、C-Ⅳ含量。
1.3.5 肝组织TGF-β1、Smad2和Smad7蛋白的表达 采用免疫组化法检测肝组织TGF-β1、Smad2和Smad7蛋白的表达。
2 结 果
2.1 GDFMT对小鼠血清肝纤维化指标的影响 与正常对照组比较,模型组血清肝纤维化HA、LN、PC-Ⅲ、C-Ⅳ含量均明显升高(P<0.01);与模型组比较,青霉胺组和GDFMT组血清肝纤维化HA、LN、PC-Ⅲ、C-Ⅳ含量均降低(P<0.05或P<0.01);与青霉胺组比较,GDFMT组血清肝纤维化HA、LN、PC-Ⅲ、C-Ⅳ含量均降低(P<0.05)。详见表1。
2.2 GDFMT对小鼠肝组织TGF-β1、Smad2和Smad7蛋白表达的影响 与正常对照组比较,模型组TGF-β1和Smad2蛋白表达明显升高(P<0.01),Smad7蛋白表达明显降低(P<0.01);与模型组比较,青霉胺组和GDFMT组TGF-β1和Smad2蛋白表达明显降低(P<0.01),Smad7蛋白表达明显升高(P<0.01);与青霉胺组比较,GDFMT组TGF-β1和Smad2蛋白表达均明显降低(P<0.05),Smad7蛋白表达明显升高(P<0.05)。详见表2,图1~图3。


组别nTGF⁃β1 Smad2 Smad7正常对照组80.40±0.030.44±0.011.13±0.05模型组81.17±0.071)1.24±0.101)0.42±0.061)GDFMT组80.68±0.022)3)0.74±0.052)3)0.84±0.032)3)青霉胺组80.76±0.012)0.81±0.042)0.72±0.042) 与正常对照组比较,1)P<0.01;与模型组比较,2)P<0.01;与青霉胺组比较,3)P<0.05。
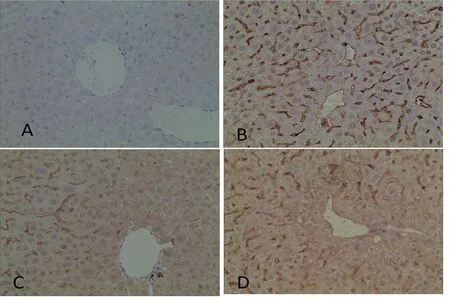
注:A代表正常对照组;B代表模型组;C代表GDFMT组;D代表青霉胺组。

注:A代表正常对照组;B代表模型组;C代表GDFMT组;D代表青霉胺组。

注:A代表正常对照组;B代表模型组;C代表GDFM组;D代表青霉胺组。
3 讨 论
WD是常染色体隐性遗传的单基因疾病,主要导致铜代谢障碍,促使体内铜离子沉积,影响肝、大脑、肾等脏器结构及功能,肝脏是铜代谢的枢纽器官,铜离子沉积常导致肝纤维化,甚至肝硬化等[1]。中医无肝豆状核变性一词,根据其临床表现,多归属“肝风”“积聚”“癥瘕”等病证范畴。先前临床研究表明,WD肝纤维化多是由于肝肾亏虚、痰瘀互结所致,采用补益肝肾、袪痰化瘀法,创制GDFMT,正是针对WD肝纤维化肝肾亏虚,痰瘀互结病机而设的组方。本方由何首乌、枸杞、土茯苓、白芍、三七、郁金及柴胡等药组成。其中何首乌、枸杞补益肝肾、扶正固本;三七、郁金、土茯苓活血化瘀、解毒除湿;白芍、柴胡柔肝敛阴、调达肝气,诸药合用,共奏补益肝肾、豁痰化瘀之功效。现代药理研究表明,何首乌中所含的二苯乙烯苷对肝脏具有保护作用[8]。枸杞多糖可以通过阻止内质网的损伤,促进蛋白质合成及解毒,有助于损伤肝细胞的恢复及再生[9]。三七总皂苷能抑制肝脏胶原纤维合成与沉积,具有抗肝纤维化作用[10]。柴胡皂苷是柴胡属植物中主要的有效成分,具有保肝作用,与传统中医记载的柴胡疏肝解郁功效一致[11]。郁金挥发油可以改善肝功能,促进肝细胞再生[12]。白芍总苷为白芍的有效部位,具有抗急性肝损伤、非酒精性脂肪肝、慢性肝纤维化及抗肝癌等多种作用[13]。WD纤维化是由于铜离子沉积导致的慢性肝损伤后的一种损伤修复反应,其本质是细胞外基质(extracellular matrix,ECM)合成与降解失衡[14-15]。WD是一种遗传性铜代谢障碍疾病,铜离子在肝脏内沉积,通过氧化应激作用刺激肝星状细胞(hepatic stellate cell,HSC)增殖[16],HSC是肝纤维化发展中的一个重要事件,因为它是ECM产生的主要细胞来源[17]。
TGF-β1是促进肝纤维化发展的关键因子,它可以激活HSC并促进其表达ECM。Smad蛋白是TGF-β信号转导过程中重要的胞内信号分子。Smad蛋白有8种,根据功能不同分为3类:受体调节型Smad (R-Smad),有Smad1,2,3,5,8;通用型Smad(Co-Smad),有Smad4;抑制型Smad(I-Smad),有Smad6,7[18]。TGF-β1与HSC膜表面的Ⅰ型、Ⅱ型受体结合后磷酸化激活Smad2,3,活化的Smad2,3与胞质中的Smad4结合形成复合物进入细胞核内,在核内调节目标基因的转录[19]。磷酸化的Smad2,Smad3诱导Tβ1R/Smad复合物形成,促使HSC活化为成纤维细胞(myofibroblaster,MFB),激活的HSC通过分泌基质金属蛋白酶(matrix metalloproteinases,MMP)及其抑制物(inhibitors of metalloproteinases,IMP),抑制ECM降解,诱导肝纤维化的发生[20-21]。Smad7是负性调控因子,它可以抑制HSC的转化和ECM的合成与分泌[22]。基于TGF-β1/Smad信号转导通路在肝纤维化发展过程中的重要意义,用药物干预该信号通路可以为防治肝纤维化提供新的方法[23]。
TX小鼠是由同系繁殖到F68的DL小鼠所产生的自然突变品系,其致病基因与WD致病基因——ATP7B基因的同源性达82%,能较好地模拟WD临床征象,是理想的WD模型动物。本研究采用TX小鼠作为研究对象,通过肝纤维化TGF-β1/Smad信号通路来观察中药GDFMT对其的影响,结果表明,GDFMT能有效地降低TX小鼠肝纤维化血清指标从而发挥抗纤维化的作用,其作用机制可能是GDFMT抑制TGF-β1和Smad2蛋白的表达,上调Smad7蛋白的表达。表明GDFMT可以通过TGF-β1/Smad信号转导通路抑制肝纤维化的发生与发展。
[1] 孙忠人,杨文明. 神经病学 [M]. 第2版. 北京:人民卫生出版社,2016:110-116.
[2] 孙艳玲,赵景民,李文淑,等. 儿童Wilson病的临床病理特征及其肝纤维化机制探讨[J]. 解放军医学杂志,2005,30(4):300-302.
[3] Trautwein C,Friedman SL,Schuppan D,et al. Hepatic fibrosis:concept to treatment[J]. Journal of Hepatology,2015,62(1 Suppl):S15-S24.
[4] 吴兰婷,刘文兰. 肝纤维化逆转机制的研究进展及治疗概况[J]. 世界华人消化杂志,2017,25(23):2123-2132.
[5] 杨文明,方芳,汪美霞,等. 肝豆扶木汤治疗Wilson病肝纤维化的临床研究[J]. 中医药临床杂志,2014,26(11):1111-1113.
[6] 李顶春,李武. TGF-β/Smad、MAPK/ERK、NF-κB信号通路对肝纤维化的影响[J]. 现代免疫学,2017,37(5):427-432.
[7] 谭淑萍,吴晓东. 肝纤维化与TGF-β和以其为靶位点的治疗策略[J]. 世界华人消化杂志,2006,14(32):3126-3130.
[8] 罗瑞芝,贾伟,赵利斌,等. 何首乌研究进展[J]. 中草药,2005,36(7):1097-1100.
[9 ] 张敏,张新华. 枸杞子抗衰老保肝等实验研究综述[J]. 时珍国医国药,2000,11(4):373-375.
[10] 甘雨,徐惠波,孙晓波. 三七总皂苷的药理作用研究进展[J]. 时珍国医国药,2007,18(5):1251-1252.
[11] 卢伟,杨光义,杜士明,等. 竹叶柴胡化学成分和药理作用研究进展[J]. 医药导报,2016,35(2):164-168.
[12] 尹国平,张清哲,安月伟,等. 温郁金化学成分及药理活性研究进展[J]. 中国中药杂志,2012,37(22):3354-3360.
[13] 左志燕,詹淑玉,黄嬛,等. 白芍总苷保肝作用的药动学和药效学研究进展[J]. 中国中药杂志,2017,42(20):3860-3865.
[14] Wells RG. Cellular sources of extracellular matrix in hepatic fibrosis[J]. Clinics in Liver Disease,2008,12(4):759-768.
[15] Friedman SL. Molecular regulation of hepatic fibrosis,an integrated cellular response to tissue injury[J]. The Journal of Biological Chemistry,2000,275(4):2247-2250.
[16] Xu SQ,Zhu HY,Lin JG,et al. Copper ions stimulate the proliferation of hepatic stellate cells via oxygen stress in vitro[J]. Journal of Huazhong University of Science and Technology,2013,33(1):75-80.
[17] Hernandez-Gea V,Friedman SL. Pathogenesis of liver fibrosis[J]. Annual Review of Pathology,2011,6:425-656.
[18] Moustakas A,Heldin CH. The regulation of TGF-beta signal transduction[J]. Development,2009,136(22):3699-3714.
[19] Shi Y,Massague J. Mechanisms of TGF-beta signaling from cell membrane to the nucleus[J]. Cell,2003,113(6):685-700.
[20] Pinzani M. Novel insights into the biology and physiology of the Ito cell[J]. Pharmacology & Therapeutics,1995,66(2):387-412.
[21] Gressner AM,Weiskirchen R,Breitkopf K,et al. Roles of TGF-beta in hepatic fibrosis[J]. Frontiers in Bioscience A Journal and Virtual Library,2002,7:d793-d807.
[22] Zhu HJ,Iaria J,Sizeland AM. Smad7 differentially regulates transforming growth factor beta-mediated signaling pathways[J]. The Journal of Biological Chemistry,1999,274(45):32258-32264.
[23] Liu X,Hu H,Yin JQ. Therapeutic strategies against TGF-beta signaling pathway in hepatic fibrosis[J]. Liver Inter,2006,26(1):8-22.
