我国鸡球虫分子生物学研究进展*
2018-03-13胡丹丹刘贤勇
胡丹丹 索 勋 刘贤勇
(中国农业大学动物医学院国家动物原虫实验室,北京 100193)
我国是养禽大国,鸡球虫病对养殖业造成了大量直接或间接的经济损失。鸡球虫病主要由7种寄生于鸡肠道上皮细胞的顶复门艾美耳属球虫导致,其中包括柔嫩艾美耳球虫、毒害艾美耳球虫、巨型艾美耳球虫、堆型艾美耳球虫、布氏艾美耳球虫、早熟艾美耳球虫以及和缓艾美耳球虫。随着实验技术的发展,特别是高通量测序技术和转基因技术的出现,以柔嫩艾美耳球虫为代表的多种艾美耳球虫得到广泛的研究。我国科研工作者在鸡球虫的分子生物学上开展了诸多深入细致的工作,在球虫研究领域做出了重要贡献。例如,国内学者解析了许多重要基因的表达定位情况及其生物学功能、完成了7种鸡球虫线粒体全基因组测序、建立并发展了球虫转基因和遗传操作技术以及利用多种组学技术解析球虫发育调控和耐药性等科学问题。本文对这些工作进行梳理综述,为将来更好的开展研究工作服务。
1 鸡球虫功能基因研究
球虫寄生和发育过程较为复杂,包含宿主体内寄生状态下的无性生殖(即裂殖生殖)、配子生殖、以及体外的孢子生殖(索勋等, 1998)。期间不同的球虫基因在不同时间和空间上发挥各自的功能,使得球虫发育正常进行。研究人员致力于解析其中的重要基因,试图通过不同的方式对这些基因进行干预,以期阻断球虫的发育,达到控制球虫病的目的。目前主要研究的干预靶标是酶类和与子孢子入侵相关的蛋白(表1)。
代谢相关酶类,如脂磷酸酯磷酸酶、乳酸脱氢酶、苹果酸脱氢酶和多肽:N-乙酰氨基半乳糖转移酶等大多在虫体全时期均表达(Dongetal., 2014b; Guoetal., 2015; 刘晓丽等, 2017; Chenetal., 2018),且在入侵或寄生阶段高表达,说明它们在球虫能量代谢和虫体寄生生活中起到重要的作用。相反,组蛋白修饰相关酶类,如组蛋白去乙酰化酶2 A(左云云等, 2016)和组蛋白去乙酰化酶3(刘兵, 2014)在未孢子化卵囊阶段或孢子化过程中表达量最高,在其他阶段反而很少表达。在球虫孢子化过程中,球虫未孢子化卵囊细胞核首先经历一次减数分裂,随后进行连续两次有丝分裂最终发育成为含有8个子孢子的孢子化卵囊(Canningetal., 2010),借此推测相关的组蛋白修饰主要是发生在球虫细胞核的第1次减数分裂时期。
研究人员通过酶的特异性抑制剂或者针对蛋白的特异性抗体对球虫子孢子进行体外处理,然后观察特异性拮抗相关蛋白,是否会对球虫子孢子入侵细胞产生影响。其中,对EtCHP559(Zhaietal., 2016)、ZB10-E05(马卫娇, 2011)、钙依赖蛋白激酶(李洋, 2010)、胱硫醚 β合成酶和假定蛋白(李聪, 2016)的抑制作用最为显著,子孢子在它们对应的多克隆抗体或抗血清作用后,能降低其入侵细胞的效率约60%~70%;其次为Et440(崔晓霞, 2017)、苹果酸脱氢酶(Chenetal., 2018)和钙依赖蛋白激酶3(Hanetal., 2013)对它们用特异性抑制剂或多抗进行抑制后,子孢子的入侵效率降低约30%~40%;对子孢子入侵细胞作用影响较小的蛋白为乳酸脱氢酶(Dongetal., 2014b)、艾美耳属保守蛋白(Dongetal., 2014a)、蛋白质二硫化物异构酶样蛋白(Hanetal., 2014)和微线蛋白2(崔晓霞, 2017),特异性抑制这些蛋白,仅能抑制约10%~25%子孢子入侵。
在蛋白质相互作用方面,以柔嫩艾美耳球虫AMA1蛋白作为诱饵,从柔嫩艾美耳球虫子孢子的酵母双杂交文库中筛选与AMA1互作的蛋白,并将对应的序列重新进行酵母双杂交验证后,显示EtMIC2等14个蛋白和AMA1互作(Hanetal., 2016)。利用GST pull-down技术找出了10个可能与AMA1相互作用的候选蛋白,其中也包含了EtMIC2蛋白;但随后利用免疫共沉淀和双分子荧光互补实验进行验证时发现,AMA1与EtMIC2蛋白之间并没有相互作用(崔晓霞, 2017)。此外,采用相似的策略结合免疫共沉淀技术发现柔嫩艾美耳球虫菱形蛋白能够与EtMIC4相互作用,并能对EtMIC4进行切割(Zhengetal., 2011; Zhengetal., 2014);利用柔嫩艾美耳球虫端粒酶的RNA-binding结构域作为诱饵,找到并用GST pull-down和Co-IP验证了Et-14-3-3蛋白能与之结合(Zhaoetal., 2014)。
球虫重要基因功能的解析将极大地促进我们对球虫在感染、入侵以及整个寄生生活上的了解,有助于了解一些球虫生物学过程和现象,如发育调控、有性到无性生殖的转换以及早熟现象等;同时,抗原基因和耐药性相关基因的研究也有助于开发新的球虫病疫苗和药物。
2 鸡球虫分子分类与检测研究
2.1 线粒体基因组与系统发育
朱兴全教授课题组(Linetal., 2011; Liuetal., 2012)对鸡球虫7个种的线粒体基因组进行了测序,发现7个种的线粒体基因组结构非常相似,线粒体基因组全长为6 148~6 407 bp,AT含量为64.53%~67.30%。鸡球虫线粒体基因组编码3个蛋白质基因(分别为cox1、cox3和cytb)、12个大亚基rRNA基因片段、7个小亚基rRNA基因片段,且无tRNA。编码的3个基因种内保守,种间差异稍大,可以明显将7个种分为独立分支(图1)。其中,毒力最强的两个物种,柔嫩艾美耳球虫和毒害艾美耳球虫序列相似性较高,分类上也较为接近。
谢雯琴等(2010)对5株堆型艾美耳球虫的cox3部分序列进行了比较分析,发现序列完全一致。分别对6株巨型艾美耳球虫和3株柔嫩艾美耳球虫的cox1部分序列进行比较,结果显示同种不同株的cox1序列也完全一致(王鑫, 2007; 周飞亚等, 2014)。Cytb基因的同源性也相当高,20株柔嫩艾美耳球虫cytb基因序列一致性可达到99.9%(Lietal., 2017)。因此,球虫线粒体基因组基因编码序列一般不用作球虫种内鉴定。
2.2 鸡球虫PCR分类检测方法研究
除传统形态学观察外,可用于球虫鉴定的分子生物学方法包括同工酶技术、荧光定量PCR、RAPD(Randomly Amplified Polymorphic DNA,随机扩增多态性DNA)、扩增片段长度多态性(Amplified Fragment Length Polymorphism,AFLP)、限制性片段长度多态性(Restriction Fragment Length Polymorphism,RFLP)、单链构象多态性(Single Strand Conformation Polymorphism,SSCP)、和常规PCR技术、多重PCR技术 (李文超等, 2006a; 李文超等, 2006b)。目前,以RAPD和PCR技术使用较为广泛。
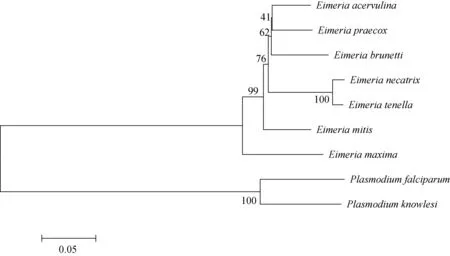
图1 基于线粒体蛋白编码基因的7种鸡球虫系统进化树(NJ树)Fig.1 Phylogenetic (neighbor-joining) tree of 7 chicken coccidia based on mitochondrial protein coding genes利用MEGA软件的邻接法将整合的各虫种的cox1、cox3和cytb序列进行比对和作图。E. acervulina、E. praecox、 E. brunetti、E. necatrix、E. tenella、E. mitis、 E. maxima、Plasmodium falciparum和P. knowlesi线粒体序列的NCBI登录号分别为HQ702479、 HQ702483、 HQ702480、HQ702482、 HQ702484、 KF501573、HQ702481、 M76611和AB444108。The NJ-tree was constructed by Neighbor-Joining method in MEGA software with cox1, cox3 and cytb protein coding genes in their mitochondria. NCBI accession numbers for E. acervulina, E. praecox, E. brunetti, E. necatrix, E. tenella, E. mitis, E. maxima, Plasmodium falciparum and P. knowlesi are HQ702479, HQ702483, HQ702480, HQ702482, HQ702484, KF501573, HQ702481, M76611 and AB444108, respectively.
RAPD技术利用大量随机引物对全基因组中差异位点进行鉴别,技术简单,无需同位素或DNA探针,灵敏度高,并且能够体现全基因组范围内的差异。刘群等利用RAPD技术对柔嫩艾美耳球虫早熟株、鸡胚适应株、亲本毒株和田间分离的抗药株进行了比较分析,发现各分离株间均能找出差异条带,建议将RAPD技术用于艾美耳球虫株间差异的检测(刘群等, 1998)。随后,将该技术用于不同种和株鸡球虫间DNA多态性的比较,发现多数引物能使不同种球虫产生完全不同的谱带,证明RAPD技术可以用于鸡球虫虫种的分类鉴定(刘群等, 2000)。对柔嫩艾美耳球虫6个虫株进行RAPD扩增,得出这6个虫株之间的相似值约在0.61~0.88之间,而不同种间的相似值则相对较低(陈兆国等, 2001)。对11株巨型艾美耳球虫和两株柔嫩艾美耳球虫进行分析,分别得出其种内的相似值为0.7822和0.9216(陶建平, 2004)。对6种鸡艾美耳球虫和7个柔嫩艾美耳球虫虫株进行的分析发现,60条随机引物中有35条对6个种球虫能够扩增出103条多态性条带,不同种之间的相似性为0.253~0.575;在柔嫩艾美耳球虫7个株中,60条随机引物有28条共可以扩增出41条多态性条带,不同株之间相似性为0.391~0.696,明显高于不同种之间的相似性(夏延富, 2009)。对安徽及周边地区的柔嫩艾美耳球虫进行RAPD扩增和相似性分析,显示株间相似性为0.40~0.78(黄月月等, 2016)。
虽然RAPD在球虫种内和种间鉴定都取得了不错的成效,但是由于RAPD技术存在重复性较差的缺点,导致其在实际应用上存在一定的局限性。相对来说操作更简单,重复性更好的基于PCR技术的序列分析可以很好的对不同种的球虫进行鉴定。目前用于虫种和虫株PCR鉴定的序列有很多,包括顶质体DNA、线粒体DNA、核DNA以及核糖体DNA。由于顶质体DNA(谢雯琴, 2010; 刘国昌等, 2013)和线粒体DNA(王鑫, 2007; 谢雯琴等, 2010; 周飞亚等, 2014; Lietal., 2017)自身保守性较高,较少用于球虫虫种和虫株的鉴定研究。核糖体DNA序列突变频率相对较高、适用于物种间基因相似性较高的球虫虫种区别鉴定,因此被广泛使用。蔡兰对不同虫种和虫株的18S rDNA序列进行比对分析,发现8种鸡球虫(含变位艾美耳球虫)种间同源性为92.9%~99.4%;5株巨型艾美耳球虫种内同源性为96.9%~99.8%;7株柔嫩艾美耳球虫种内同源性为99.0%~99.9%(蔡兰, 2006)。类似地,发现巨型艾美耳球虫、柔嫩艾美耳球虫和堆型艾美耳球虫种间18S rDNA同源性为96.5%~98.1%,而巨型艾美耳球虫和柔嫩艾美耳球虫种内同源性分别为98.7%~99.3%和99.7%~99.9%(王鑫等, 2009)。有学者针对巨型艾美耳球虫、柔嫩艾美耳球虫和堆型艾美耳球虫的ITS-1序列设计了3对特异性引物,并建立了单一PCR和多重PCR检测方法,其结果显示两种方法均能够分别扩增出各自特异性的条带,且最小检出浓度为0.5 ng(辛玲, 2005)。随后,对10株巨型艾美耳球虫ITS-1基因序列进行比较分析,显示同源性差异较大,为65.4%~100%(辛玲, 2005)。而最近研究检出21株柔嫩艾美耳球虫ITS-1序列同源性为92.5%~100%(Lietal., 2017)。同时,ITS-1序列在球虫种间的保守性较低,只有34%~52%(夏延富等, 2009a)。这些结果说明,核糖体DNA中ITS-1序列比18S序列的变异频率更丰富,更适合设计特异性引物对球虫进行种间鉴定。
国外研究人员将RAPD技术和PCR鉴定方法进行整合优化,先用RAPD筛选出能够区分不同虫种和虫株的特异性RAPD引物,并把特异性条带转化成对应的分子标记(如SCAR marker),再以特异性PCR引物对虫株进行鉴定(Fernandezetal., 2003; Fernandezetal., 2004)。王鑫等(2010)根据我国流行的巨型艾美耳球虫、柔嫩艾美耳球虫、堆形艾美耳球虫的RAPD和SCAR分子标记,针对ITS-I区序列分别设计了6对特异性引物,成功对这些虫种进行了鉴别,开发出适合于国内使用的检测标记物。此外,国外已有一些较为成熟的基于ITS-1序列的特异性PCR检测方法,如针对ITS-1设计特异的9对引物来鉴定鸡球虫7个种 (Lewetal., 2003)。此外,研究人员还对卵囊DNA提取方法和PCR引物进行改进和优化,提出使用“卵囊研磨—GeneReleaser提取DNA—单种PCR”的流程,使得检测更加灵敏,实验结果更加可靠,也能节省大量的实验操作时间(Haugetal., 2007)。
3 球虫转基因技术及应用
3.1 鸡球虫转染技术的建立与发展
1998年Kelleher和Tomley利用β-半乳糖苷酶作为报告基因,成功对柔嫩艾美耳球虫进行了体外瞬时转染(Kelleheretal., 1998)。此后,索勋教授实验室以红、黄荧光蛋白作为报告基因,实现了球虫的瞬时转染(Haoetal., 2007),并对体外培养的各时期球虫进行实时荧光观察(Shietal., 2008)。随后,对球虫体外转染条件进行优化,发现线性化质粒转染效率明显高于环型质粒,并且在转染时加入限制性内切酶可以进一步提升转染效率(Liuetal., 2008)。借助药物筛选策略,使得球虫筛选效率得到提升(Clarketal., 2008),使球虫转染进入了体内稳定转染 (Shietal., 2009; Yanetal., 2009)。研究者籍此可以得到大量稳定表达特定蛋白的转基因球虫,便于后续球虫生物学、免疫学等研究。
进一步的研究还证实刚地弓形虫和柔嫩艾美耳球虫基因启动子序列能够在两个物种中互换和发挥功能(Zouetal., 2009);同时,弓形虫蛋白也可以在球虫中实现表达(Yinetal., 2013)。国内学者首次实现了双框载体在球虫中的稳定表达,并且可以利用弓形虫GRA8的信号肽序列,将报告基因打靶到纳虫空泡中(Yinetal., 2011)。这些结果说明弓形虫和球虫在基因表达调控上具有一定的保守性。由于双框载体序列需要两套上下游调控序列,增加了载体构建的难度。为此利用了具有自剪切功能的2 A肽段,该肽段能够在蛋白质翻译阶段将串联前后两个基因的多肽链切开,变为两个独立的蛋白,从而缩短了载体长度(Tangetal., 2016a)。为提升外源蛋白在球虫中的表达量,对转染载体进行优化结果显示,将原先常用的Histone 4、Actin和Tubulin等启动子替换为SAG13启动子,从而进一步提升表达水平(Tangetal., 2016a)。此外,和缓艾美耳球虫(Meietal., 2014)、堆型艾美耳球虫(张思新等, 2015)和毒害艾美耳球虫(Duanetal., 2016)均先后实现了稳定转染,并获得稳定表达外源基因的虫株。
3.2 鸡球虫表达外源蛋白作为新型疫苗载体
自国内学者首次提出利用表达外源抗原的转基因球虫卵囊作为新型活疫苗载体这一设想以来,先后在此方向上取得一系列成绩。将模式抗原黄色荧光蛋白分别表达于柔嫩艾美耳球虫的胞浆和微线体中,两个转基因虫株均能刺激鸡淋巴细胞特异性增殖并产生IFN-γ分泌;其中,将黄色荧光蛋白表达于微线体上的虫株能够激发更强烈的抗原特异性的淋巴细胞增殖和更高的IgA水平(Huangetal., 2011)。在柔嫩艾美耳球虫中成功表达H5N1禽流感病毒M2蛋白外膜区(M2 ectodomain,M2e)抗原且能够被特异性抗体所识别(Liuetal., 2013; 李秋明等, 2013)。在柔嫩艾美耳球虫中转入弓形虫SAG1基因,该基因表达于球虫子孢子表面,并且能够被鸡免疫系统识别,对弓形虫产生部分免疫保护效果;同时,将表达弓形虫SAG1的球虫子孢子对小鼠进行腹腔免疫后,使小鼠产生特异性的Th1型免疫反应,并能延长攻毒小鼠死亡时间(Tangetal., 2016b)。同样地,在柔嫩艾美耳球虫中过表达巨型艾美耳球虫免疫优势抗原IMP1(immune mapped protein 1)也能被宿主免疫系统识别,免疫该转基因球虫能够激发鸡体同时产生对柔嫩和巨型艾美耳球虫的保护力(Tangetal., 2017)。与此同时,为进一步提升球虫自身的免疫效果,使球虫表达一些免疫佐剂分子,比如在和缓艾美耳球虫中转入IL-2或IgY的 Fc片段,均能够比正常野生虫株提供更多的卵囊减少量(Lietal., 2015; Qinetal., 2016)。在柔嫩艾美耳球虫中转入巨型艾美耳球虫profilin基因(Toll样受体的配体),能够增强柔嫩艾美耳球虫特异性免疫,并能提供更好的免疫保护效果(Tangetal., 2018)。
4 鸡球虫组学研究
4.1 鸡球虫参考基因组
近来多个研究小组联合对鸡球虫的7个虫种进行了全基因组测序,其中重点对柔嫩艾美耳球虫Houghton株进行了拼接和注释,使得鸡球虫研究进入后基因组时代(Reidetal., 2014)。但是由于其在建库时仅采用一个300 bp的小片段文库进行测序(柔嫩艾美耳球虫多一个3 kb文库),以及球虫基因组本身重复序列较多,导致基因组非常碎片化(scaffold N50最高为201 kb),不能够满足当前研究的需求。为此,本课题组对柔嫩艾美耳球虫基因组进行重新测序和拼接注释,利用PacBio三代测序和高通量染色体构象捕获技术(Hi-C)将99%以上的序列挂载到14条染色体上,极大的提升了基因组的完整性(胡丹丹等,未发表数据)。同时还对柔嫩艾美耳球虫基因组的重复序列进行了重新分析,并对基因组进行了基因重注释(胡丹丹等,未发表数据)。新版基因组将极大促进球虫分子生物学发展及其重要性状分子机制的解析。
4.2 组学在球虫发育调控上的研究
鸡球虫生活史较为复杂,各个发育时期的基因表达均有较大差异。利用抑制性消减文库对柔嫩艾美耳球虫孢子化过程中的差异表达基因进行了研究,从两个子孢子cDNA消减文库中能够获得40个单一有效序列,其中包括MASP、MIC、SAG等细胞器蛋白或表面抗原等(韩红玉等, 2007)。利用转录组高通量测序,分别比较毒害艾美耳球虫第2代和第3代裂殖子的差异表达基因以及第3代裂殖子与配子体的差异基因,找出837个基因在第3代裂殖子中高表达,1 216个基因低表达;分别有95和48个基因是2代和3代裂殖子特异性表达基因(Suetal., 2017, 2018)。在第2代裂殖子中显著富集的上调表达基因主要与蛋白质降解和氨基酸代谢相关,在第3代裂殖子中则主要是与转录、细胞增殖和分化相关的基因(Suetal., 2017)。第3代裂殖子同配子体的差异基因相对更多,达到4 267个,从中筛选出了53与卵囊壁形成相关的基因以及30个与小配子发育相关的基因。这些数据为更好的了解球虫生活史提供了参考(Suetal., 2018)。
早熟弱毒系是将原始野生毒株进行不断选育后得到的生活史发生了极大改变的虫株,其最大的特征是裂殖生殖代次缺失或内生性发育速度加快(Jeffers, 1975)。目前调控早熟系产生的机制尚不明确。李玉剑(2009)分别构建了堆型艾美耳球虫早熟株和原始株的抑制性消减cDNA文库。从早熟株消减文库中获得20个单一有效序列,包括丝氨酸蛋白酶抑制剂、表面抗原和一些假定蛋白;从野生虫株消减文库中获得21个单一有效序列,包括ATP合成酶、线粒体醛脱氢酶前提以及假定蛋白等。利用抑制性消减cDNA文库结合芯片分析的方法对巨型艾美耳球虫早熟差异基因进行了筛选,找出其孢子化卵囊阶段32个单一有效序列,其中21个在早熟系中下调表达,11个上调表达(Dongetal., 2011)。其中包括菱形蛋白、转氢酶、serpin和阳离子转运ATP酶等。这些研究为研究调控球虫早熟性状打下了基础,但是抑制消减cDNA文库的通量和灵敏度较低,需要采用通量更大的方法找出更多差异基因,以便提供更多有效信息。如国外研究人员利用转录组测序对柔嫩早熟和野生虫株的孢子化卵囊进行测序分析(Matsubayashietal., 2016),但由于其测序样品没有生物学重复,其数据仅供参考。
4.3 组学在球虫耐药性上的研究
球虫耐药性广泛存在,影响了球虫病的防控效果。研究人员希望通过找到耐药虫株与敏感虫株之间差异表达的蛋白来研究耐药性产生的机制(夏延富等, 2009b)。采用消减文库的方法筛选柔嫩艾美耳球虫抗马杜拉霉素和地克珠利相关基因,分别得到4个和3个基因可能与之相关(韩红玉等, 2005)。通过cDNA阵列分析的方法分别比较莫能菌素和马杜霉素耐药虫株与敏感株的差异表达基因,发现莫能菌素耐药虫株中大量基因上调表达,并且这些基因大多参与细胞骨架重排和能量代谢途径;而在马杜霉素耐药虫株中高表达的基因大多为细胞骨架基因以及参与虫体入侵的基因;此外,在马杜霉素耐药虫株中,与糖代谢和转运相关的基因却下调表达(Chenetal., 2008)。直接对柔嫩艾美耳球虫经地克珠利处理后的蛋白质表达变化进行分析(Shenetal., 2014),能够得到13个在处理后表达量显著变化的蛋白,这些差异蛋白参与代谢、蛋白合成和虫体入侵等过程。随着测序技术的发展及成本的降低,可利用高通量测序技术发掘耐药性虫株和敏感虫株基因组上的标记。通过对两株地克珠利完全耐药株和两株敏感株的裂殖子阶段转录组进行比较,发现330 个差异表达基因,这些基因在DNA 整合、金属离子结合和阳离子结合功能中得到了明显富集,可能与地克珠利耐药性相关,但是还需要后续实验验证(韩贞艳,2018)。
4.4 鸡球虫病毒基因组
许多寄生原虫被双链RNA病毒感染,如毛滴虫、贾第虫和利士曼原虫等。在柔嫩艾美耳球虫中发现了一株双链RNA病毒(直径约为30 nm)并对其全长基因组进行测序(Wuetal., 2016)。结果显示,该双链RNA病毒基因组全长6 006 bp,仅含有两个编码框,分别长2 367 bp和3 216 bp,其中有5个碱基重叠。这两个编码框分别编码约85 kDa的衣壳蛋白和118.2 kDa的RNA依赖性RNA聚合酶。后续研究发现,该RNA依赖性RNA聚合酶可以与球虫卵巢肿瘤蛋白样半胱氨酸蛋白酶相互作用(Wangetal., 2018)。序列比对发现,该病毒与布氏艾美耳球虫体内的病毒同源(29%~36%)。该病毒基因组序列特征类似于Totiviridae病毒,但系统发育分析时却与Victorivirus病毒聚类,提示该病毒可能属于一个自己特定的分支。
5 展望
我国对球虫分子生物学的研究已逐步靠近国际水平并在某些领域开始取得领先。然而,相比于其他顶复门的原虫(如弓形虫和疟原虫等),球虫的整体研究水平还相对较低。究其原因,制约球虫分子生物学发展的主要原因有两个:第一是没有可靠的体外培养体系用于球虫的培养。目前球虫的传代主要依赖鸡体内传代,传代周期长、收取和纯化卵囊过程繁琐,易交叉污染。同为顶复门原虫的弓形虫和疟原虫均可以在体外细胞系中实现稳定传代。体外培养体系的成熟有利于实验操作,也有利于对虫体的不同处理(如药物、抑制剂等)和实时观察。如果能实现这一步的突破,将会极大加速球虫研究进程。研究显示柔嫩艾美耳球虫可以在鸡肾原代细胞中完成生活史(Shietal., 2008),但遗憾的是由于其卵囊产量极低,还不能作为稳定的球虫体外传代系统。而最新的研究表明,柔嫩艾美耳球虫也可以在CLEC-213等细胞系中发育成为配子体 (Bussièreetal., 2018),但未能检测到卵囊产生。这些研究说明了球虫体外培养系统理论上是可行的,但是还需要投入大量的研究工作。第二是球虫缺乏基因组编辑工具。本实验室针对柔嫩艾美耳球虫开发了一套基于稳定表达CRISPR-Cas9系统的球虫基因敲除工具虫株,现已成功实现球虫基因敲除(胡丹丹等,未发表数据),希望该系统在将来能为球虫功能基因研究提供帮助。另一方面,随着基因编辑在球虫中的应用,一些问题也迎面而来。目前在球虫中使用的筛选标记主要有黄色(或绿色)荧光蛋白、红色荧光蛋白以及弓形虫耐药基因DHFR-TS,这些筛选标记现已不能完全满足球虫研究,特别是多基因敲除等类似的研究。所以,及早解析球虫耐药性机制,找出一系列耐药基因,也可同时服务于球虫分子生物学研究。
