氢分子和氢分子离子轨道几何参数的研究
2018-03-12侯秀芳
何 帅,侯秀芳
(1.延安大学西安创新学院 理工系,陕西 西安 710000;2.延安大学 化学与化工学院,陕西 延安 716000)
分子轨道几何参数是了解分子结构的基本构型参数,可以由实验测量得到。键长是分子结构的重要参数之一,它对于讨论化学键的性质,研究物质的微观结构以及阐明微观结构与宏观性能之间的关系等方面都具有重要作用。对于分子轨道的精确计算,目前普遍认可的是薛定谔方程。1927年,沃尔特·海特勒(Walter Heitler)和弗里茨·伦敦(Fritz London)首次用波函数ψ1和ψ2的线性组合计算氢分子键长。虽然所得的氢分子键长与实验值误差较大,但对量子化学的创立做出了不可磨灭的贡献。到了20世纪60年代,Kolos等人也给出了氢分子键长的精确解[1-6]。虽然薛定谔方程可以很精确地计算氢分子和氢分子离子的轨道几何参数,但这些计算过程是极其复杂的。
笔者借助氢分子轨道和氢分子离子轨道电子所在的特殊位置,用一种新颖的宏观方法计算氢分子键长、氢分子离子键长,所得的理论计算值与实验值较高精度的吻合,并且计算过程极为简单,计算过程中不含任何人为定义的参数。同时给出了氢分子离子半长轴和半短轴的理论预测值。
1 氢分子键长计算
根据Pauli原理,当两个氢原子具有自旋相反的电子时,它们的电子云可以叠加,此时在两核之间出现了两个球冠面组成的电子云。
若从静电引力角度考察时,在某一特定的核间距下,体系处于一种相对平衡状态,即基态氢分子。此时的平衡核间距Re即为氢分子键长。两个氢原子的距离为Re时,处于平衡状态,距离小于Re时排斥,大于Re时吸引。这个结果表明,氢分子共价键中,库仑平均等效相互作用是有效的,并可以用来理解其力学平衡[6-9]。
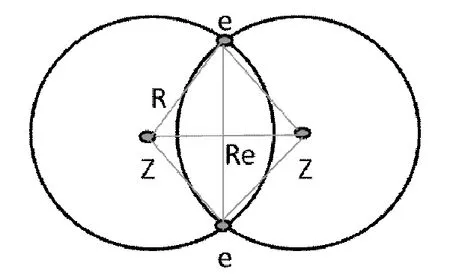
图1 氢分子结构图
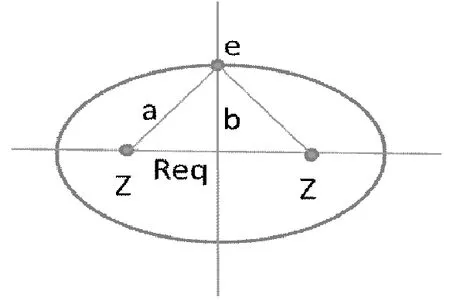
图2 氢分子离子结构图
如图1所示,是某一时刻氢分子的结构图,可以用经典力学计算氢分子键长Re。图中Z代表质子,e代表电子,R为氢原子半径,其值为0.529Å。两质子间的斥力为:
(1)
式中,Re即为氢分子核间距;z为质子的电荷量,其值为Q=1.60×10-19C。
假设两电子之间的间距为Rx,则在该时刻两电子之间的斥力为:
(2)
两个电子对任一质子的距离均为R(即基态氢分子的原子半径),则其静电引力均为:
(3)
式中,R为氢原子半径,其值为0.529Å ,e为电子的电荷量,其值为Q=1.60×10-19C。
综上:氢分子的成键机理,可以简单的认为仅仅是静电力的力学平衡所致,即在该时刻氢分子处于一种动态平衡的状态。
如图1所示,分析该时刻氢分子的结构图,由于两个电子对任一质子的静电引力均相等,则质子与电子之间构成菱形。
根据最大重叠原理:在形成共价键时,原子间总是尽可能的沿着原子轨道最大重叠的方向成键。成键电子的原子轨道重叠程度越高,电子在两核间出现的概率密度也越大,形成的共价键也越稳固[10]。
若要氢分子的重叠部分最大,同时遵循其力学平衡。等价于图1所示时刻,电子与质子所构成的菱形面积越大。面积最大的菱形是正方形。正方形两条对角线相等,即在该时刻质子间距离和电子间距离相等。
(4)
解得:Re=0.748Å ,实验值为0.741Å[4],相对误差为小于1%,理论值与实验值较好的吻合。
2 氢分子离子键长计算
氢分子离子是在用电子束轰击放电管的氢气时在光谱中观察到的,它的性质活泼,寿命很短,一旦与其它物质接触立即夺取电子而形成氢分子[6]。
如图2所示,是某时刻氢分子离子的结构图。氢分子离子的产生机理,可以认为是图2中氢分子中某一氢原子偶然失去电子,此时整个体系的引力减小,对应着两个原子排斥力也减小,即核间距增大。此时的核间距Req即为氢分子离子的键长。
由于体系的吸引力减小为原来的一半,则排斥力也会减小为原来的一半,根据这一原理列方程式,则:
(5)

氢分子离子键长的实验值为2a0,理论值和实验值较好的吻合。
3 氢分子离子半长轴和半短轴理论值预测
如图2所示,是某时刻氢分子离子的结构图。图中a为氢分子离子的半长轴,b为氢分子离子的半短轴。氢分子离子的轨道指数ζ=1.24,即有效核电荷数为1.24。假定氢分子转变为氢分子离子后仍然是静电引力提供向心力。则氢分子半短轴可以用下面的方程式计算:
(6)
经计算,氢分子离子的半短轴和半长轴分别为:
b=0.589Å
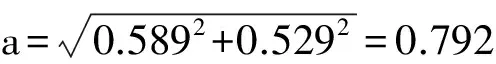
4 讨论
目前认为经典力学不能解决原子的激发态、光谱、各种轨道(s、p、d、f)的差异、轨道杂化、π键与共轭键等物质结构中的各种问题。笔者借助氢分子轨道和氢分子离子轨道电子所在的特殊位置,用一种新颖的宏观方法计算氢分子键长为0.748Å,氢分子离子键长为2a0,所得的理论计算值与实验值较高精度的吻合,并且计算过程极为简单,计算过程中不含任何人为定义的参数。同时给出了氢分子离子半长轴和半短轴的理论预测值,即b=0.589Å,a=0.792A。这表明,对于简单分子的轨道参数完全可以用经典力学较好的解决。
[1] 潘道皑,赵成大,郑载兴.物质结构[M].北京:高等教育出版社,1987,159-176.
[2] Kauzman W. Quantum Chemistry[M].New York: Academic Press Inc,1957:376-382,440-445.
[3] George B Bacskay, Sture Nordholm. Covalent bonding: the fundamental role of the kinetic energy[J].The Journal of Physical Chemistry A,2013,117:7946-7958.
[5] 鲍 林 L.化学键的本质[M].上海:上海科学技术出版社,1966:9-21.
[6] 陈 景.用经典力学计算氢分子的键长键能及力常数[J].中国工程科学,2003(6):39-43.
[7] 吴大猷.理论物理 (二)量子论与原子结构[M].北京:科学技术出版社,2008.
[8] 曾瑾言.量子力学(第 2卷) [M] .北京:科学出版社. 2000: 442-463.
[9] 黄明宝.量子化学教程[M].北京:科学出版社.2015.
[10] 李炳瑞.结构化学[M].北京: 高等教育出版社,2011.
(本文文献格式:何帅,侯秀芳.氢分子和氢分子离子轨道几何参数的研究[J].山东化工,2018,47(02):3-4.)
