海水吸入性急性呼吸窘迫综合征发病机制的研究进展
2018-03-12谢永宏金发光
谢永宏 金发光
海水淹溺是一个重要但又经常被忽视的公共卫生问题。20世纪90年代末世界银行和WTO颁布的第一个全球疾病负担(global burden of disease, GBD)就指出海水淹溺是最常见的死亡原因之一。据保守估计,每年全球约有50万人死于海水淹溺,非致死性溺水发生率比致死性溺水高出2倍以上,而且海水淹溺导致的急性肺损伤往往比淡水淹溺更为严重[1-2]。2008年发布的《世界儿童伤害预防报告》也指出非致命性溺水对终身健康和经济造成的影响超过其他任何伤害。尽管淹溺发生多、致死致残率高,但国际上对海水淹溺性肺损伤的研究并不多,国内外也未见关于海水淹溺性肺损伤发病机制的系统研究。Orlowski等[3-4]在上世纪八十年代末进行了部分海水淹溺性肺损伤相关基础研究,明确吸入淡水或海水后动物出现呼吸困难,频率加快,两肺布满湿啰音,气管内溢出泡沫状液体。PaO2、SaO2、血液pH值、实际碳酸氢盐(AB)显著降低,表明出现了进行性低氧血症和代谢性酸中毒,结合病理改变证明出现了肺水肿[5]。然而,海水吸入性急性呼吸窘迫综合征(seawater-aspiration acute respiratory distress syndrome, SW-ARDS)的救治和基础研究用于SW-ARDS的救治在国际上却比较少见。
近年来,随着我国海洋活动增加,SW-ARDS的救治和基础研究又逐渐引起国内学者的重视,并在SW-ARDS发病机制方面取得一定的成果。明确了炎症、氧化应激、细胞凋亡和细胞间通讯障碍等机制参与了SW-ARDS的发生和发展;逐步深入研究发现,除了这些多种肺损伤中均存在的病理机制以外,海水自身高渗特点和吸入海水后所引起的机体缺氧可能也参与了SW-ARDS的发生与发展[6-9]。如果在SW-ARDS发生发展过程中,早期能够准确预警,中期进行有效治疗,晚期进行积极救治,就可以明显改善其预后。但遗憾的是,在此之前,其具体发病机制一直不够明确,发生发展的关键环节也不清楚,救治方法始终不理想。
目前,人们已经逐渐认识到炎症反应是SW-ARDS的主要发病机制,参与炎症反应的细胞主要有多形核白细胞、巨噬细胞、血管内皮细胞、肺泡上皮细胞等。活化炎症细胞释放大量炎性介质,如弹性蛋白酶、组织蛋白酶、胶原酶、明胶酶、肿瘤坏死因子(tumor necrosis factor-α, TNF-α)、白细胞介素-1β(interleukin-1β, IL-1β)、IL-9、IL-8和血小板活化因子等,这些炎性介质作用于肺毛细血管内皮细胞和肺泡上皮细胞等诱发肺损伤[10-13]。既然全身和局部的炎症反应是ARDS发生和发展的重要机制,理论上糖皮质激素应当具有良好的治疗效果。然而,大量试图应用糖皮质激素控制炎症反应,预防和治疗ARDS的研究结果表明,糖皮质激素既不能预防ARDS的发生、甚至对早期肺损伤也没有治疗作用[14]。究其原因,不同的损伤因素所导致的ARDS既有相似临床特征,又有不同表现形式,这可能预示其发病机制既具有共同的作用环节又有特异性的信号途径,如果能够明确SW-ARDS发生发展的关键分子靶点并筛选出相应的抗炎药物将极有可能最终破解这一难题。现就SW-ARDS的发病机制研究的新进展做一全面综述,以便提高人们对SW-ARDS的深入认识。
一、SW-ARDS的动物模型制作
第四军医大学唐都医院在国内成功构建了大鼠SW-ARDS的动物模型,为后续研究奠定了基础。其制作方法为:用3%戊巴比妥钠(1.5 ml/kg)腹腔内注射的方式麻醉大鼠,仰卧固定并保持头部抬高45度,将大鼠舌头拉出,避免舌后坠窒息。右侧颈总动脉插管以备取血测量PaO2和PaCO2;采取甲状软骨处颈部正中切口,钝性分离暴露气管,取1 ml注射器刺入气管,以4 ml/kg海水缓慢注入气管内,在4 min内完成。大鼠迅速出现耳鼻发绀、呼吸急促,自口、鼻腔涌出粉红色泡沫样液体,双肺听诊布满湿性啰音,动脉血气示PaO2<50 mmHg,SaO2<45%左右,PaO2/FiO2(氧合指数)<150 mmHg提示海水淹溺模型建立成功[7]。
二、SW-ARDS发病机制
通过成功构建大鼠SW-ARDS动物模型的研究发现,当ARDS形成时均存在着缺氧、炎症反应、肺组织细胞凋亡等基本病理生理变化,并通过对炎症反应、高渗反应、细胞凋亡等多个信号通路的研究中明确了SW-ARDS发病机制。
1. 高渗启动、HIF-1α介导、PI3K/AKT信号途径激活是SW-ARDS发生发展的关键分子机制: 在研究过程中,通过建立不同渗透压梯度动物模型,发现高渗是海水淹溺性肺损伤最主要的启动因素,并诱导了HIF-1α高表达,引起肺组织缺氧。研究证实HIF-1α可激活PI3K/AKT信号途径,并引起下游炎症因子过度反应,导致肺组织原发性损伤。得出了以HIF-1α为中心的关于SW-ARDS肺损伤的理论,见图1。
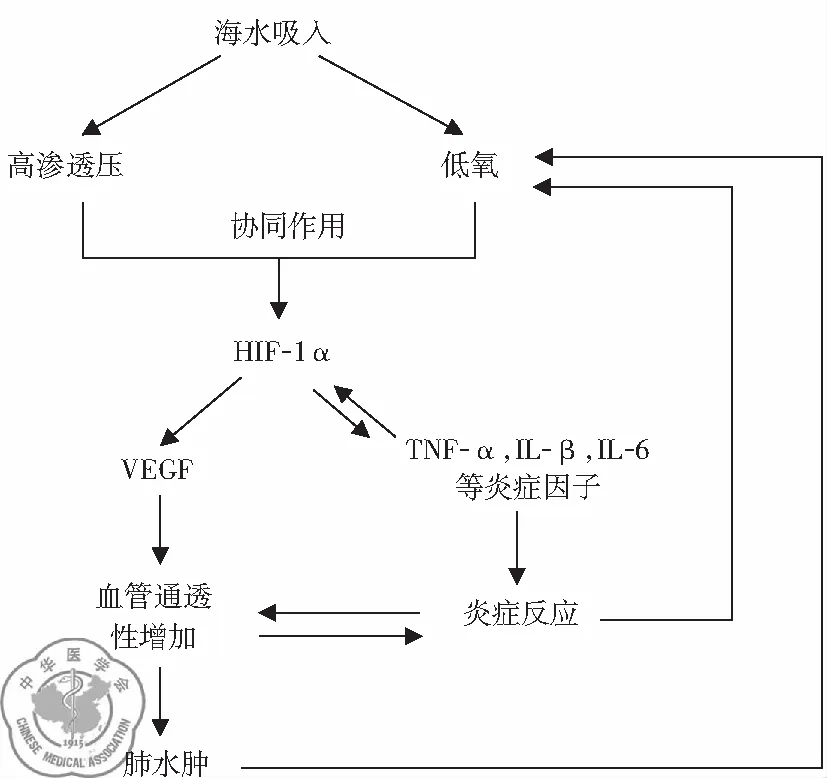
图1 HIF-1α在海水淹溺性肺损伤机制中的作用
海水淹溺导致肺部高渗、缺氧环境,高渗与缺氧协同作用更明显地促进肺组织HIF-1α的表达,增加的HIF-1α分别通过“HIF-1α-VEGF-肺血管通透性-肺水肿”和“HIF-1α-前炎症因子(TNF-α、IL-1β、IL-6)-肺组织炎症反应”两条路径加重肺血管通透性、肺水肿、肺组织炎症反应,进而使肺组织缺氧更加严重,形成一个以HIF-1α为中心的肺损伤逐渐加重的恶性循环[15]。
2. 高渗启动HIF-1α介导、Semaphorin 7A信号途径参与SW-ARDS的机制形成: 通过构建SW-ARDS大鼠模型的研究表明,海水吸入导致肺组织处于高渗缺氧的环境,该环境促进肺组织HIF-1 α的表达,HIF-1 α表达的增高又引起了血管内皮细胞SEMA7A表达的上调,增加的SEMA7A通过与内皮Plexin C1受体作用,引起血管内皮生长因子(vascular endothelial growth factor, VEGF)表达上调,最终导致肺血管通透性增加。另外上调的SEMA7A还通过与渗出的炎症细胞β1 integrin受体相互作用,激活p38MAPK以及NF-κB通路,最终加强肺组织炎症反应。而肺血管通透性增加以及炎症反应又进一步使肺组织缺氧更加严重,形成了一个以SEMA7A为中心的肺损伤逐渐加重的恶性循环[16],见图2。
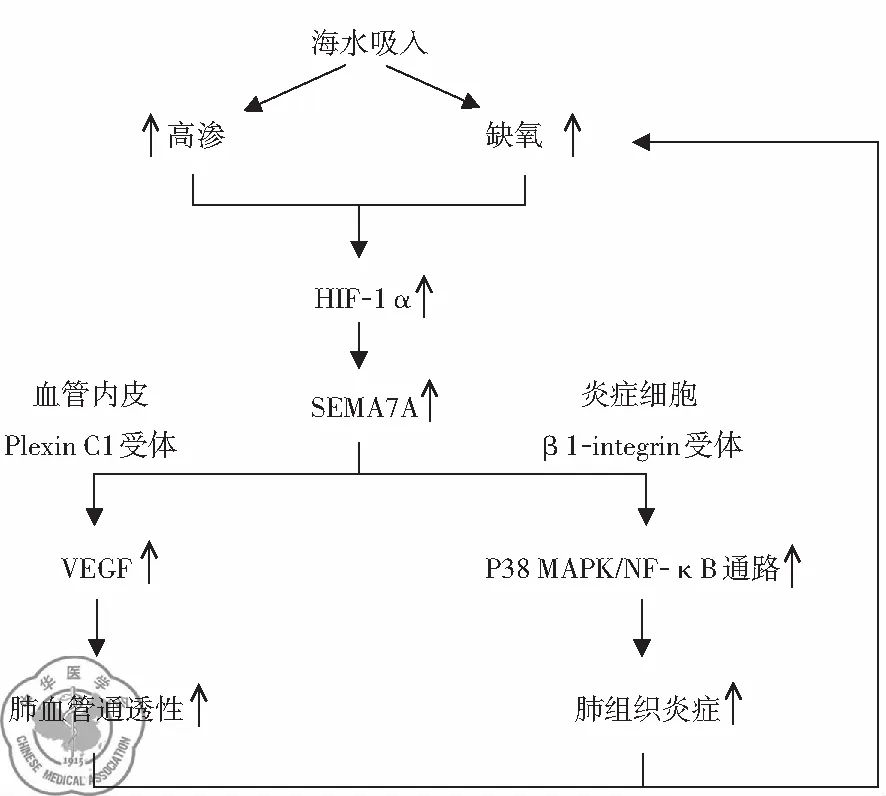
图2 “HIF-1α-SEMA7A途径”在SW-ARDS中的作用机制示意图
3. ANGⅡ/ANG1-7内质网应激反应并诱导肺组织细胞凋亡: 通过动物实验,及对细胞和多种分子生物学实验研究,检测SW-ARDS时肺组织中ANGⅡ/Ang1-7体系的表达,并进一步明确了ANGⅡ/Ang1-7体系在海水刺激下内质网应激诱导凋亡发生的机制。首次研究了Ang1-7在海水刺激后内质网应激过程中的变化,并验证了Ang1-7对内质网应激诱导凋亡的保护作用和机制。最终,我们提出了ANGⅡ/Ang1-7体系参与介导海水淹溺性肺损伤时内质网应激反应诱导凋亡的作用机制理论[10],见图3。

图3 ANGII/ Ang1-7体系在海水吸入型肺损伤中内质网应激反应诱导凋亡的作用机制
4. JNK-mtDNA-中性粒细胞胞外损伤途径参与SW-ARDS的形成: 研究显示海水可以刺激肺脏的组织细胞,扰乱细胞及线粒体的正常结构及功能,导致产生大量的mtDNA并释放到肺泡腔及肺细胞间隙中。释放的这些mtDNA可以损伤肺脏的细胞、破坏血气屏障,也可以凭借自身的免疫原性激活机体的免疫系统,引起中性粒细胞的黏附、渗出以及炎性因子的释放。mtDNA所引起的过度激活的免疫系统,尤其是中性粒细胞的激活,进一步加重了肺损伤的程度。实验证实mtDNA以及NETs的形成及产生损伤作用主要依赖于ROS,在肺组织细胞处于氧化应激状态时,更易受到mtDNA及NETs的破坏。而JNK-线粒体通路的激活可以引起线粒体功能紊乱,造成ROS在细胞内的积聚。通过特异性多肽Tat-SabKIM1可以抑制海水刺激时肺脏细胞的JNK向线粒体转移,继而维持线粒体的稳定,阻断JNK-线粒体通路激活,起到抑制细胞自噬及凋亡、减轻肺损伤的作用,见图4。

图4 海水吸入通过“JNK-mtDNA-NETs”途径介导肺组织损伤示意图
5. TonEBP/NFAT5信号通路介导肺组织损伤: 研究显示TonEBP/NFAT5信号通路参与SW-ARDS的发生发展,TonEBP/NFAT5的表达及活化受到p38 MAPK信号通路的调节。配方海水、高渗NaCl溶液和LPS刺激都能够引起细胞中p38 MAPK信号通路的异常活化;配方海水和高渗NaCl溶液对TonEBP/NFAT5及其下游分子表达的影响更为明显,但同比例的配方海水对TonEBP/NFAT5的影响强于高渗NaCl溶液;这说明以TonEBP/NFAT5为核心的信号通路是SW-ARDS发病机制中的独特环节。TonEBP/NFAT5通过调节Na+-K+-ATP酶的活性和表达参与调控SW-ARDS时肺水肿的发生[17],见图5。
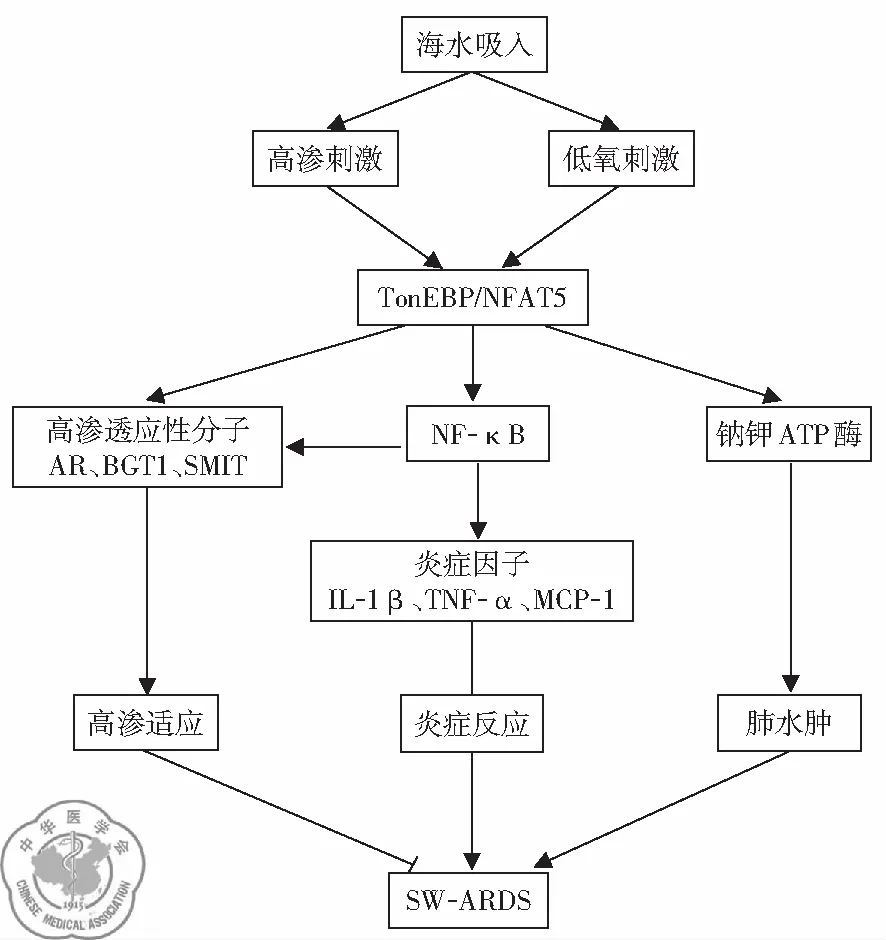
图5 TonEBP/NFAT5信号通路介导SW-ARDS机制示意图
6. p38 MAPK-p53途径”和“Fas/FasL途径”介导肺组织细胞凋亡: 新近研究表明野生型p53及其下游目的基因通过内源性途径调节了海水淹溺性肺损伤时肺泡上皮细胞的凋亡;Fas/FasL介导的细胞凋亡途径参与海水刺激时肺组织细胞的凋亡。此外,p38 MAPK作为p53的上游因子,通过磷酸化p53,部分地介导了海水吸入诱导的细胞凋亡调节[18],见图6。
综上所述,通过构建稳定的SW-ARDS大鼠模型,观察海水刺激后肺组织的损伤变化,发现SW-ARDS发生时存在缺氧、炎症反应、肺水肿、肺组织细胞凋亡4种基本病理生理变化。以吸入海水导致机体缺氧和肺组织局部高渗刺激为切入点,系统研究SW-ARDS的发病机制,先后明确了海水刺激通过“TonEBP/NFAT5-HIF-1α/NF-κB信号通路”和“JNK—线粒体DNA(mtDNA)—中性粒细胞胞外杀菌网络(NETs)”介导肺部炎症反应和肺水肿的机制,海水吸入导致ANGII/ANG1-7体系、“p38 MAPK-p53途径”和“Fas/FasL途径”异常表达引起肺组织细胞凋亡的机制。总体而言,肺水肿、肺部炎症反应和肺组织细胞凋亡三个方面共同引起海水吸入导致SW-ARDS的发生。因而,在海水淹溺救治中应当从这些途径入手,寻找诊断和治疗SW-ARDS的新方法。
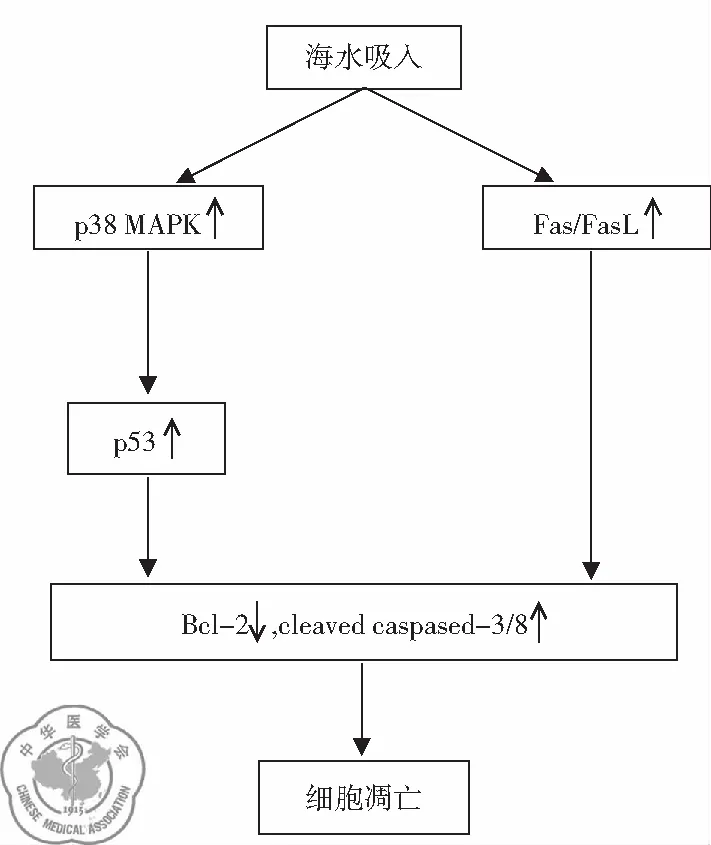
图6 海水吸入导致肺组织细胞凋亡示意图
1 李鹏程, 李聪聪, 鲁曦, 等. 海水干预下人肺泡上皮细胞活性氧及内质网应激水平的变化[J/CD]. 中华肺部疾病杂志(电子版), 2016, 9(5): 489-493.
2 李聪聪, 薄丽艳, 刘庆晴, 等. 蛋白激酶SPAK在海水淹溺性肺损伤中的表达和作用[J/CD]. 中华肺部疾病杂志(电子版), 2014, 7(1): 19-22.
3 Orlowski JP. Drowning, near-drowning, and ice-water submersions[J]. Pediatr Clin North Am, 1987, 34(1): 75-92.
4 Orlowski JP. Drowning, near-drowning, and ice-water drowning[J]. JAMA, 1988, 260(3): 390-391.
5 Gu MN, Xiao JF, Huang YR, et al. Study of direct lung injury by seawater in canine models[J]. Di Yi Jun Yi Da Xue Xue Bao, 2003, 23(3): 201-205.
6 Ji MH., Tong JH., Tan YH., et al. Erythropoietin pretreatment attenuates seawater aspiration-induced acute lung injury in rats[J]. Inflammation, 2016, 39(1): 447-456.
7 Ma L, Chen X, Wang R, et al. 3,5,4′-Tri-O-acetylresveratrol decreases seawater inhalation-induced acute lung injury by interfering with the NF-kappaB and i-NOS pathways[J]. Int J Mol Med, 2016, 37(1): 165-172.
8 Diao M., Zhang S., Wu L., et al. Hydrogen Gas Inhalation Attenuates Seawater Instillation-Induced Acute Lung Injury via the Nrf2 Pathway in Rabbits[J]. Inflammation, 2016, 39(6): 2029-2039.
9 Ma J, Wang Y, Wu Q, et al. Seawater immersion aggravates burn-associated lung injury and inflammatory and oxidative-stress responses[J]. Burns, 2017, 43(5): 1011-1020.
10 Li C, Bo L, Li P, et al. Losartan, a selective antagonist of AT1 receptor,attenuates seawater inhalation induced lung injury via modulating JAK2/STATs and apoptosis in rat[J]. Pulm Pharmacol Ther, 2017, 45: 69-79.
11 Ma L, Li Y, Zhao Y, et al. 3,5,4′-tri-O-acetylresveratrol ameliorates seawater exposure-induced lung injury by upregulating connexin 43 expression in lung[J]. Mediators Inflamm, 2013, 2013: 182132.
12 Moraes TJ, Zurawska JH, Downey GP. Neutrophil granule contents in the pathogenesis of lung injury[J]. Curr Opin Hematol, 2006, 13(1): 21-27.
13 Bian Z, Guo Y, Ha B, et al. Regulation of the inflammatory response:enhancing neutrophil infiltration under chronic inflammatory conditions[J]. J Immunol, 2012, 188(2): 844-853.
14 Hudson LD, Hough CI. Therapy for late-phase acute respiratory distress syndrome[J]. Clin Chest Med, 2006, 27(4): 671-677.
15 Liu Z, Zhang B, Wang XB, et al. Hypertonicity contributes to seawater aspiration-induced lung injury: Role of hypoxia-inducible factor 1alpha[J]. EXP LUNG RES, 2015, 41(6): 301-315.
16 Zhang M, Yan X, Liu W, et al. Endothelial semaphorin 7A promotes seawater aspiration-induced acute lung injury through plexin C1 and beta1 integrin[J]. Mol Med Rep, 2017, 16(4): 4215-4221.
17 Guo K, Jin F. NFAT5 promotes proliferation and migration of lung adenocarcinoma cells in part through regulating AQP5 expression[J]. Biochem Biophys Res Commun, 2015, 465(3): 644-649.
18 Han F, Luo Y, Li Y, et al. Seawater induces apoptosis in alveolar epithelial cells via the Fas/FasL-mediated pathway[J]. Respir Physiol Neurobiol, 2012, 182(2-3): 71-80.
