志贺氏菌检测和分群PCR方法的建立
2018-03-09王海艳赵治国郭文秀陈宇飞赵林立
王海艳,赵治国,催 强,郭文秀,陈宇飞,赵林立
(内蒙古出入境检验检疫局,内蒙古呼和浩特 010020)
志贺氏菌对许多国家和地区的人类健康造成了严重危害。特别在不发达国家和发展中国家,由于缺乏清洁的水源和必要的卫生医疗设备等,由其引发的公共卫生问题更加严重[1-2]。大多数志贺氏菌病由3种志贺氏菌引起,即福氏志贺氏菌、宋内志贺氏菌和痢疾志贺氏菌。近年来,由于多种耐药志贺氏菌株的出现,许多国家和地区的志贺氏菌病病例数量不断增加。志贺氏菌病的早期确诊需要准确、快速的检测方法。目前,对志贺氏菌的鉴定分群仍然依靠常规生化鉴定方法、免疫学方法。但这些方法复杂、耗时、耗力、敏感性低。一些学者研究建立了针对志贺氏菌属的分子生物学检测技术,这些传统PCR方法存在一定的局限性,容易出现误检或漏检。因此,建立一种准确、可靠、快捷的志贺氏菌鉴定和分群方法尤为重要。
本研究根据志贺氏菌的独特基因,设计引物进行PCR分析。设计的引物用于检测志贺氏菌属,同时对临床上与志贺氏菌病有关的3种志贺氏菌(即福氏志贺氏菌、宋内志贺氏菌和痢疾志贺氏菌)进行分群,以弥补目前志贺氏菌分子生物学检测方法的不足。
1 材料与方法
1.1 材料
1.1.1引物 根据志贺氏菌invC、rfc、wbgZ和rfpB 等基因,利用引物在线设计网站(http∶//bioinfo.ut.ee/primer3-0.4.0/)分别设计的引物,用于鉴定志贺氏菌属、福氏志贺氏菌、宋内志贺菌和痢疾志贺菌,并以根据ompA基因设计的引物为参照。引物由上海奥吉生物技术有限公司合成(表1)。
1.1.2主要试剂 志贺氏菌增菌肉汤、志贺氏菌显色培养基:购于北京陆桥公司;Tris Base、EDTA、溶菌酶、异硫氰酸胍、sarkosyl、 Taq酶、dNTPs、PCR缓冲液、溴化乙锭、分子量100 bp DNA Ladder Marker(100~1 500 bp):购自大连宝生物公司;低熔点琼脂糖(电泳级)和其它试剂:国产分析纯。
1.1.3主要仪器设备 低温冷冻高速离心机、微量移液器、PCR仪、电泳槽、电泳仪、凝胶成像分析系统、恒温培养箱等。
1.1.4菌株 福氏志贺氏菌株(CMCC51571、CMCC51572、ATCC12022、CMCC51579、CMCC51240),鲍氏志贺氏菌株(CMCC51346、CMCC51585、CMCC51586、ATCC9207),宋内志贺氏 菌 株(CMCC51592、ATCC11060、ATCC29930、ATCC25931、CMCC51334),痢 疾 志 贺 氏 菌 株(CMCC51105、CMCC51570、CMCC51252), 单增李斯特氏菌CMCC54002株,英诺克李斯特氏菌ATCC33090株,威氏李斯特氏菌ATCC35897株,斯氏李斯特氏菌ATCC35967株,格氏李斯特氏菌ATCC25401株,枯草芽孢杆菌CMCC63501-21株,大肠杆菌CMCC44116株,沙门氏菌CMCC50079株,金黄色葡萄球菌CMCC26001株,乙型溶血型链球菌CMCC32210株,肺炎克雷白氏菌CMCC46114株,弗氏柠檬酸杆菌CMCC48001株,阪崎肠杆菌ATCC29544株,蜡样芽孢杆菌CMCC63303株,阴沟肠杆菌ATCC13047株,绿脓杆菌ATCC27853株,小肠结肠耶尔森氏菌ATCC23715株,绵羊李斯特氏菌ATCC19119,大肠杆菌O157∶H7 ATCC43895株:购自中国药品生物制品检定所和上海汉尼公司:
1.1.5样品 消毒鲜奶、雪糕、酸奶、香肠、熟肉和生肉:购于超市;原奶:购于个体养牛场;奶粉:送检样品。
1.2 方法
1.2.1PCR特异性检测
1.2.1.1细菌培养 将所有细菌接种于TSB-YE中,37 ℃培养1 d。分别取1.5 mL细菌培养液,8 000 r/min离心5 min,弃上清,将沉淀用0.5 mL TE 洗1次,然后直接用于DNA提取或存于−20 ℃备用。
1.2.1.2DNA提取 参照Pitcher等[3]方法进行。将沉淀干燥后用60~70 µL灭菌双蒸水溶解,将其直接用于PCR或存于−20 ℃冰箱中备用。

表1 本研究所用的引物
1.2.1.3PCR扩增 以提取的细菌DNA为模板,分别用各对引物进行PCR扩增。反应体系均为 25 µL:模板 DNA 2 µL,EX Taq DNA 聚合酶(5 U/µL)0.25 µL,10×EX Taq Buffer 2.5 µL,dNTP混合物(2.5 mmol/L)各1 µL,上游引物(10 pmol/ µL)1 µL,下游引物(10 pmol/ µL)1 µL,灭菌蒸馏水17.25 µL;循环参数:94 ℃预变性3 min,94 ℃变性30 s,gen、flex和ctr引物65 ℃(son引物67 ℃,dys引物63 ℃)退火30 s,72 ℃延伸30 s,30个循环,最后72 ℃终延伸3 min;用3%琼脂糖凝胶电泳后分析结果。
1.2.2PCR敏感性试验
1.2.2.1细菌定量接种与培养 按1~3、12、27、53、105 cfu/(25 g·mL-1)的量,将各株志贺氏菌分别接种到加入25 mL灭菌生理盐水的225 mL 志贺氏菌增菌肉汤中(接菌的同时用志贺氏菌显色培养基平板计数),并设未加菌的阴性对照,于41.5 ℃,厌氧培养18 h;各取1 mL培养物,8 000 r/min离心5 min;将沉淀用0.5 mL TE 缓冲液(pH 8. 0)悬起,移入1.5 mL离心管中,8 000 r/min离心5 min;弃尽上清后,直接用于DNA提取或存于−20 ℃冰箱中备用。
1.2.2.2DNA提取 方法同 1.2.1.2。
1.2.2.3PCR扩增 方法同1.2.1.3。
1.2.3抗干扰试验 将志贺氏菌与非志贺氏菌属细菌(乙型溶血性链球菌)混合物按相应接种量,分别接种志贺氏菌增菌肉汤(接菌的同时用志贺氏菌显色培养基平板计数)。按照1.2.2的方法进行培养、核酸提取和PCR扩增试验,同时采用传统培养法(GB 4789.5)作对比试验。
1.2.4人工接种样品验证试验 将消毒鲜奶、雪糕、酸奶、香肠、熟肉、生肉、原奶和奶粉,各取5个样,经常规方法检验无志贺氏菌污染后,用作PCR检测方法的人工接种试验。每个样取25 g/mL加入到225 mL志贺氏菌增菌肉汤中;均质后,按相应细菌量进行人工接种试验,并按1.2.2中的方法进行转接、培养、DNA提取及PCR扩增;同时将增菌肉汤划线接种于志贺氏菌显色培养基平板进行分离培养,挑取可疑菌落进行PCR鉴定;采用ISO的传统培养法作对比试验。
1.2.5实际样品检测 对本实验室送检的和市场上购买的1 100份样品进行检测,并与ISO的传统培养法进行比较。
2 结果
2.1 PCR特异性确定
引物genF/genR,除了非志贺氏菌属细菌外,在所有志贺氏菌属细菌中都扩增出了878 bp的特异性片段(图1-A);引物flexF/flexR,仅在福氏志贺氏菌扩增出539 bp片段,其它志贺氏菌属细菌和非志贺氏菌属细菌均未扩增出相应大小片段(图1-B);引物sonF/sonR,仅在宋内志贺氏菌可扩增出434 bp片段,其它志贺氏菌属细菌和非志贺氏菌属细菌均未扩增出相应大小片段(图1-C);引物dysF/dysR,仅在痢疾志贺氏菌可扩增出214 bp片段,其它志贺氏菌属细菌和非志贺氏菌属细菌均未扩增出相应大小片段(图1-D);引物ctrF/ctrR,在所有细菌中均能够扩增出1 322 bp的特异性片段(图1-E)。
2.2 PCR敏感性检测
以生理盐水替代食品,分别将福氏志贺氏菌、宋内志贺氏菌和痢疾志贺氏菌定量接种于志贺氏菌增菌肉汤中,两步增菌后进行PCR检测,可见增菌后 PCR 的最低检出限为 1~3 cfu/(25 g·mL-1),证明该PCR方法具有极高的敏感性(图2)。
2.3 抗干扰试验
通过试验可见,在人工污染干扰菌的情况下,本试验建立的PCR方法和培养法均可检出志贺氏菌,但培养法比较费力。在非志贺氏菌属细菌存在的情况下,由于在增菌肉汤中加入了抑菌剂,使得非志贺氏菌属细菌的生长受到抑制,所以采用两种方法均比较容易检出目标菌(表2)。

表2 志贺氏菌抗乙型溶血性链球菌干扰的试验结果
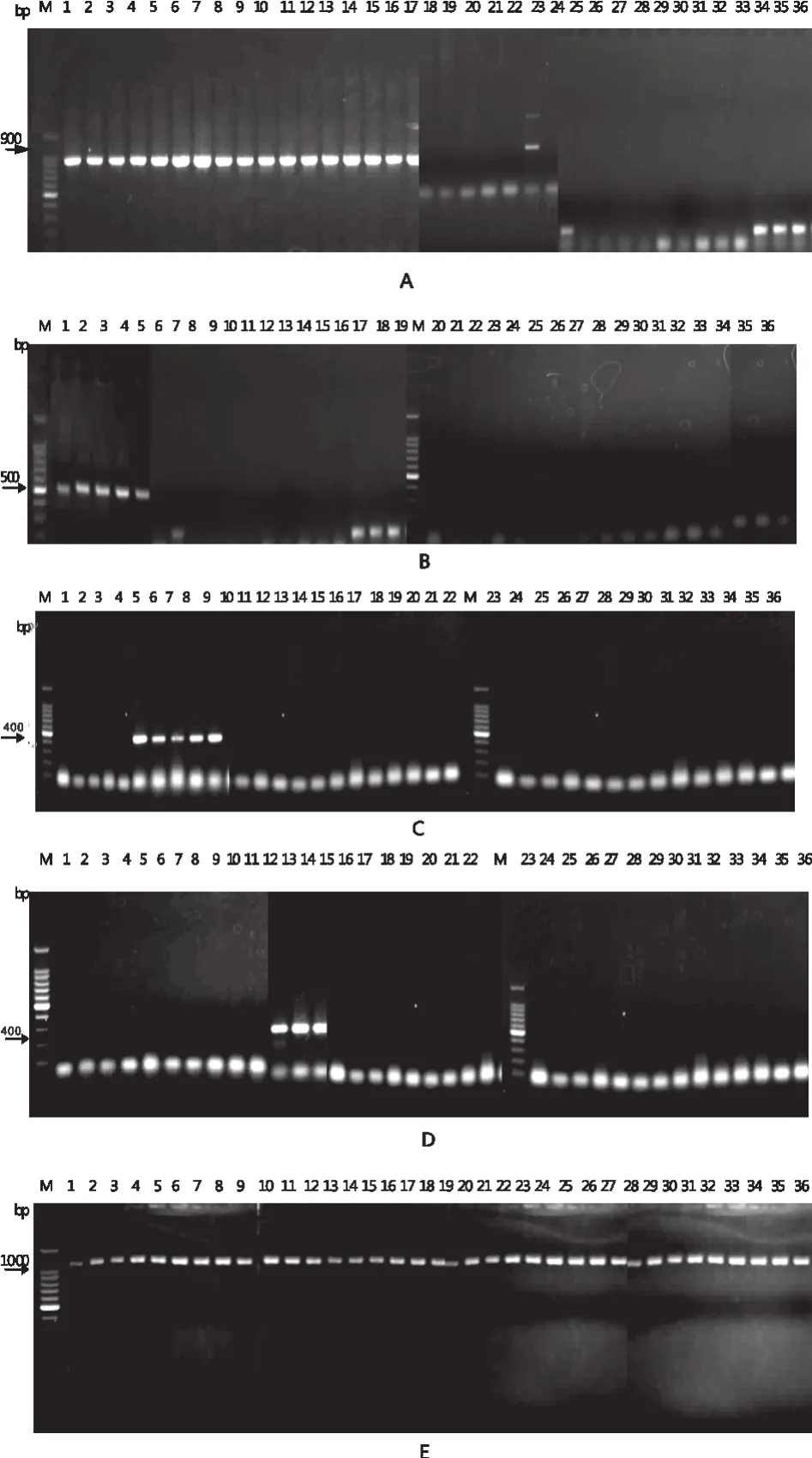
图1 不同引物PCR扩增结果

图2 PCR敏感性检测结果
2.4 人工污染食品中志贺氏菌的检出情况
将人工污染样品于41.5 ℃18 h增菌后的增菌肉汤直接进行PCR分析,发现在消毒奶、冰淇淋、酸奶、奶酪、熟肉和香肠中的志贺氏菌检出限为1~3 cfu/(25 g·mL-1),在原奶、生肉和奶粉中的检出限分别为≤ 12、27 和≤ 27 cfu/(25 g·mL-1)。将增菌肉汤划线接种于固体培养基分离培养后再进行PCR分析,发现在所有检样中均能检测到志贺氏菌,与GB4789.5传统培养法的检测限一致,均达到了1~3 cfu/(25 g·mL-1),证明该 PCR 方法适合不同类型样品的常规检测分析(表3)。
2.5 实际样品检测
对本实验室送检的1 100份样品进行检测,并与传统培养法(GB 4789.5)进行比较,均未分离到志贺氏菌,与GB4789.5的传统培养法的检测结果一致。
3 讨论
目前,国内外有许多研究者建立了食品中志贺氏菌属的PCR检测方法,如国外Houng等[4]建立的志贺氏菌属的PCR检测方法。但其建立的方法因存在一定的局限性而出现错检或漏检。在我国,许龙岩等[5]、蔡亦红[6]等建立的食品中PCR检测方法均只能鉴定志贺氏菌属。并且上述传统的PCR方法通常选择侵袭质粒(ipaH)基因、O抗原合成基因和16S基因作为目标基因,因而检测通常是基于序列的多态性或序列差别,而不是基于基因序列的缺失或存在。本研究根据志贺氏菌独特的基因设计引物进行PCR分析,将设计的引物用于检测志贺氏菌属,同时对临床上重要的志贺氏菌(即福氏志贺氏菌、宋内志贺氏菌和痢疾志贺氏菌)进行区分。
一个新的方法在实验室应用之前,必须与得到认可的方法进行对比,从而得到确证。本研究通过细菌干扰试验将本室建立的PCR方法与传统培养法进行对比,发现该PCR方法与传统培养法具有相同的检出水平,但PCR方法更省时、方便、快捷。
为了提高检测的灵敏性,在PCR检测前,增加了增菌步骤。其优点在于:使损伤的细胞得以修复,使细胞的数量增加;稀释样品中的抑制剂及死细胞,从而避免出现假阴性或假阳性,增加检测的灵敏度,提高检测的可靠性。

表3 人工污染样品中志贺氏菌的的检出情况 单位:份
4 结论
本研究表明,经过增菌之后,直接对增菌肉汤进行PCR检测,在其它杂菌污染轻微的食品中,检测的灵敏度可达 1~3 cfu/(25 g·mL-1),即使在有大量杂菌干扰的原奶、生肉和奶粉中,检测限也分别达到了≤ 12、27和≤ 27 cfu/(25 g·mL-1)。因此,增菌步骤对提高检测的灵敏度十分必要。另外,将增菌肉汤划线接种于固体培养基分离培养后对可疑菌落再进行PCR鉴定,发现在所有检样中均能检测到志贺氏菌,与GB4789.5的传统培养法的检测限一致,均达到了 1~3 cfu/(25 g·mL-1),说明该方法的检测灵敏度与传统培养法相同,可用于样品中志贺氏菌的常规检测分析。
[1] BENNISH M L,WOJTYNIAK B J. Mortality due to shigellosis:community and hospital data[J]. Reviews of infectious diseases,1991,13:245-251.
[2] NIYOGI S K. Shigellosis[J]. Journal of microbiology,2005,43:133-143.
[3] PITCHER D G,SAUNDERS N A,OWEN R J. Rapid extraction of bacterial genomic DNA with guanidium thiocynate[J]. Letters in applied microbiology,1989,8:151.
[4] HOUNG H S H,SETHABUTR O,ECHEVERRIA P. A simple polymerase chain reaction technique to detect and differentiate Shigella and enteroinvasive Escherichia coli in human feces[J]. Diagnostic microbiology and infectious disease,1997,28:19-25.
[5] 许龙岩,李志勇,王志强,等. PCR 方法检测志贺氏菌的研究[J]. 检验检疫科学,2003,13(5):28-29.
[6] 蔡亦红. PCR 快速检测食品中志贺氏菌方法的建立[J].中国人兽共患病学报,2008,24(2):150-153.
