改良Trizol法提取富含花青素马铃薯块茎的总RNA
2018-03-04刘芳陈广侠马蕾杨煜郭晓杨晓慧董道峰杨元军
刘芳 陈广侠 马蕾 杨煜 郭晓 杨晓慧 董道峰 杨元军
摘要:富含花青素的马铃薯块茎因含有大量多糖和多酚类次级代谢产物而难以大量提取高质量的总RNA。本研究以紫色和红色马铃薯为材料,利用改良Trizol法实现了块茎总RNA的快速高质量提取。试验结果表明,在Trizol法中添加2%(V/V)-巯基乙醇、0.75%(W/V)十六烷基三甲基溴化铵(CTAB)和7.5%(W/V)醋酸钾(KOAc),可以有效去除多糖、多酚类物质,获得高产、完整的总RNA。改良Trizol法提取时间短、操作方便,提取的RNA通过了actin RT-PCR和18S rRNA RT-qPCR检验,可以用于后续的分子生物学试验。
关键词:马铃薯;块茎;花青素;RNA提取;醋酸钾;改良Trizol法
中图分类号:S532.035.3文献标识号:A文章编号:1001-4942(2018)12-0114-05
馬铃薯是粮菜兼用作物,具有丰富的营养,有“地下苹果”的美誉。紫色和红色马铃薯除具有普通马铃薯的优良性状,还含有大量花青素[1]。花青素具有杀菌、清除氧自由基和抗衰老的作用,可以降低心脑血管疾病、癌症和糖尿病等的发生[2, 3]。随着人们对富含花青素马铃薯重要性认识的增加,此类材料的分子生物学研究也逐渐开展起来。RNA提取是分子生物学研究的重要环节,RT-PCR、RT-qPCR、Northern杂交、cDNA文库构建均需要高质量的RNA。目前,用于马铃薯块茎RNA的提取方法主要有Trizol法[4, 5]、CTAB法、异硫氰酸胍法[6]、SDS-酚法[7]、LiCl法[8]。由于富含花青素的马铃薯块茎含有大量多糖、酚类等次级代谢产物[9, 10],这些提取方法难以满足此类马铃薯块茎总RNA提取的需要。获得大量高质量的块茎总RNA成为富含花青素马铃薯分子生物学研究的迫切需要,因此本试验采用改良Trizol法研究了紫色和红色马铃薯块茎RNA的高质量提取方法,以期为富含花青素马铃薯材料的分子生物学研究奠定基础。
1 材料与方法
1.1 供试材料与试剂
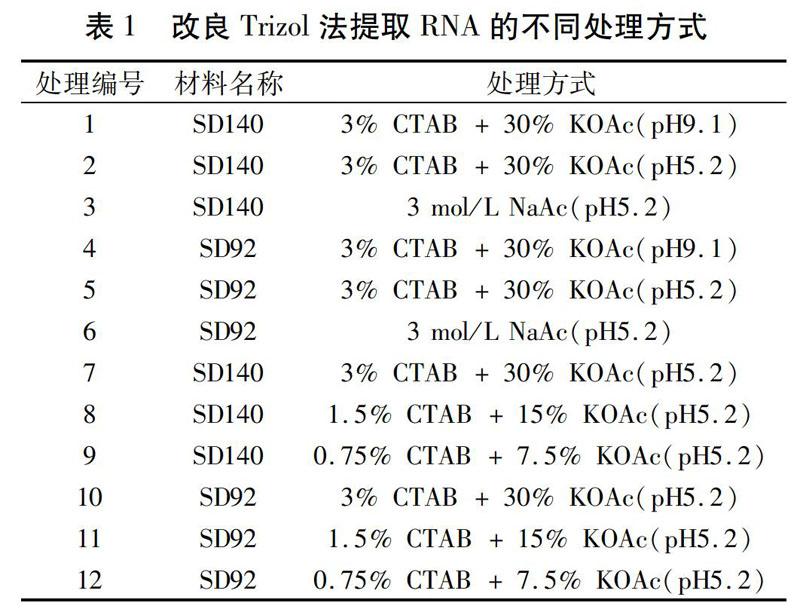
供试材料:马铃薯四倍体材料SD92和SD140,其中SD92为紫皮紫肉类型,SD140为红皮红肉类型。SD92和SD140种植于温室。70 d收获,收获后的块茎洗净后用吸水纸吸干水分,迅速切成片后用液氮速冻,置于-80℃保存备用。
试剂:焦碳酸二乙酯(DEPC)、交联聚乙烯吡咯烷酮(PVPP)、十二烷基磺酸钠(SDS)、三羟甲基氨基甲烷(Tris)、乙二胺四乙酸(EDTA)、氯化锂(LiCl)、低熔点琼脂糖(Agarose)、溴化乙锭(EB)均为 Sigma 公司产品;Trizol 试剂购自Ambion(USA);PrimeScriptⅡ 1st Strand cDNA Synthesis Kit为TaKaRa产品;DNaseⅠ购自Thermo(USA); RT-qPCR采用康为世纪公司UltraSYBR Mixture;Marker为DL1000 DNA Marker (TaKaRa),引物由上海生工合成;醋酸钾(KOAc)、醋酸钠(NaAc)等其他试剂均为国产分析纯。
器皿处理:将所用的枪头及离心管用0.1% DEPC灭菌水浸泡12 h,随后121℃灭菌20 min,倒掉废液,然后80℃烘8 h。对于所用的研钵和金属药勺,用锡箔纸封口后在 180℃烘烤8 h。所用试剂均用无RNase的0.1% DEPC灭菌水配制。
1.2 RNA提取方法
方法一:采用Trizol法和改良的Chan法提取RNA,Trizol法参照说明书,改良的Chan法具体步骤参照赵宝勰等的方法[9]。
方法二:采用改良的Trizol法提取RNA,具体步骤如下:(1)取马铃薯块茎适量,加液氮和少许PVPP充分研磨,然后取0.1 g研磨材料,加入1 mL的Trizol和2% (V/V) -巯基乙醇混匀,室温放置10 min后,4℃、12 000 r/min离心10 min;(2)取上清于1.5 mL离心管中,加入200 μL氯仿混匀,室温放置10 min后,4℃、12 000 r/min离心10 min;(3)取上清于1.5 mL离心管中,然后分别加入1/4氯仿和等于上清体积的其他溶液(表1)颠倒混匀,室温放置10 min,12 000 r/min离心10 min;(4)取上清,加入等体积的异丙醇,颠倒混匀,室温放置10 min,12 000 r/min离心10 min;(5)弃上清,加入1 mL的75%(V/V)预冷乙醇短暂离心,洗涤沉淀后,室温晾干约5~10 min。(6)RNA干燥后用20 μL DEPC-H2O溶解,-80℃保存。140 V(6 V/cm)电泳15 min,溴化乙锭(EB)染色,Bio-Rad (USA)凝胶成像仪检测RNA的完整性;利用 Nanophotometer P330 (IMPLEN,Germany)测定RNA的质量和浓度。
1.3 RNA的RT-PCR和RT-qPCR检测
首先采用DNase Ⅰ(Thermo,USA)对RNA进行消化,具体步骤如下:取2 μL采用1.5% CTAB+15% KOAc(pH5.2)提取的RNA,1 μL 10buffer,1 μL DNaseⅠ,DEPC-H2O补足10 μL。37℃消化60 min,最后加入50 mmol/L EDTA 1 μL,65℃、10 min灭活DNaseⅠ。PCR检测消化结果。取1 μL消化完全的RNA为模板进行反转录,反转录采用PrimeScriptⅡ 1st Strand cDNA Synthesis Kit(TaKaRa),具体步骤参照说明书。利用PCR扩增马铃薯肌动蛋白基因actin(XM_006351284.1)片段来检测消化和反转录的结果。PCR反应体积为50 L,引物分别为actin F:5′-GATGGTGTCAGCCACAC-3′和actin R:5′-ATTCCAGCAGCTTCCATTCC-3′。PCR程序:94℃预变性3 min;95℃变性30 s,55℃退火30 s,72℃延伸1 min,40个循环;最后72℃延伸10 min。分别以1 L消化产物和反转录产物为模板进行PCR扩增actin片段,最后1% 琼脂糖电泳检测消化和反转录结果。
对反转录产物进行RT-qPCR检测,50 μL反应体系,25 μL 2UltraSYBR Mixture (CWBIO)、1 μL cDNA、0.2 μmol/L引物和ddH2O。RT-qPCR反应在iCycler iQ (Bio-Rad,Hercules,CA,USA)中进行,流程为95℃ 15 s,60℃ 1 min,37个循环,3次重复。扩增基因为18S rRNA,引物分别为18S F:5′-CCTGGTCGGCATCGTTTA-3′,18S R:5′-CGAACAACTGCGAAAGCAT-3′。
2 结果与分析
2.1 Trizol法与改良Chan法提取RNA
Trizol法提取RNA时,未見紫色马铃薯和红色马铃薯块茎的RNA条带,RNA未能成功提取,同时没有DNA残留。利用改良Chan法提取出的RNA有弥散带,RNA降解严重,并且有大分子量的条带,说明有DNA残留。
2.2 改良Trizol 法提取RNA
在紫色马铃薯SD92和红色马铃薯SD140块茎中,3个处理均可以提取出RNA。而且3% CTAB + 30% KOAc(pH9.1)处理和3% CTAB + 30% KOAc(pH5.2)处理效果最佳,18S rRNA和28S rRNA条带清晰完整,且RNA产量较高。而3 mol/L NaAc(pH5.2)处理提取的RNA产量明显少于前两个处理,尤其是在SD140中,效果更为明显。
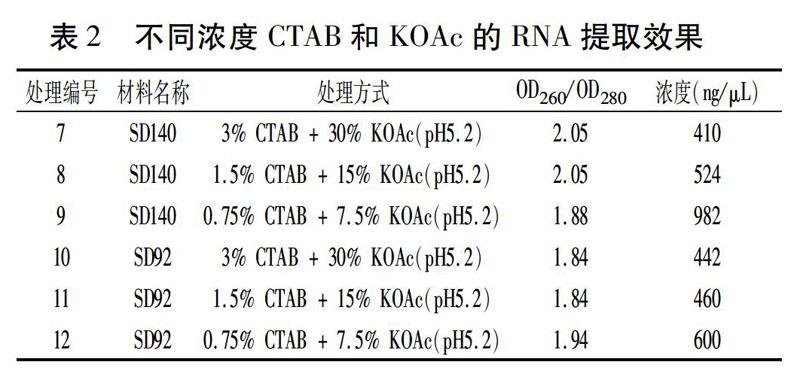
不同浓度CTAB和KOAc组合可以提取SD92 和SD140块茎中完整的RNA,包括28S、18S、5S rRNA。从表2可以看出,在0.75%~3% CTAB和7.5%~30% KOAc时,CTAB和KOAc浓度越低,提取的RNA总量越大。添加3% CTAB和30% KOAc时,SD140和SD92的RNA提取量分别为410 ng/μL和442 ng/μL,而在0.75% CTAB和7.5% KOAc时,它们的提取量分别为982 ng/μL和600 ng/μL,后者的提取量是前者的2.40倍和1.36倍。另外,在SD92和SD140提取RNA的3种处理中,提取的RNA OD260/OD280都大于1.80,说明蛋白质的残留量很低,RNA质量良好。
利用管家基因actin扩增检测Trizol提取RNA的消化和反转录效果。通过PCR,RNA、cDNA和DNA均能扩增出actin条带,消化后的RNA未扩增出条带,说明DNA消化完全,提取的RNA质量优,杂质残留量低,可用于后续的反转录等反应。
利用18S rRNA检测改良Trizol法提取RNA反转录后cDNA的RT-qPCR效果。两种材料中18S rRNA的扩增曲线是光滑的,两个样品的Ct值< 20,并且熔解曲线是单一峰,说明反转录的cDNA达到了荧光定量检测的要求,表明改良Trizol法提取的RNA可以用于后续的荧光定量检测。
3 讨论与结论
富含花青素的马铃薯块茎中含有多糖、酚类化合物,蛋白质和其他次级代谢产物,采用Trizol法和改良的Chan法不能从该类块茎中提取出完整的RNA。Trizol法简单方便、耗时较短,但不能有效除掉块茎中的多糖。而RNA与多糖可以形成共沉淀[11],导致RNA难以分离。Chan法提取RNA时,使用3 mol/L NaAc有效去除块茎中的多糖,但是步骤繁琐、耗时较长,导致RNA出现了降解;并且该法利用LiCl选择性沉淀RNA效果不佳,导致大量DNA残留。
改良Trizol法提取RNA纯度高、完整性好,可以用于后续的RT-PCR和RT-qPCR等分子生物学试验。该法操作简单方便,单样品提取时间约90 min。改良Trizol法较Trizol法在提取过程中添加了PVPP、β-巯基乙醇、CTAB和KOAc。PVPP可以与酚类物质结合[12],从而除去块茎中的酚类。β-巯基乙醇作为一种变性剂可以去除RNase和其他一些活性酶,有效阻止RNA的降解和酚类向醌类的转化[13, 14]。由于在低盐条件下,多糖会与核酸形成胶状沉淀[15, 16],所以提取RNA时需要高盐环境,而常用的NaCl对RNA提取的效果有限[17]。在本试验中,采用高浓度的KOAc和NaAc去除多糖,与KOAc相比,NaAc提取RNA的产量较低,说明Na+对RNA的提取效果差于K+,采用KOAc去除多糖效果更好。CTAB作为一种很强的离子变性剂,可以使核酸从植物组织中充分分离[18, 19]。KOAc和CTAB共同使用,可以使RNA与多糖等其它代谢产物在充分分离的条件下,获得高纯度的RNA。
总之,改良Trizol法可以高效地提取富含花青素马铃薯块茎的RNA,提取的RNA可以用于后续的基因表达分析等分子生物学试验。此法对于其它富含多糖、多酚和花青素等代谢产物作物RNA的提取提供了参考。
参 考 文 献:
[1] Brown C R, Culley D, Bonierbale M, et al. Anthocyanin, carotenoid content, and antioxidant values in native South American potato cultivars[J]. HortScience, 2007, 42(7): 1733-1736.
[2] Liu Y H, Wang K L, Deng C, et al. Comparative transcriptome analysis of white and purple potato to identify genes involved in anthocyanin biosynthesis[J]. PLoS ONE, 2015,10(6):e0129148.
[3] Bontempo P, Carafa V, Grassi R, et al. Antioxidant, antimicrobial and anti-proliferative activities of Solanum tuberosum L. var. Vitelotte[J]. Food and Chemical Toxicology, 2013, 55: 304-312.
[4] 刘柏林, 尤佳, 张宁, 等. 3种商品化Trizol试剂提取高质量马铃薯块茎总RNA的比较[J]. 甘肃农业大学学报, 2012, 2(1): 59-63.
[5] Wei Q, Wang Q L, Feng Z H, et al. Increased accumulation of anthocyanins in transgenic potato tubers by overexpressing the 3GT gene[J]. Plant Biotechnology Reports, 2012, 6:69-75.
[6] 王伟, 李立芹, 邹雪, 等. 马铃薯块茎总RNA提取方法比较[J]. 江苏农业科学, 2013, 41(1): 38-40.
[7] 白斌, 张金文. 马铃薯块茎RNA提取及RT-PCR法克隆酸性转化酶基因[J]. 分子植物育种, 2005, 3(3): 479-484.
[8] Stushnoff C, Ducreux L J M, Hancock R D, et al. Flavonoid profiling and transcriptome analysis reveals new gene-metabolite correlations in tubers of Solanum tuberosum L.[J]. Journal of Experimental Botany, 2010, 61(4): 1225-1238.
[9] 趙宝勰, 程李香, 林必博, 等. 两种马铃薯块茎总RNA提取方法的比较[J]. 广东农业科学, 2010(1):124-127.
[10]Lachman J,Hamouz K. Nutrition-a review[J]. Plant Soil and Environment, 2005, 51: 477-482.
[11]Gao J W, Liu J Z, Li B, et al. Isolation and purification of functional total RNA from blue-grained wheat endosperm tissues containing high levels of starches and flavonoids[J]. Plant Molecular Biology Reporter, 2001, 19(2): 185-186.
[12]Bridi R, Troncoso M J, Folch-Cano C, et al. A Polyvinylpolypyrrolidone (PVPP)-assisted folin-ciocalteu assay to assess total phenol content of commercial beverages[J]. Food Analytical Methods,2014,7(10): 2075-2083.
[13]Rashid A, Baldwin T, Gines M, et al. A high-throughput RNA extraction for sprouted single-seed barley (Hordeum vulgare L.) rich in polysaccharides[J]. Plants, 2017,6(1):1.
[14]Tong Z G, Qu S C, Zhang J Y, et al. A modified protocol for RNA extraction from different peach tissues suitable for gene isolation and real-time PCR analysis[J]. Molecular Biotechnology, 2012, 50: 229-236.
[15]Sabzevari A G, Hosseini R. A quick, efficient, and cost-effective method for isolating high-quality total RNA from tomato fruits, suitable for molecular biology studies[J]. Preparative Biochemistry & Biotechnology, 2014, 44: 418-431.
[16]Birtic S, Kranner I. Isolation of high-quality RNA from polyphenol, polysaccharide and lipid-rich seeds[J]. Phytochemical Analysis, 2006, 17(3):144-148.
[17]Deepa K, Sheeja T E, Santhi R, et, al. A simple and efficient protocol for isolation of high quality functional RNA from different tissues of turmeric (Curcuma longa L.)[J]. Physiological and Molecular Biology Plants, 2014, 20(2):263-271.
[18]Kim S H, Hamada T. Rapid and reliable method of extracting DNA and RNA from sweet potato, Ipomoea batatas (L). Lam[J]. Biotechnology Letters, 2005, 27(23): 1841-1845.
[19]Wang X C, Tian W M, Li Y X. Development of an efficient protocol of RNA isolation from recalcitrant tree tissues[J]. Molecular Biotechnology, 2008, 38(1): 57-64.
