2013—2016年国家医疗器械抽检复检改判情况分析
2018-03-03郝擎张欣涛李晓朱炯张庆生石现
【作 者】郝擎,张欣涛,李晓,朱炯,张庆生,石现
中国食品药品检定研究院,北京市,102629
复检改判是指抽检原检不合格的产品经复检后被改判为合格。它已成为近年来中国官方组织的医疗器械抽样检验工作中的一个突出现象。根据2013年10月发布实施的《医疗器械质量监督抽查检验管理规定》[1]第二十二条之规定:“被抽样单位或标示生产企业对检验结果有异议的,可以自收到检验报告之日起7个工作日内向具有相应资质的医疗器械检验机构提出复验申请”。这打破了之前数年所实行的由原检机构进行复检的实际规定。
新规随即在当年的国家医疗器械抽检中显现效应。统计显示,2013年国家医疗器械抽检的复检改判率为26%。之后的2014、2015、2016年,复检改判率分别达到了32%、36%、43%。
有鉴于此,本文对国家医疗器械抽检中复检改判情况进行了研究,了解原检和复检过程,分析改判原因,并根据原因归纳出复检改判的五种主要类型,总结现象背后所反映的深层问题,并提出相应的工作建议。
1 主要类型
1.1 标准缺陷
标准或技术要求的缺陷是造成复检改判的一项重要原因。由于强制性国家标准、强制性行业标准或企业的产品技术要求存在“先天缺陷”,导致检验出现偏差,这样的情况屡见不鲜。统计显示,42%的复检改判与这一因素有关。具体体现包括:
(1)标准中的试验方法本身存在局限性。如医用口罩产品的多个检验项目与受试人脸型的广泛性和代表性密切相关,不同检验机构选择的受试人差别足以影响检验结果[2-3]。
(2)部分项目存在多种试验方法且一致性不佳,如一次性使用无菌阴道扩张器的“抗变形能力”[4]。
(3)产品技术要求和说明书中未能提供完成检验所需的所有要素,如示意图缺失、测量部位不明确等。
(4)技术文件之间不一致,如产品技术要求和说明书二者对于“工作时间”的规定不同。
(5)部分产品出现了标准“未尽”的情形,如某家用制氧机企业将氧浓度提示装置的开关设在产品内部(要使用该功能需使用工具打开机壳,企业未在任何技术文件中载明该情况,且产品出厂时也不提前将开关置于正确状态),但相关标准对该情况均未有过约束[5]。
1.2 判定尺度
检验机构之间对标准(技术要求)的理解不一致,或虽然理解一致但对样品是否做到了其中的规定存在争议。例如:部分中医诊疗设备接通网电源后是否“另有显而易见的指示”决定了“指示器”这一项目合格与否[6],但对于哪些指示属于另有的显而易见的指示,标准中未予明确(也难以明确),检验机构之间对此存在不同理解。统计显示,24%的复检改判与这一因素有关。
1.3 实验操作
实验操作对检测结果的影响存在多种情形,11%的复检改判与这项因素有关,主要又体现为以下几种情形:
(1)检测点选择。部分体外诊断试剂的原检复检单位选择的稀释浓度点不同,造成在接近极端点的线性回归和相关系数的计算结果不同。
(2)零配件更换。如某超声理疗设备复检调样运输中出现部件(治疗头硅胶囊)破损(原检未出现该破损,经证实是运输原因造成,且破损导致复检无法进行),复检单位在获得批准且保留证据的前提下更换了该部件。
(3)修约差异。如某一次性使用输液器产品的“滴斗与滴管”项目实际性能接近限值,原复检单位的检测数据也相差无几,最终因修约原因导致判定结论截然相反。
(4)标准物质。某体外诊断试剂产品自带标准物质,但产品技术要求又声称使用其他标准物质,标准物质使用上的差异可能是原检复检结论不同的原因。严格来说,该企业的行为存在违规,相关处理在此不予赘述。
1.4 样品原因
一些产品的原复检单位对标准的理解一致,所采用的试验方法一致,试验装备均经过计量,导致检验结果出现差别的大概率原因是样品的均匀性。根据统计,8%的复检改判与这一因素有关。
1.5 其他原因
除了以上较为系统的原因外,还有一些原因以孤例的形式出现,它们合计占到了近年复检改判总量的15%。虽是孤例,但它们也能够揭示医疗器械抽样检验全过程中可能存在的一些系统性风险,并且不排除今后再次出现的可能。它们包括:① 抽样环节未注意和抽取到某些样品(如软性接触镜)的特殊保存溶液;② 部分有源产品的检测装备经过校准后仍可能存在细微的差异,导致检测结果不同;③ 部分复检机构单方面采信了企业提出的说明作为判定依据;④有待进一步调查,个别改判有待更深层次的调查。
上述原因中,个别情况已经涉嫌违规甚至违法,相关处理亦不赘述。
除此之外,复检单位与原检单位之间缺乏沟通,导致一些可以先行交流的技术问题难以暴露,检验人员坚持个人理解,也是此次调查研究中发现的较为普遍的现象。
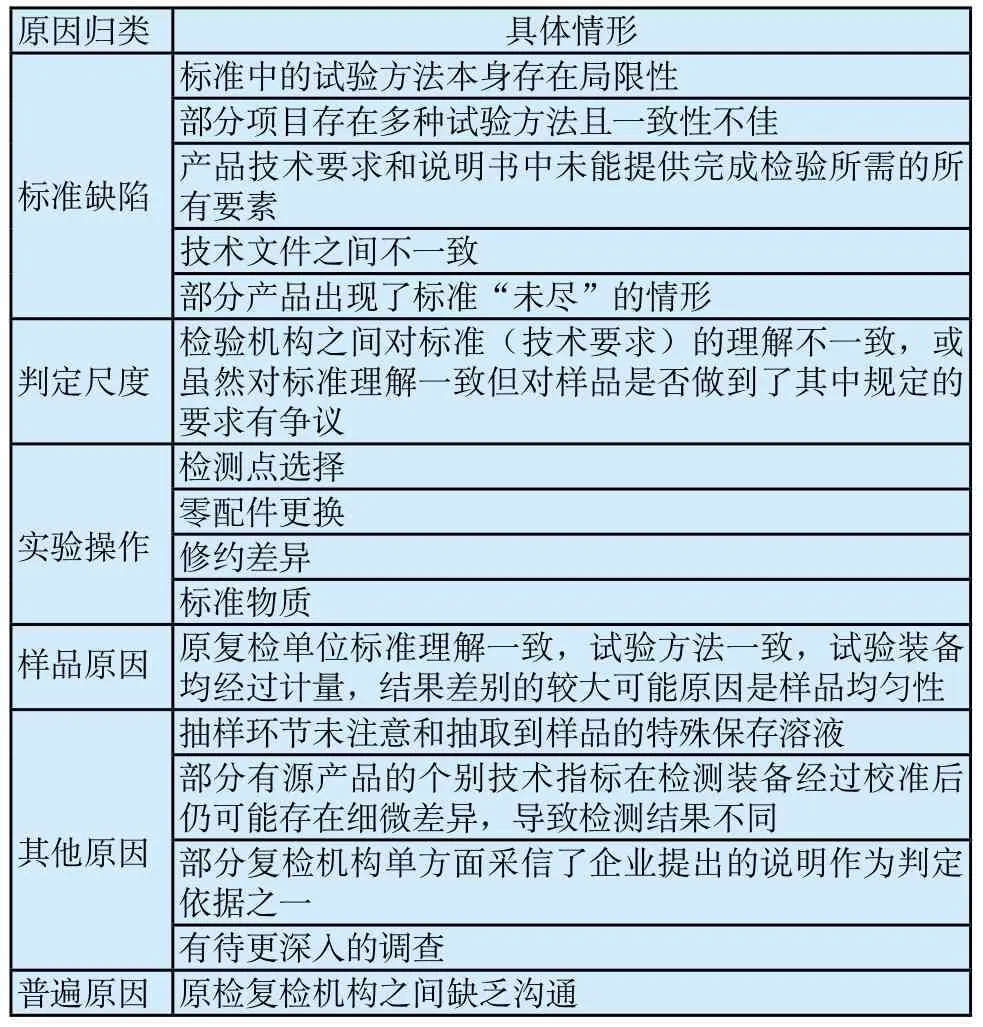
表1 复检改判情况Tab.1 Types and reasons of changing the original test results after retesting
2 解决建议
(1)重视抽检的实践价值。对于抽检发现的试验方法局限性、一致性问题和未尽情形,相关标准化技术委员会应该有组织的认真研究,并在标准制修订工作中完善。
(2)加强对判定原则的统一,并通过合适的渠道宣贯落实。对于标准执行中的不同理解,应当及时反馈和总结,并依照《医疗器械标准管理办法》[7]释标。
(3)严肃检验纪律。除了检验机构要加强自身廉洁自律,抵制外在压力和利益诱惑外,也要加强对问题检验的震慑,加强相应的监督和问责。
(4)高度重视沟通交流。在标准、技术要求等基础性问题不能在一时一日解决的情况下,要通过原检、复检机构及相应产品标技委之间的沟通,分析研判复检样品所涉及的各项事宜,本着科学、严谨的原则,将问题解决在爆发前。
3 结语
随着医疗器械审评审批制度的改革,国家对医疗器械质量愈发重视,上市后医疗器械监管力度进一步加强。医疗器械抽检工作能够直接体现医疗器械前端监管环节的成效,有效衔接整个监管体系。希望有关各方能够重视这一具有中国特色但又切合实际且行之有效的手段,保证它的科学性、公正性、权威性,并进一步反哺和促进前端监管环节的进步。
[1] 国家食品药品监督管理总局. 食品药品监管总局关于印发医疗器械质量监督抽查检验管理规定的通知[EB/OL]. 2013-10-11.http://www.sda.gov.cn/WS01/CL0845/93336.html.
[2] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会. GB 19083—2010 医用防护口罩技术要求[S].
[3] 国家食品药品监督管理局. YY 0469—2011 医用外科口罩[S].
[4] 国家食品药品监督管理总局. YY 0336—2013 一次性使用无菌阴道扩张器[S].
[5] 国家食品药品监督管理局. YY 0732—2009 医用氧气浓缩器 安全要求[S].
[6] 国家食品药品监督管理局. YY 0780—2010 电针治疗仪[S].
[7] 国家食品药品监督管理总局. 国家食品药品监督管理总局令第33号 医疗器械标准管理办法[R/OL]. 2017-4-17. http://www.sda.gov.cn/WS01/CL0053/172049.html.
