不同品种辣木叶多糖的理化性质和抗氧化活性研究
2018-03-01董竹平李超扶雄
董竹平,李超,扶雄
(华南理工大学食品科学与工程学院,广东广州 510640)
辣木(Moringa oleifera),属辣木科辣木属,是一种分布广泛,营养价值高,具有诸多生理活性的多年生植物。辣木原广泛分布于印度北部、巴基斯坦、孟加拉国及阿富汗等,随着越来越多的人认识到辣木重要的营养和药用价值,很多地区开始重视辣木的引种培育和开发利用,包括我国的云南、台湾、广东及广西等地区均有种植[1]。辣木在全世界主要有14个品种,目前在国内引种较多的主要有4个品种:印度传统辣木、印度改良种辣木(PKM1)、PKM1改良种辣木(PKM2)和非洲辣木。辣木含有丰富的蛋白质、维生素、氨基酸、脂肪和碳水化合物等,其蛋白质含量高于鸡蛋,钙含量高于牛奶,在印度常被用作孕妇食品,被西方科学家称为上帝赐给人类的礼物。辣木是传统的药物来源,其根、茎、叶、果和树皮等常被用来治疗各种疾病,比如辣木叶的水提物在印度的很多地区用于治疗糖尿病[2]。现代研究表明辣木中含有多种活性成分,具有降血糖、抗炎、免疫调节和抗氧化等生理活性,是开发功能性食品的优质原料[2,3]。
多糖是由10个以上的单糖组成的高分子化合物,包括植物多糖、动物多糖和真菌多糖等,具有抗炎、抗氧化、抗癌、降血糖及免疫调节等诸多的有益生理活性[4]。植物多糖因其重要的生理活性以及极低的毒副作用,受到国内外研究工作者的青睐。辣木叶中含有丰富的多糖,含量范围为8.61~33.61%[5]。目前国内对辣木叶多糖的研究主要停留在提取和含量测定方面,对其活性和结构的报道比较少。本文选取了国内引种比较多的三种辣木叶品种:PKM1叶、PKM2叶和非洲辣木叶,采用热水提取方法提取三个品种的辣木叶多糖,比较研究三种辣木叶多糖的理化性质、化学结构及抗氧化活性,为辣木叶的开发和深入利用提供理论依据。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
PKM1、PKM2辣木叶购自中国云南省西谷科技有限公司;非洲辣木叶购自中国云南省昆明樵山记食品有限责任公司,风干后粉碎备用;牛血清蛋白、抗坏血酸(Vc)、凝胶多糖(Curdlan)、海带多糖(Laminarin)、DPPH(1,1-diphenyl-2-picryhydrazyl)、ABTS(2,2-azino-bis-(3-ethylbenzothiazoline-6-sulfonic acid)购自美国Sigma-Aldrich公司;其它化学试剂均为国产分析纯。
1.1.2 仪器与设备
SpectraMax® i3x连续波长多功能酶标仪,美谷分子仪器上海有限公司;A1260高效液相色谱仪(配有Agilent 1260示差检测器)美国Agilent公司;TU-1901双光束紫外可见分光光度计,北京普析通用仪器有限责任公司;Dionex ICS 3000离子色谱仪,美国Dionex公司;Vector 33红外光谱仪,德国Bruker公司;Nanoscope 3A原子力显微镜,美国Veeco公司。
1.2 实验方法
1.2.1 辣木叶预处理
将辣木叶原料用自来水清洗3遍,用去离子水清洗1遍后置于50 ℃电热恒温鼓风干燥箱中烘至恒重。将干燥的辣木叶用中草药粉碎机粉碎,过60目筛子后,收集备用。称取1000 g辣木叶粉末,与4 L乙醇溶液(90%)混合,置于70 ℃水浴锅中加热回流4 h,抽滤,收集滤渣,重复操作一次,收集滤渣,置于50 ℃电热恒温鼓风干燥箱中烘至恒重,制得预处理的辣木叶粉,放在干燥器中备用。
1.2.2 辣木叶多糖的制备
称取100 g预处理后的辣木叶粉末,加入2 L的去离子水,于90 ℃水浴锅中加热回流2 h,5000 r/min转速离心15 min,上清液进一步抽滤,收集滤液。滤渣重新提取一次,合并滤液。滤液于45 ℃下减压浓缩至体积的1/4~1/6。采用Sevage试剂(氯仿:正丁醇=4:1)进行脱蛋白,重复操作12次后,于45 ℃下减压旋蒸发除去残留的Sevage试剂。然后加入200 g的AB-8大孔树脂,35 ℃条件下摇晃脱色2 h,抽滤分离滤液,大孔树脂用去离子水洗3次,合并滤液,减压浓缩至500 mL。在浓缩液中加入无水乙醇,边加边搅拌至乙醇浓度为80%,4 ℃冰箱中静置12 h以上,重复操作1次,离心收集沉淀,用去离子水复溶,-50 ℃冷冻干燥得辣木叶粗多糖。称取1 g粗多糖,配成10 mg/mL的多糖溶液,装入截留分子量为3000 u的透析袋中透析24 h,收集透析袋内的多糖溶液,冷冻干燥制得辣木叶多糖样品。多糖提取率计算公式如下:
得率(%)=多糖样品的质量/辣木叶粉质量×总糖含量×100
1.2.3 总糖含量和蛋白质含量测定
采用苯酚-硫酸法测定多糖样品中的总糖含量;采用考马斯亮蓝法测定多糖样品中的蛋白含量。
1.2.4 单糖组成及糖醛酸含量测定
采用离子色谱法测定样品单糖组成及糖醛酸含量,测试方法参考Ren等[6]报道的方法。称取5 mg样品溶解在4 mL的三氟乙酸(2 M)中,转移到10 mL安培瓶中,酒精喷灯封口,110 ℃鼓风恒温干燥箱中水解6 h。冷却到室温,于45 ℃下减压旋蒸除去多余的三氟乙酸,用50%的甲醇清洗5次,45 ℃条件下减压旋蒸除去甲醇,用适量超纯水溶解,定容到50 mL容量瓶中,过0.22 μm水膜,-4 ℃低温下保存在液相瓶中,然后通过离子色谱仪进行分析。岩藻糖(Fuc)、阿拉伯糖(Ara)、鼠李糖(Rha)、半乳糖(Gal)、葡萄糖(Glu)、木糖(Xyl)、甘露糖(Man)、半乳糖醛酸(GalA)和葡萄糖醛酸(GluA)作为标品,绘制标准曲线。
1.2.5 分子量的测定
采用高效液相色谱仪测定样品的分子量分布。称取2 mg多糖样品溶解在2 mL的磷酸二氢钾缓冲液(0.02 M)中,过0.22 μm的水膜,进行分析。标准曲线采用普鲁兰标准品(分子量分别为642000、337000、194000、21100、9600、6100 u)。液相工作条件:色谱柱为TSK-gel G5000 PWXL和TSK-gel G3000PWXL串联使用;检测器:Agilent 1260示差检测器;流动相:0.02 M磷酸二氢钾缓冲液(pH 6.0);柱温:35±0.1 ℃;检测器温度:45±0.1 ℃;流速:0.6 mL/min;进样量:20 μL。
1.2.6 红外光谱的测定
称取3 mg的多糖样品经过KBr压片,采用傅里叶红外光谱仪在400~4000 cm-1波数范围内进行光谱扫描。
1.2.7 三螺旋结构的测定
采用刚果红试剂法测定样品的三螺旋构象。配制1 mg/mL多糖样品与等体积的100 μM刚果红试剂混匀,依次滴加1 M NaOH溶液调整NaOH浓度为0~0.5 M,紫外全波长扫描每一个NaOH浓度下的混合溶液,得到最大吸收波长,以Curdlan和Laminarin为对照,同时以相同体积的蒸馏水为空白对照。
1.2.8 原子力显微镜测量
采用原子力显微镜(AFM)观测样品的形貌特征。称取5 mg样品配成1 mg/mL的样品溶液,在60 ℃的水浴锅中搅拌2 h,冷却至室温后稀释400倍,在25 ℃下搅拌6 h。取5 μL溶液滴在平整的云母片上,风干后放在AFM的金属圆盘上测量。
1.2.9 抗氧化活性实验
1.2.9.1 DPPH自由基清除能力
参照Ren等[6]人的方法并稍加改进。DPPH溶液配制:19.7 mg的DPPH溶于50%甲醇,定容到250 mL容量瓶中。样品溶液用去离子水配置不同梯度浓度。取1 mL不同浓度的样品溶液与1 mL的DPPH溶液或50%的甲醇溶液混合,涡旋混匀,避光反应30 min,于517 nm波长测定吸光度。DPPH自由基清除率计算公式如下:
DPPH自由基清除率(%)=[1-(A0-A1)/(A2-A3)]×100
其中,A0表示1 mL样品溶液与1 mL DPPH溶液混合反应后的吸光度;A1表示1 mL样品溶液与1 mL 50%甲醇溶液混合后的吸光度;A2表示1 mL去离子水与1 mL DPPH溶液混合后的吸光度;A3表示1 mL去离子水与1 mL、50%甲醇溶液混合后的吸光度。
1.2.9.2 ABTS自由基清除能力
参照Zhang等[7]人的实验方法并稍加改进。ABTS溶液配置:7 mM ABTS溶液和2.45 mM K2S2O8按1:1的比例配置,避光反应12 h生成。ABTS+工作液配置:ABTS溶液加水稀释到在732 nm波长下吸光度为0.70±0.02。样品溶液用去离子水配置不同梯度浓度。取0.2 mL不同浓度的样品溶液与1.5 mL的ABTS+工作液,涡旋混匀,避光反应30 min,于732 nm波长下测定吸光度。Vc用作阳性对照。ABTS自由基清除率计算公式如下:
ABTS自由基清除率(%)=[1-(A0-A1)/A2]×100
其中,A0表示0.2 mL样品溶液与1.5 mL ABTS+工作液混合反应后的吸光度;A1表示0.2 mL样品溶液与1.5 mL去离子水混合的吸光度;A2表示0.2 mL去离子水与1.5 mL ABTS+工作液混合的吸光度。
1.2.9.3 羟基自由基清除能力
参照Ren等[6]的方法并稍加改进。取1 mL不同浓度的样品溶液和1 mL Fe2SO4(1.5 mM)、0.7 mL双氧水(6.7 mM)、0.3 mL水杨酸钠(20 mM)混匀,置于37 ℃条件下避光孵育1 h,然后于562 nm波长测定吸光度,记为A0;1 mL去离子水替代样品溶液反应的吸光度,记为A1。Vc作为阳性对照。羟基自由基清除率计算公式如下:
羟基自由基清除率(%)=[1- A0/A1]×100
1.2.10 数据分析
所有数据均采用平均值(Mean)±标准差(SD)表示。采用SPSS 13.0软件进行一维方差分析(one-way ANOVA),采用Origin 8.6对数据进行画图。
2 结果与讨论
2.1 单糖组成
三种辣木叶多糖的得率和化学组成情况如表1所示。可以看到,PKM1辣木叶的多糖得率高于PKM2辣木叶和非洲辣木叶,得率最大为6.84%,其中非洲辣木叶的多糖得率最低,这与岳秀洁等[8]人的研究结果相似。PKM1辣木叶多糖的总糖含量最高,达到63.19%,而PKM2辣木叶多糖含有较多的蛋白质。此外,三种辣木叶多糖含有不同含量的糖醛酸。这些结果表明三种辣木叶含有不同含量和组成的活性多糖成分。
三种辣木叶多糖具有相似的单糖组成,均由四种单糖(半乳糖、阿拉伯糖、岩藻糖和木糖)组成,其中半乳糖和阿拉伯糖的摩尔百分含量达到了90%以上,说明辣木叶多糖主要是由半乳糖和阿拉伯糖组成,这和Chen等[9]人的研究结果不同,这可能是由于提取方式、检测方法和原料的差异造成的。
2.2 分子量大小
通过HPGPC对三种辣木叶多糖的分子量分布进行测量,结果如图1所示。用普鲁兰标准品建立标准曲线:LogMw=-0.001V3+0.0861V2-2.5962V+31.632(R2=0.9999)。PKM1辣木叶主要含有五种分子量不同的多糖组分,根据标准曲线方程计算,得分子量分别是13699.94 ku(21.84%)、145.469 ku(55.06%)、36.20 ku(5.48%)、20.03 ku(5.76%)、3.82 ku(11.86%);同样地,PKM2辣木叶也有五种不同分子量的多糖组分,分别是8310.88 ku(49.91%)、142.73 ku(12.49%)、36.83 ku(7.71%)、19.11 ku(1.91%)和3.90 ku(11.31%);而非洲辣木主要有四种分子量不同的多糖组分,分别是13762.18 ku(33.21%)、126.54 ku(29.88%)、34.6301 ku(24.85%)和3.83 ku(12.07%)。从结果可以看到,三种辣木叶多糖的分子量分布区间相似,主要在10000 ku、140 ku、34 ku和3.8 ku左右有分布,但是不同品种的辣木叶多糖在各个分子量区间的分布比例有很大的不同,其中PKM2辣木叶多糖在高分子量区域占比更大,达到了49.91%,相比于非洲辣木叶多糖33.21%,PKM1辣木叶多糖的21.84%。

表1 三种辣木叶多糖的提取率和化学组成(%)Table 1 The yields and chemical compositions of polysaccharides from three Moringa oleifera leaves

图1 三种辣木叶多糖的分子量分布Fig.1 The molecular weight distributions of the polysaccharides from three Moringa oleifera leaves
多糖等生物大分子的活性往往由它的结构决定,故分子量的大小、单糖组成、官能团的不同等都能影响多糖的生理活性。You等[10]研究发现,平均分子量为306.2 ku的香菇多糖,体外抗氧化活性优于平均分子量为605.4 ku和25.5 ku的香菇多糖。Hu等[11]用不同浓度的乙醇醇沉得到三组不同分子量的太子参多糖,发现中等分子量的太子参多糖具有更强的降血糖作用。本文研究得到了三种分子量分布不同的辣木叶多糖,为研究其活性的差异提供依据。
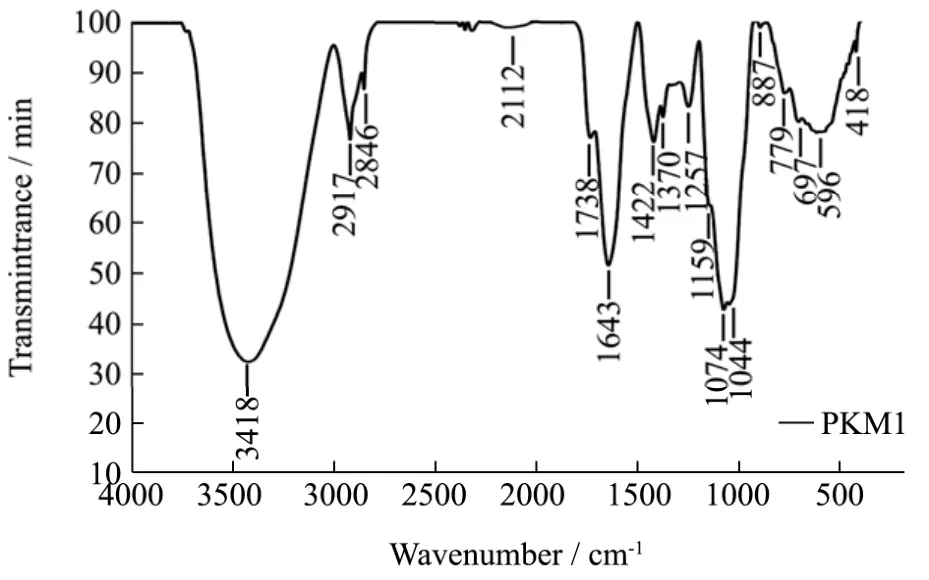
2.3 三种辣木叶多糖的红外图谱
从图2可以看到,三种样品均在3410 cm-1、2917 cm-1和1072 cm-1附近有特征峰,分别是O-H伸缩振动峰、C-H振动吸收峰、羧基的C-O伸缩振动峰,是多糖的典型峰,表明三种样品都是多糖样品;分别在1738 cm-1、1751 cm-1、1740 cm-1有吸收峰,表明三种辣木叶多糖都含有糖醛酸,是一种酸性多糖,这和离子色谱测出来的结果一致[12]。分别在887 cm-1、901 cm-1和890 cm-1有吸收峰,表明三种多糖是β构型多糖。在1100~1010 cm-1都有两个吸收峰,说明三种辣木叶多糖都是呋喃多糖,分别在1370 cm-1、1376 cm-1和1367 cm-1有特征峰,说明都有磷酸基的存在[13]。这些特征吸收峰表明这三种辣木叶多糖样品具有典型的多糖特征吸收,且具有相似的官能团。
2.4 螺旋性结构
有研究表明,多糖的三螺旋结构与其活性密切相关。Maeda等[14]发现具有三螺旋结构的β-(1,3)葡聚糖比不具有三螺旋结构的β-(1,3)葡聚糖具有更强的抗肿瘤和免疫调节作用。故研究辣木多糖的三螺旋结构有助于研究其生理活性。刚果红是一种酸性染料,溶于水和酒精,可与具有三螺旋构象的多糖发生结合,从而使最大吸收波长变大,所以可以通过测量不同NaOH浓度下的多糖与刚果红溶液的最大吸收波长来推测糖链结构。

图3 三种辣木叶多糖在不同NaOH浓度的溶液中螺旋-卷曲转变分析Fig.3 Helix-coil transition analysis of the polysaccharides from three Moringa oleifera leaves in different NaOH concentrations
从图3可以看到,在弱碱性条件下,三种辣木叶多糖组同control组相比,最大吸收波长发生红移,其中PKM2和非洲辣木叶多糖均在NaOH浓度为0.05 M下最大吸收波长最大,PKM1辣木叶多糖在NaOH浓度为0.1 M时最大吸收波长最大,说明三种多糖在弱碱性条件下具有规则的三螺旋结构,能与刚果红试剂形成络合物。随着NaOH浓度的上升,三种辣木叶多糖的最大吸收波长都下降,说明在强碱性环境下,多糖的三螺旋结构开始解体。
2.5 原子力图谱
多糖因为相对分子量较大,结构复杂,自身常存在结构缺陷,从而难以得到良好的晶形,原子力显微镜使得对多糖这样的生物大分子表面形貌的观察成为可能。

图4 三种辣木叶多糖的原子力显微镜图谱Fig.4 AFM images of polysaccharides from three Moringa oleifera leaves
由图4可以看到,三种辣木叶多糖的AFM图像有区别,PKM2和非洲辣木叶多糖的AFM图像呈现球形的构象,而PKM1辣木叶多糖AFM图像呈现状的构象,下端有多分枝结构。
2.6 三种辣木叶多糖的抗氧化活性
2.6.1 羟基自由基清除能力
羟基自由基是一种活性氧自由基,可在细胞内与蛋白质,脂类、DNA等各种生物大分子发生反应,过量的自由基会诱导机体发生氧化损伤。因此,从天然资源中筛选出一些具有抗羟自由基作用的非酶膳食抗氧化剂,对于增强抗氧化防御系统在活细胞中的功能极为重要[15]。

图5 三种辣木叶多糖的羟基自由基清除能力Fig.5 Hydroxyl radical scavenging ability of the polysaccharides from three Moringa oleifera leaves
从图5中可以看出,三种辣木叶多糖对羟基自由基有一定的清除作用,且在0~5 mg/mL的浓度范围内具有显著的清除自由基能力,且呈现剂量依赖性。非洲辣木叶多糖和PKM1辣木叶多糖的清除自由基能力相当,强于改良的PKM1辣木叶多糖,当浓度为5 mg/mL时,非洲辣木叶多糖和PKM1辣木叶多糖对ABTS自由基的清除率分别达到了87.9%和84.5%。这些结果表明三种辣木叶多糖均具有抗氧化活性,其中非洲辣木叶多糖和PKM1辣木叶多糖的抗氧化活性最强,而这和前人的研究结果相似[8]。
2.6.2 DPPH自由基清除活性
DPPH是一种相对比较稳定的自由基,其醇溶液呈紫色,在517 nm波长处具有特征吸收,而抗氧化剂能提供电子或氢质子供给DPPH自由基,生成稳定的化合物,从而使其溶液从紫色向无色转变,其褪色程度与抗氧化剂的给电子能力呈正相关关系,因而用分光光度计进行快速的定量评价样品抗氧化能力[16]。
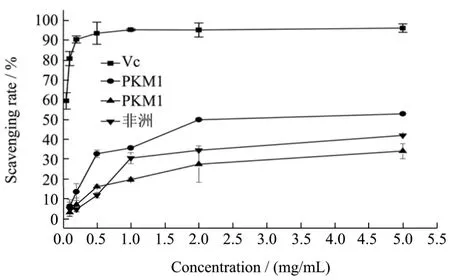
图6 三种辣木叶多糖的DPPH自由基清除活性Fig.6 1,1-diphenyl-2-picrylhydrazyl (DPPH) radical scavenging ability of the polysaccharides from Moringa oleifera leaves
从图6中可以看出,三种辣木叶多糖对DPPH自由基均有一定的清除作用,且在0~2 mg/mL的浓度范围内对自由基清除能力呈现剂量依赖性上升,当浓度为2 mg/mL时,PKM1辣木叶多糖、非洲辣木叶多糖和PKM2辣木叶多糖的DPPH自由基清除率分别为49.8%、34.4%和27.4%,继续增加样品浓度,其自由基清除率无显著性变化。尽管三种辣木叶多糖对DPPH自由基的清除能力均低于Vc,但由于其良好的抗氧化活性和较低的副作用,可开发一种天然的抗氧化剂。
2.6.3 ABTS自由基清除能力

图7 三种辣木叶多糖的ABTS自由基清除能力Fig.7 2,2'-amino-di(2-ethyl-benzothiazoline sulphonic acid-6)ammonium salt (ABTS) radical scavenging ability of polysaccharides from three Moringa oleifera leaves
从图7可以看出,三种辣木叶多糖对ABTS自由基有一定的清除作用,且在0~5 mg/mL的浓度范围内呈现剂量依赖性上升。其中非洲辣木叶多糖>PKM1辣木叶多糖>PKM2辣木叶多糖。当样品浓度5 mg/mL时,非洲辣木叶多糖和PKM1辣木叶多糖对ABTS自由基的清除率分别达到了90.5%和87.5%,表明辣木叶多糖具有较显著的ABTS清除能力。研究表明相比高分子量的多糖,中等或低分子量多糖具有较好的抗氧化活性[17];此外,研究表明多糖的抗氧化活性与其蛋白质、硫酸基和糖醛酸含量相关[6]。以上结果表明非洲辣木叶多糖和PKM1辣木叶多糖的抗氧化能力强于PKM2辣木叶多糖,其差异性主要由于其化学组成和结果不同。
3 结论
3.1 PKM1辣木叶、PKM2辣木叶和非洲辣木叶的多糖得率分别为6.84%、4.67%和3.78%。化学组成分析表明三种辣木叶多糖含有不同含量的总糖、蛋白质、葡萄糖醛酸和半乳糖醛酸,其中PKM1辣木叶多糖的总糖含量最高,其次是非洲辣木叶多糖和PKM2辣木叶多糖。
3.2 三种辣木叶多糖的分子量分布不同,均由半乳糖、阿拉伯糖、岩藻糖和木糖组成,主要由阿拉伯糖和半乳糖组成,其摩尔百分比能达到90%以上,是一种β构型的呋喃酸性多糖,具有相似的官能团,在弱碱性条件下都具有三螺旋结构。
3.3 三种辣木叶多糖均具有DPPH、ABTS和OH-自由基清除活性,且非洲辣木叶多糖和PKM1辣木叶多糖的清除自由基能力显著大于PKM2辣木叶多糖,其活性差异主要由于化学组成和结构不同造成的。
[1] 刘凤霞,王苗苗,赵有为,等.辣木中功能性成分提取及产品开发的研究进展[J].食品科学,2015,36(19):282-286
LIU Feng-xia, WANG Miao-miao, ZHAO You-wei, et al.Extraction of functional components from Moringa oleifera and development of Moringa oleifera-based products [J].Food Science, 2015, 36(19): 282-286
[2] Fahey Jed W. Moringa oleifera: A Review of the medical evidence for its nutritional, therapeutic, and prophylactic Properties. Part 1. [J]. Trees for Life Journal, 2005, 1(5): 1-24
[3] Verma A R, Vijayakumar M, Mathela C S, et al. In vitro and in vivo antioxidant properties of different fractions of Moringa oleifera leaves [J]. Food and Chemical Toxicology,2009, 47(9): 2196-2201
[4] Yu X, Liu Y, Wu X, et al. Isolation, purification,characterization and immunostimulatory activity of polysaccharides derived from American ginseng [J].Carbohydrate Polymers, 2017, 156: 9-18
[5] 刘昌芬,伍英,龙继明.不同品种和产地辣木叶片营养成分含量[J].热带农业科技,2003,26(4):1-2
LIU Chang-fen, WU Ying, LONG Ji-ming. Nutrients of drumstick tree leaf of different varieties and producing area[J]. Tropical Agricultural Science & Technology, 2003, 26(4):1-2
[6] Ren B, Chen C, Li C, et al. Optimization of microwave-assisted extraction of Sargassum thunbergii polysaccharides and its antioxidant and hypoglycemic activities [J]. Carbohydrate Polymers, 2017, 173: 192-201
[7] Zhang W, Li C, You L, et al. Structural identification of compounds from Toona sinensis leaves with antioxidant and anticancer activities [J]. Journal of Functional Foods, 2014,10: 427-435
[8] 岳秀洁.辣木叶有效成分的提取、分离纯化及其活性研究[D].广州:华南理工大学,2016
YUE Xiu-jie. Isolation and identification of effective constituents from Moringa oleifera Lam. Leaves and their biological activities [D]. Guangzhou: South China University of Technology, 2016
[9] Chen C, Zhang B, Fu X, et al. Microwave-assisted extraction of polysaccharides from Moringa oleifera Lam. leaves:Characterization and hypoglycemic activity [J]. Industrial Crops and Products, 2017, 100: 1-11
[10] You R, Wang K, Liu J, et al. A comparison study between different molecular weight polysaccharides derived from Lentinus edodes and their antioxidant activities in vivo [J].Pharmaceutical Biology, 2011, 49(12): 1298-1305
[11] Hu J, Pang W, Chen J, et al. Hypoglycemic effect of polysaccharides with different molecular weight of Pseudostellaria heterophylla [J]. BMC Complementary and Alternative Medicine, 2013, 13: 267
[12] Lai F, Wen Q, Li L, et al. Antioxidant activities of water-soluble polysaccharide extracted from mung bean(Vigna radiata L.) hull with ultrasonic assisted treatment [J].Carbohydrate Polymers, 2010, 81(2): 323-329
[13] 阳佛送,李雪华.多糖结构研究的方法和进展[J].食品科技,2008,33(3):200-203
YANG Fu-song, LI Xue-hua. Advances and methods in study on structure analysis of polysaccharides [J]. Food Science and Technology, 2008, 33(3): 200-203
[14] Maeda Y Y, Watanabe S T, Chihara C, et al. Denaturation and renaturation of a beta-1,6; 1,3-glucan, lentinan, associated with expression of T-cell-mediated responses [J]. Cancer Research, 1988, 48(3): 671-675
[15] Jiang C, Wang M, Liu J, et al. Extraction, preliminary characterization, antioxidant and anticancer activities in vitro of polysaccharides from Cyclina sinensis [J]. Carbohydrate Polymers, 2011, 84(3): 851-857
[16] Lai F, Wen Q, Li L, et al. Antioxidant activities of water-soluble polysaccharide extracted from mung bean(Vigna radiata L.) hull with ultrasonic assisted treatment [J].Carbohydrate Polymers, 2010, 81(2): 323-329
[17] Sun L, Wang C, Shi Q, et al. Preparation of different molecular weight polysaccharides from Porphyridium cruentum and their antioxidant activities [J]. International Journal of Biological Macromolecules, 2009, 45(1): 42-47
