猪塞尼卡谷病毒病现状与未来防控思考
2018-03-01樊晓旭迟田英吴晓东王志亮
樊晓旭,迟田英,吴晓东,王志亮
(中国动物卫生与流行病学中心外来病研究中心,山东青岛 266032)
2002年,美国基因治疗公司偶然从PER.C6细胞(转化的胎儿成视网膜细胞)培养基中首次发现并分离到一种新的病毒——塞尼卡谷病毒(Seneca Valley virus,SVV,另称Seneca virus A,SVA)[1]。2015年,国际病毒分类委员会(ICTV)将该病毒划分至新的病毒属——塞尼卡病毒属。目前,SVV是该属唯一成员。SVV结构呈二十面体,直径30 nm,无囊膜。基因组为线性、不分节段、单股正链RNA,全长约7.2~7.3 kb,5´和3´有非编码区,具有多聚腺苷酸尾。病毒基因含1个开放阅读框(ORF),编码含2 181个氨基酸的多聚蛋白前体,之后被裂解为1个前导蛋白和3个主要多聚蛋白(P1、P2和P3)。P1基因区域主要编码4个结构蛋白(VP4、VP2、VP3和VP1),形成病毒的核衣壳,而P2和P3基因区域编码7个非结构蛋白(2A、2B、2C、3A、3B、3C和3D)。SVV与同科的心肌炎病毒属成员同源性最接近[2]。2014年以前,该病毒受关注度较低,仅有SVV-001等3个毒株全基因组序列被测定公布。同时研究发现SVV-001有溶瘤特性,可专嗜性感染神经内分泌肿瘤细胞,而不感染正常人类细胞,并由此研发出了人用抗肿瘤药物NTX-010。目前该药物尚处于临床试验研究阶段[3]。
1 猪塞尼卡谷病毒病的发现与流行现状
早在20世纪80年代,澳大利亚、新西兰及美国就曾报道猪的一种水疱性疾病。其特征是患病猪鼻、口腔和蹄冠周围出现小泡和溃疡,但口蹄疫病毒(FMDV)、猪水泡病病毒(SVDV)等检测结果为阴性,未能对病原做出确诊。当时人们推测该病与猪饲料原料(感染真菌核盘菌的防风草、芹菜叶或海产品)和光照有关[4]。2004年,美国印第安纳州猪群暴发水疱性疾病,但未能确诊病因。根据临床症状将其命名为猪原发性水疱病(PIVD)。英国(2007年)和意大利(2010年)也曾暴发过类似的水疱性疾病,但也未能确诊病原。
2007年,美国从加拿大进口的187头猪出现水疱病症状,发病率高达80%。在排除了FMDV和SVDV等病毒后,最终确诊为SVV感染;2012年,美国又在出现水疱症状的6月龄猪体内检测到SVV,进而推测SVV感染与水疱性疾病有关。2015年,美国中西部多个地区暴发猪水疱性疾病,新生仔猪死亡率达30%~70%。由于病原不明,该水疱病的出现一度给美国养猪业造成了很大恐慌[5]。对于该病,美国在鉴别诊断、主动监测和病毒致病机制研究等方面投入很高,影响了整个行业的正常发展;通过RT-PCR方法对患水疱病猪进行检测,证实该病与SVV感染有关。
2014年伊始,全球多个国家确诊了猪SVV疫情。除美国外,2014年底至2015年初,巴西的6个州成年猪及断奶仔猪出现水疱性症状,1~4日龄新生仔猪死亡率上升。经实验室检测,在粪便、血清和多个器官组织中检测出SVV阳性[6]。2015年3月和7月,我国广东省发现了SVV感染导致的猪水泡性疾病。2016年,加拿大、哥伦比亚和泰国发现了猪SVV感染[7-8]。2016—2017年,我国又从湖北、福建、河南和黑龙江等省的患病猪群中陆续分离到SVV[9-12](图1)。
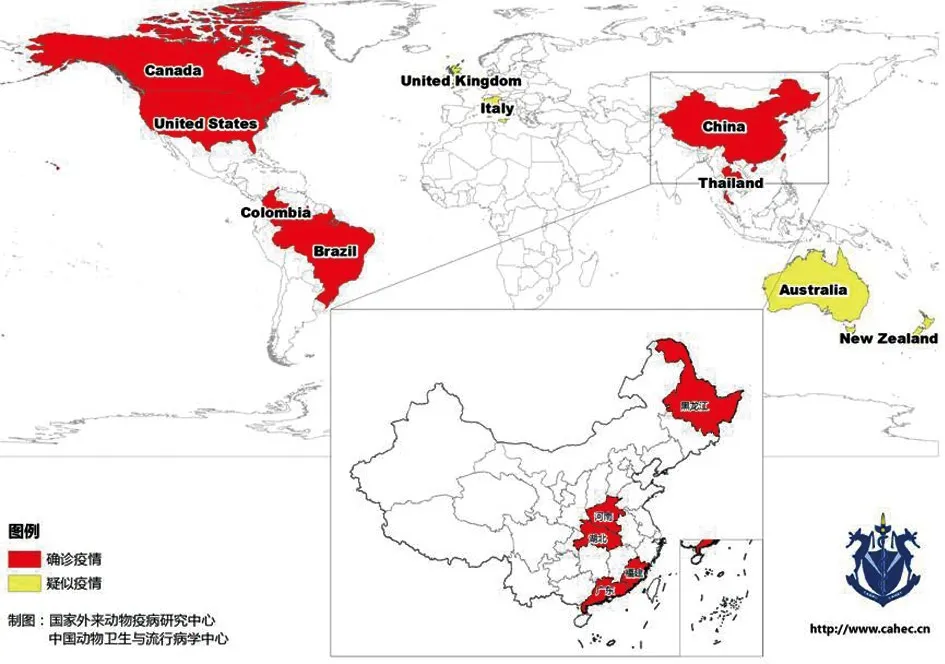
图1 SVV确诊和疑似疫情分布(截至2017年12月)
2 临床表现
猪感染后通常表现为急性、自限性水疱症状。临床表现为采食量下降,之后鼻吻出现水疱性病变,可见1个或多个大小不一、充满液体的囊泡;囊泡破裂后发展成溃疡病变,在感染后10~15 d形成厚痂。水疱性及溃疡性病变多出现于蹄冠部趾间裂和冠状带周围,导致边缘上皮疏松坏死,严重者跛行,站立困难(图2)。有些母猪腹部和乳房部出现红色斑点,或伴有发热和厌食症状,甚至发烧(39.5~40.5 ℃),部分跛行的母猪体温可达41.0 ℃。新生仔猪体态虚弱,嗜睡,不愿吸乳,并出现急性死亡,在蹄掌部可见部分化脓性小泡[10,13]。
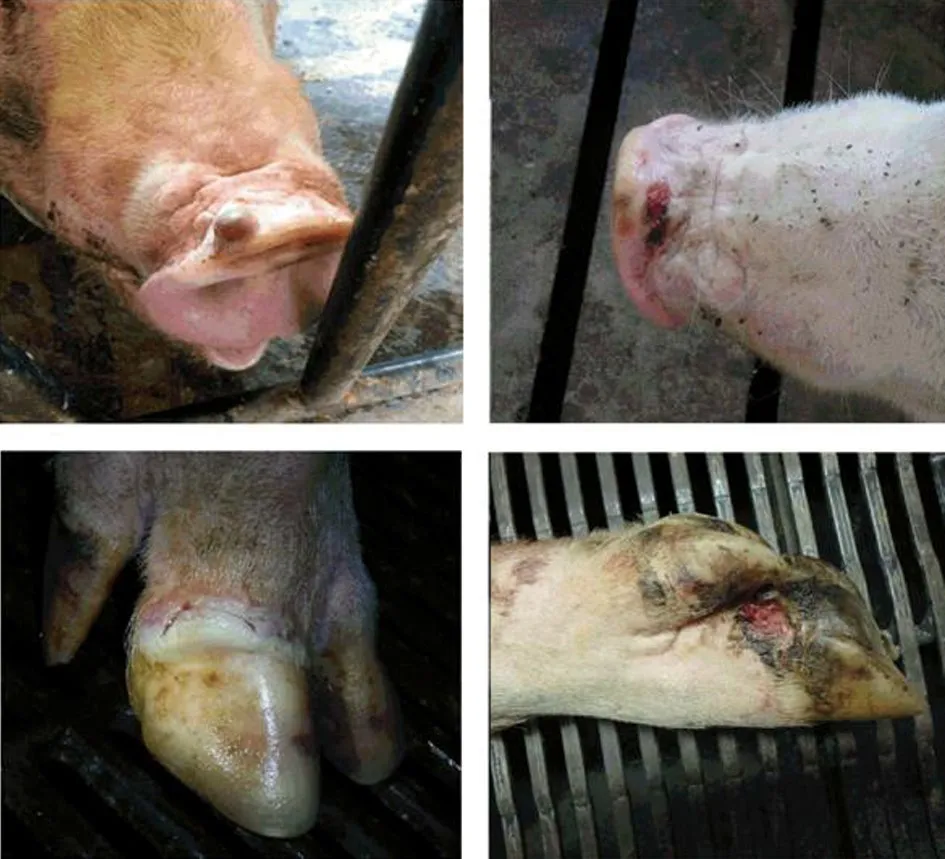
图2 鼻吻部出现囊泡(充满液体或溃破),蹄冠溃疡性病变
实验条件下,对SVV进行攻毒后,发现猪器官病理变化多生于扁桃体、脾、淋巴结和肺部,淋巴组织轻度至中度多灶性淋巴增生,肺扩张不全,偶见弥漫性充血,血管周围多灶性轻度淋巴细胞、浆细胞和巨噬细胞聚集。在感染的急性期,肺、纵隔、肠系膜淋巴结、肝、脾、小肠、大肠和扁桃体中可检测到病毒核酸或感染性病毒粒子。在康复期,肺、心脏和肝脏中检测不到病毒核酸;在纵隔、肠系膜淋巴结、肾、脾、小肠、大肠和扁桃体中,虽可检测到核酸,却不能分离到感染性的病毒粒子[14]。对9周龄及4月龄猪人工感染SVV流行毒株,发现潜伏期为4~5 d。病毒首先在扁桃体复制,病毒血症期约为7 d;在接毒后第3天,血清中病毒基因拷贝数达到峰值(约106.5拷贝/mL),随后逐渐下降;至攻毒后第10天,血清中已检不出病毒[15];SVV感染后约5 d,出现血清转化,随着抗体效价升高,组织中病毒含量、病毒血症、临床症状及排毒均随之下降或减轻;产生的SVV特异性IgM高峰持续约10 d(感染后5~15 d),之后抗体水平下降,至感染后第21天无法检测到;而SVV特异性IgG水平在感染后21 d达到高峰[14]。
SVV的发病率和死亡率,受猪群年龄、来源和地理分布等因素影响。2017年,美国母猪的发病率一度高达70%~90%,但死亡率只有0.2%左右,10~15 d后临床症状得到缓解,病猪迅速康复[16]。SVV在新生仔猪中所致发病率和死亡率很高,特别是1~4日龄仔猪,发病率达70%,死亡率达15%~30%,在仔猪群中出现临床症状和高死亡率的情况可持续2~3周。值得注意的是,在我国发现的情况是当母猪出现水疱性临床症状后,新生仔猪才开始死亡。这与在美国发现的仔猪出现临床症状先于母猪临床症状的情况不同[9]。
3 未来我国防控应对思考
3.1 建立健全动物水疱性疫病诊断处置方案
SVV所致猪水疱性临床症状与口蹄疫(FMD)等水疱性疫病相似,难以区分。2015年,巴西动物卫生部(DSA)公布了018/2015/CGI/DIPOA/SDA指导方案,规范了发现猪水疱性临床症状后应采取的措施及屠宰程序[6]。2016年,美国农业部颁布了确诊及疑似动物水疱性疾病疫情处置建议和程序,明确了主体责任,确保在调查研究外来动物疫病的同时,防止病原扩散[17-18]。鉴于SVV、SDVD和VSV等可能会对FMD诊断造成影响,应建立健全我国动物水疱性疫病诊断处置方案,提高各级兽医主管部门和动物疫病预防控制机构对水疱性疾病的认识和鉴别判断能力。
3.2 做好追溯研究,加强主动监测
美国经过20年(1988—2008年)血清学追溯性研究发现,SVV遍布美国多个州,且已存在数年[2]。然而,在巴西经过10年(2007—2016年)血清学追溯发现,2014年之前SVV在巴西猪群中并不存在[6]。在我国,出现SVV阳性的猪场以前从未发生过SVV感染,多年坚持自繁自养,未做引种,需进一步通过血清学追溯研究,摸清SVV在我国的分布和存在的时间,为下一步制定防控及净化策略提供参考。2015年,美国暴发SVV疫情后,通过RT-PCR方法对来自25个州无症状猪群的2 033份口腔液样品进行病原学检测,发现病毒RNA阳性率近1.2%[16]。这提示SVV可能在环境和猪群中持续存在,当猪群免疫低下或有抗体阴性仔猪混群后,就会引起SVV的暴发流行。因此,建议在开展口蹄疫主动监测时兼顾SVV监测。
3.3 分析病毒基因分子进化规律,关注SVV演变
目前主要根据SVV VP1基因和全基因做系统进化分析。Leme等[6]根据GenBank公布的序列信息将SVV暂时划分为3个谱系:I系为标准毒株SVV-001,II系主要为1988—1997年美国分离株,III系包括了2001年至今从巴西、加拿大、中国、泰国和美国分离的毒株。2017年初,从福建和河南省分离到的SVV毒株基因序列之间同源性达99.7%~99.8%,在亲缘关系上与美国KS15-01株相近(98.8%~98.9%),而与广东和湖北省分离到的毒株关系较远(96.3%~97.6%),因而推测在我国出现了新SVV毒株[19]。今后应在监测、诊断过程中持续追踪SVV基因组遗传变异情况,为病毒致病变化研究、实验室检测和疫苗开发提供参考。
3.4 继续进行病毒致病机制及宿主抗感染免疫机制等基础研究
目前已通过结晶并进行X射线衍射,研究了SVV的形态结构,为SVV 5´UTR内部核糖体进入位点(IRES)元件的研究提供了借鉴[20]。病毒3Cpro可以通过直接裂解MAVS、TRIF和TANK抑制I型干扰素的产生,促进病毒复制[21]。SVV通过结合炭疽毒素受体1(ANTXR1)感染细胞,提示未来可设计抗病毒药物来干扰病毒与ANTXR1的结合,进而抑制病毒复制[22]。下一步,应通过建立SVV反向遗传操作系统,研究病毒入侵及致病分子机制;分析SVV在细胞内完成复制的周期调控机制,筛选和确定影响自噬活性和细胞凋亡的关键病毒因子、靶分子及小分子化合物;在SVV感染宿主后,筛选和鉴定宿主抗病毒先天性免疫信号通路的关键调节蛋白、宿主细胞蛋白修饰(如磷酸化、泛素化修饰),以及发挥抗病毒作用的宿主非编码RNA及其作用机制。
3.5 制定SVV诊断国家标准,同时开发快速、灵敏、方便的现场诊断方法及高通量鉴别诊断方法
目前,在实验室病原学检测方面,国内外多家研究机构针对SVV基因3D、5´UTR和VP1等保守区域建立了普通RT-PCR、荧光定量RT-PCR和原位杂交ISH-RNA方法[23-25]。中国动物卫生与流行病学中心外来病研究中心利用重组酶聚合酶扩增技术(RPA)建立了实时荧光检测方法,在40 ℃、10 min内可检测的核酸最低浓度为28 拷贝/µL[26]。在血清学检测方面,通过表达SVV VP1重组蛋白[27]或利用二乙烯酰胺(BEI)灭活SVV免疫小鼠制备抗SVV单抗[28],分别建立了间接和竞争ELISA等方法。加拿大Bio-vet公司已开发了商品化的SVV抗体cELISA诊断试剂盒。除了ELISA方法外,间接免疫荧光试验与病毒中和试验检测方法也用于流行病学监测及调查。针对目前SVV流行情况,应尽快制定SVV国家诊断标准,此外可利用RPA恒温扩增技术和胶体金等技术,开发适于基层兽医和猪场使用的病原和抗体快速检测试纸条;利用液相芯片和α-ELISA等技术,开发高通量多重检测方法,对可导致猪出现水疱性临床症状的FMDV、SVV、SVDV、VSV和VESV等病原做出病原学和血清学鉴别诊断。
3.6 研制新型安全有效的SVV疫苗
目前尚无商品化的SVV疫苗问世。美国以当地SVV流行株KS15-01为骨架,利用反向遗传技术,构建了感染性克隆vKS15-01-EGFP,为下一步通过定点突变,研发高效、无致病性且具备标记(DIVA,区分感染和免疫动物)的重组病毒活疫苗提供了依据[29]。此外,可将口蹄疫合成肽疫苗作为参照,利用计算机辅助进行抗原位点分析预测,对主要抗原位点进行变异情况研究,对可能的抗原位点肽段进行化学合成,通过动物试验对候选SVV多肽抗原进行筛选,根据筛选结果对抗原位点进行优化,确保有效囊括T细胞表位和B细胞表位,以增强多肽抗原的免疫效果。
3.7 加强饲养管理,提高生物安全水平
由于目前没有疫苗或有效的治疗方法来防治SVV,因此猪场的饲养管理和生物安全防范至关重要。哺乳母猪和仔猪的圈舍环境应舒适,并确保1周龄内仔猪摄取足量优质初乳。猪舍应远离公路等车辆流通区域,最好做到运输生猪车辆专车专用,出入场舍做好消毒,且应避免该车与SVV阳性猪场车辆、人员和动物接触。饲养人员进出猪舍应沐浴并更换工作服和靴子,接触不同猪群时应有间隔观察期。应从猪群健康、无疫病发生的猪场引种,有条件的可在引种前对待引猪进行抽样检测,混群前隔离观察。避免老鼠、苍蝇等生物媒介与猪群接触。对于SVV阳性猪场,除了提高管理水平外,应严格执行全进全出制度,对猪舍、设备和工具严格清洁和消毒。
4 小结
猪SVV作为近两年在全球多地出现的一种跨境动物疫病病毒,已对多国养猪业造成了不同程度的影响,但其受到的关注还远远不够。SVV的致病机制和传播方式如何,未来流行态势将怎样演变,不得而知,但可以明确的是各国应对SVV高度重视。我国是养猪大国,生猪养殖总量约为全球的50%,是最大的生猪生产基地和猪肉需求市场。根据2017年2月28日国家统计局发布的《2016年国民经济和社会发展统计公报》数据显示,2016年末我国生猪存栏43 504万头,生猪出栏68 502万头,生猪养殖业在国计民生中占有重要地位。因此,有必要提高认识,紧密把握SVV的流行态势,研究病毒宿主相互作用机制,尽快做好诊断和疫苗技术储备,提高对SVV的综合防控能力。
[1] REDDY P S,BURROUGHS K D,HALES L M,et al.Seneca valley virus,a systemically deliverable oncolytic picornavirus,and the treatment of neuroendocrine cancers[J]. Journal of the national cancer institute,2007,99(21):1623-1633.
[2] HALES L M,KNOWLES N J,REDDY P S,et al.Complete genome sequence analysis of seneca valley virus-001,a novel oncolytic picornavirus[J]. Journal of general virology,2008,89(5):1265-1275.
[3] BURKE M J,AHERN C,WEIGEL B J,et al. Phase I trial of seneca valley virus(ntx-010)in children with relapsed/refractory solid tumors:a report of the children's oncology group[J]. Pediatr blood cancer,2015,62(5):743-750.
[4] MUNDAY B L,RYAN F B. Vesicular lesions in swine-possible association with the feeding of marine products[J]. Australian veterinary journal,1982,59(6):193.
[5] ZHANG J,PINEYRO P,CHEN Q,et al. Full-length genome sequences of senecavirus a from recent idiopathic vesicular disease outbreaks in U.S. swine[J]. Genome announcements,2015,3(6):e01270.
[6] SAPORITI V,FRITZEN J T T,FERONATO C,et al. A ten years(2007—2016)retrospective serological survey for seneca valley virus infection in major pig producing states of Brazil[J]. Veterinary research communications,2017,41(4):317-321.
[7] SUN D,VANNUCCI F,KNUTSON T P,et al.Emergence and whole-genome sequence of senecavirus a in Colombia[J]. Transboundary & emerging diseases,2017,64(5):1346-1349.
[8] SAENG-CHUTO K,RODTIAN P,TEMEEYASEN G,et al.The first detection of senecavirus a in pigs in Thailand,2016[J]. Transboundary & emerging diseases,2017,64(5):1346.
[9] ZHU Z,YANG F,CHEN P,et al. Emergence of novel seneca valley virus strains in China,2017[J].Transboundary & emerging diseases,2017,64(4):1024-1029.
[10] WU Q,ZHAO X,BAI Y,et al. The first identification and complete genome of senecavirus a affecting pig with idiopathic vesicular disease in China[J]. Transboundary &emerging diseases,2017,64(5):1633.
[11] QIAN S,FAN W,QIAN P,et al. Isolation and full-genome sequencing of seneca valley virus in piglets from China,2016[J]. Virological journal,2016,13(1):173.
[12] WANG H,LI C,ZHAO B,et al. Complete genome sequence and phylogenetic analysis of senecavirus a isolated in northeast China in 2016[J]. Archives of virology,2017,162(10):3173-3176.
[13] WU Q,ZHAO X,CHEN Y,et al. Complete genome sequence of seneca valley virus ch-01-2015 identified in China[J]. Genome announc,2016,4(1):e01509-e01515.
[14] JOSHI L R,FERNANDES M H,CLEMENT T,et al.Pathogenesis of senecavirus A infection in finishing pigs[J]. Journal of general virology,2016,97(12):3267-3279.
[15] LEME R A,OLIVEIRA T E,ALFIERI A F,et al.Pathological,immunohistochemical and molecular findings associated with senecavirus a-induced lesions in neonatal piglets[J]. Journal of comparative pathology,2016,155(2/3):145-155.
[16] HAUSE B M,MYERS O,DUFF J,et al. Senecavirus a in pigs,United States,2015[J]. Emerging infectious diseases,2016,22(7):1323-1325.
[17] WANG L,PRARAT M,HAYES J,et al. Detection and genomic characterization of senecavirus A,Ohio,USA,2015[J]. Emerging infectious diseases,2016,22(7):1321-1323.
[18] SEGALES J,BARCELLOS D,ALFIERI A,et al.Senecavirus A:an emerging pathogen causing vesicular disease and mortality in pigs[J]. Veterinary pathology,2016,54(1):11.
[19] ZHAO X,WU Q,BAI Y,et al. Phylogenetic and genome analysis of seven senecavirus A isolates in China[J]. Transboundary & emerging diseases,2017,64(6):2075-2082.
[20] WILLCOCKS M M,LOCKER N,GOMWALK Z,et al.Structural features of the seneca valley virus internal ribosome entry site(IRES)element:a picornavirus with a pestivirus-like IRES[J]. Journal virological,2011,85(9):4452-4461.
[21] QIAN S,FAN W,LIU T,et al. Seneca valley virus suppresses host type I interferon production by targeting adaptor proteins MAVS,TRIF,and TANK for cleavage[J]. Journal virological,2017,91(16):17.
[22] MILES L A,BURGA L N,GARDNER E E,et al.Anthrax toxin receptor 1 is the cellular receptor for seneca valley virus[J]. Journal of clinical investigation,2017,127(8):2957-2967.
[23] FOWLER V L,RANSBURGH R H,POULSEN E G,et al. Development of a novel real-time RT-PCR assay to detect seneca valley virus-1 associated with emerging cases of vesicular disease in pigs[J]. Journal of virological methods,2017,239:34-37.
[24] FERONATO C,LEME R A,DINIZ J A,et al.Development and evaluation of a nested-PCR assay for senecavirus a diagnosis[J].Trop anim health prod,2017(1):1-8.
[25] 樊晓旭,赵永刚,迟田英,等. 塞尼卡谷病毒TaqMan荧光定量PCR检测方法的建立[J]. 中国预防兽医学报,2016,38(12):959-962.
[26] 樊晓旭,哈登楚日亚,王英丽,等. 塞尼卡谷病毒重组酶聚合酶扩增技术(RPA)实时荧光检测方法的建立[J]. 中国动物检疫,2017,34(8):81-86.
[27] GIMENEZ L L G,RADEMACHER C,LINHARES D,et al. Serological and molecular detection of senecavirus A associated with an outbreak of swine idiopathic vesicular disease and neonatal mortality[J]. Journal of clinical microbiology,2016,54(8):2082-2089.
[28] YANG M,VAN B R,XU W. Generation and diagnostic application of monoclonal antibodies against seneca valley virus[J]. Journal of veterinary diagnostic investigation,2012,24(1):42-50.
[29] CHEN Z,YUAN F,LI Y,et al. Construction and characterization of a full-length cDNA infectious clone of emerging porcine senecavirus A[J]. Virology,2016(497):111-124.
