新疆南疆地区羊口疮病毒的分离鉴定及其遗传进化分析
2018-02-28沙娜瓦尔塔希买买提艾力斯迪克比力克孜阿不都热依木盛卓君依布拉依木阿布力米提居马别克夏拉巴依阿依吐拉肉孜
沙娜瓦尔·塔希,买买提艾力·斯迪克,比力克孜·阿不都热依木,马 伟,盛卓君,依布拉依木·阿布力米提,居马别克·夏拉巴依,阿依吐拉·肉孜,薛 文,王 文*
(1.新疆维吾尔自治区动物卫生监督所,新疆 乌鲁木齐 830001;2.新疆喀什地区动物疾病控制与诊断中心,新疆 喀什 844000;3.新疆阿图什市畜牧兽医站,新疆 阿图什 845350)
羊传染性脓疱、羊传染性脓疱皮炎、羊传染性脓疱口炎也都被称为羊口疮,是一种全球流行的急性、接触性传染病,是一种非系统性皮肤和衰弱的疾病[1],主要感染绵羊和山羊,但也有报道称可以感染如骆驼、驯鹿、狗、猫和松鼠等各种反刍动物和哺乳动物[2],另外人在与患病动物亲密接触时也有可能被感染[3]。该病毒是副痘病毒属痘病毒科大家族中的一员,其感染特点是羊口、鼻、唇、乳房等处出现增殖,其后是形成丘疹、囊泡和尘土样脓疱,最终变得干燥后脱落,感染羊口疮的羊只死亡率较低,但可以引起其他细菌的继发感染,使其死亡率大大增加,给养羊业造成巨大的经济损失[4]。
羊口疮传统的诊断方法包括观察口腔黏膜、嘴唇等出现的临床症状,血清中和实验、病毒分离和电子显微镜观察[5]。PCR与实时定量PCR的开发为病原的快速诊断与确定提供了极大的便利。羊口疮病毒是基因组大小为130~150kb的双链DNA分子,包含约130多个基因,编码几十种蛋白[6]。BamH I酶切片段的B2L基因,编码大小为42ku的病毒囊膜蛋白,可刺激淋巴细胞诱导强烈的抗体反应[7]。ORFV121编码一种特异性病毒NF-kB信号通路抑制物,结合NF-kBp65并抑制其磷酸化和核转运,抑制NF-kB信号通路,从而抑制细胞凋亡[8]。2016年3月,新疆喀什某地区绵羊场发生疑似羊口疮 ,本实验以羊口疮病毒B2L基因和ORFV121基因设计引物进行PCR扩增,并与其它流行毒株进行核苷酸和氨基酸同源性比对以及进化树的分析,以探明喀什等地区羊场中羊只感染羊口疮病毒的情况。
1 材料和方法
1.1 样品采集与处理
样品采自新疆喀什某羊场疑似ORF的绵羊乳房部结痂,用高压灭菌的剪刀将痂皮剪碎,加入青霉素和链霉素各1 000 U/mL并研磨,然后加维持液放入4℃冰箱过夜,以6 000 r/min,4℃,离心30min,取上清,过滤除菌后存于-20℃冰箱中备用。
1.2 主要试剂、载体及细胞
pMD18-T载体、DH5α感受态细胞、ExTaq酶、T4DNA连接酶、DNA凝胶回收纯化试剂盒、小量质粒纯化试剂盒购自上海生工有限公司;细胞培养液及胎牛血清均为Gibco公司。
1.3 病毒分离
取3mL样品接种于生长密度80%~90%且生长状态良好的羊皮肤成纤维细胞 (goat skin fibroblasts,GSFs),37℃培养2 h,加入含1%双抗的维持液,37℃下5%CO2培养箱培养4~5 d,同时设置阴性对照,病毒接种细胞后传至第5代,若细胞一直没有出现病变,则为阴性,细胞完全病变后,加入少量的NaHCO3,调节溶液的pH值,分装后放于-20℃保存备用。
1.4 引物的设计与合成
根据GenBank公布的羊口疮病毒OV-IA82株B2L基因和ORFV121基因全序列,使用Primer5.0软件 设 计 如 下 引 物 ,B2L 上 游 为 5’ -ATGTGGCCGTTCTCCTCC -3’,B2L 下 游 为 5’ -ATTTATTGGCTTGCAGAACTCC-3’;ORFV121 上游为 5’-ATGGCTGGCTTCCTAGGC-3’,ORFV121 下游为5’-CAGAACTTCCTCCACTTTGCA-3’,引物由上海生工有限公司合成。
1.5 目的基因的扩增、克隆及鉴定
吸取上述1.3中上清200μL,按照DNA提取试剂盒操作说明书提取病毒DNA,加入上下游引物进行PCR扩增,扩增产物经琼脂糖凝胶电泳检测,并回收纯化PCR扩增产物。用T4连接酶将纯化的产物连接至pMD18-T载体,转化到DH5α感受态细胞,然后涂布于加有抗性的LB平板上,37℃温箱中培养10~12 h挑取挑斑摇菌,将筛选到的阳性克隆,小量质粒试剂盒提取质粒送至上海生工有限公司测序。
1.6 ORFV-B2L基因与ORFV121基因的序列分析
对扩增的B2L和ORFV121全基因序列利用DNAStar软件与GenBank中其他不同地区流行毒株(如表1、表2)进行分析,包括核苷酸、氨基酸序列同源性分析,并利用MEGA6.06软件绘制进化树,对其亲缘性进行分析。
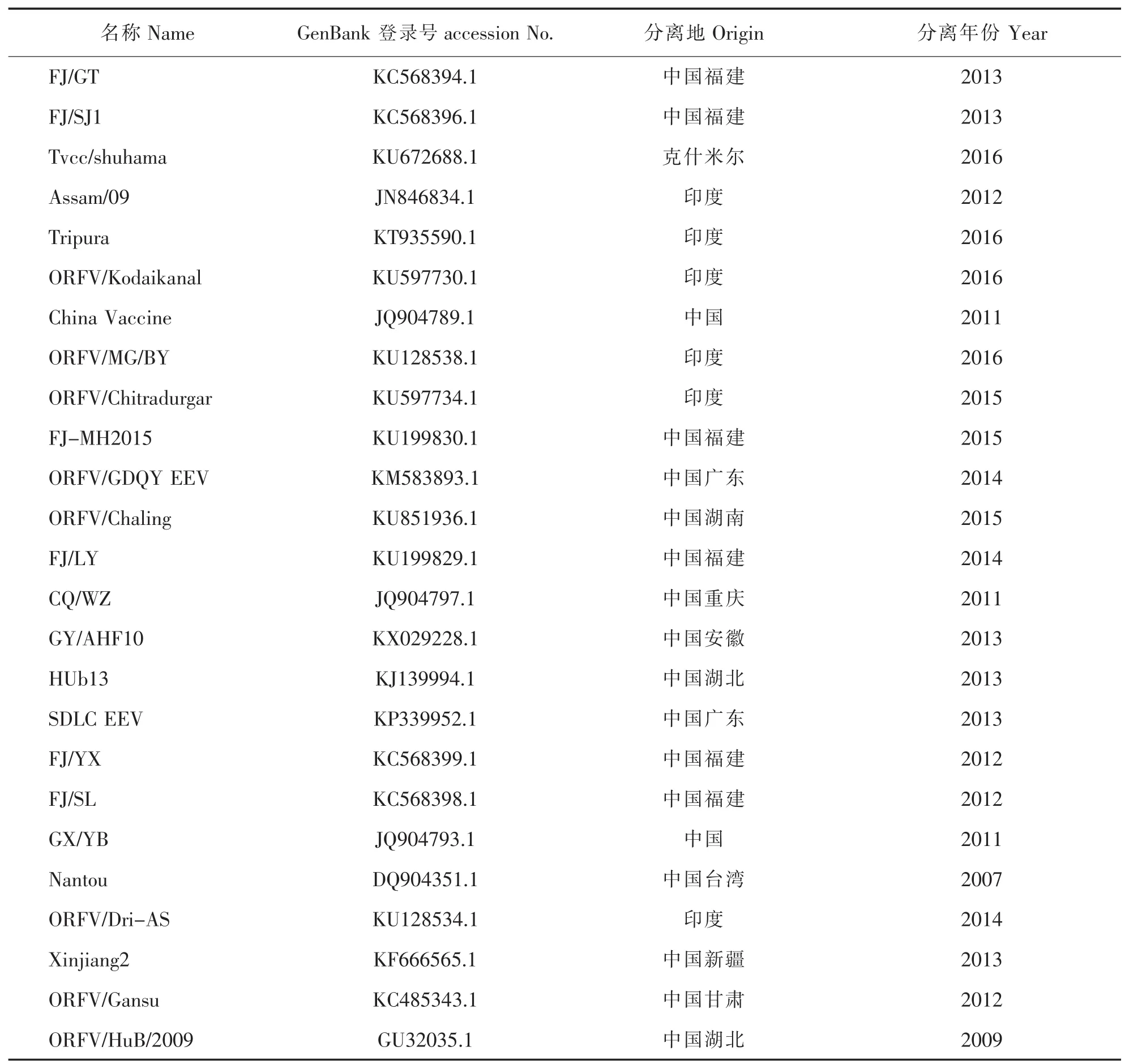
表1 25株B2L基因病毒分离株

表2 ORFV121基因病毒分离株
2 结果与分析
2.1 病羊的临床症状
2016年3月,新疆喀什等地区出现了绵羊疑似感染ORFV病羊表现为口唇、舌、鼻、乳房等部位形成丘疹、水疱、脓疱和结成疣状痂。根据以上初步诊断为ORFV感染。
2.2 病毒的分离
将分离得到的疑似羊口疮病毒病料在GSFs细胞上盲传,盲传至第5代时出现了明显的病变,表现为细胞培养24 h后细胞逐渐变圆,开始肿胀,72 h后细胞病变达到90%,拉网、游离继而脱落(图1.A),而对照组细胞生长紧密(图1.B)
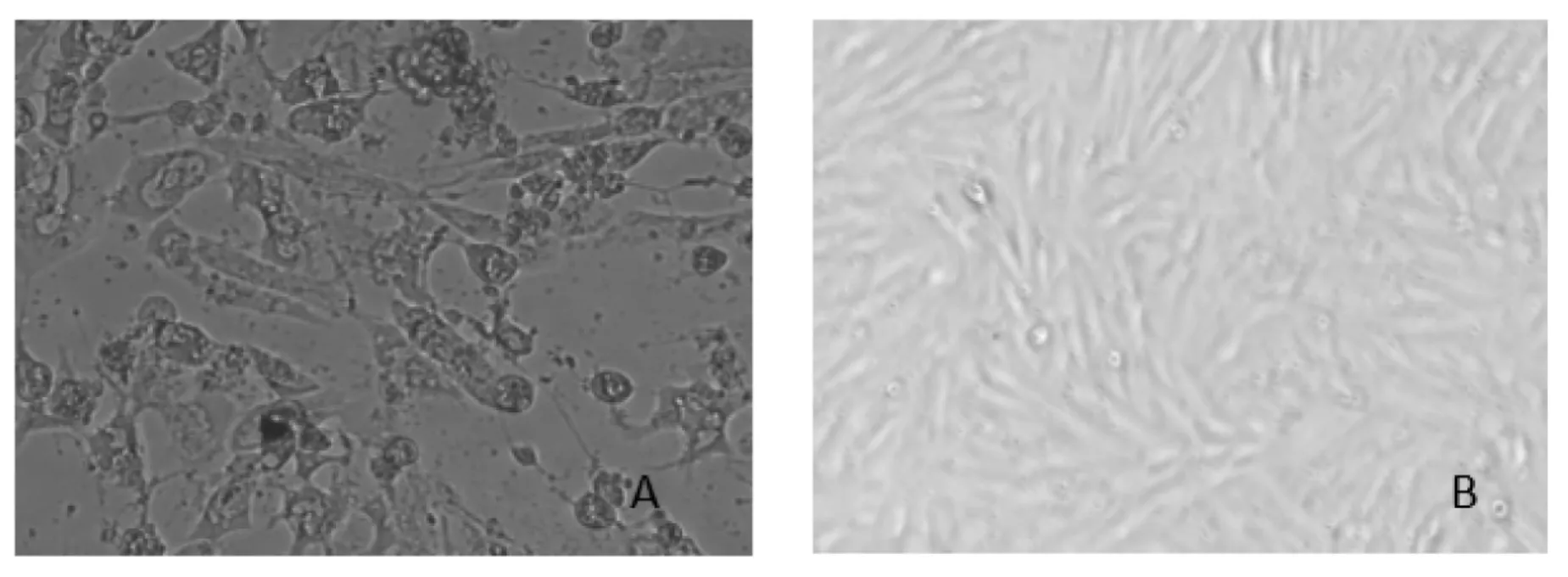
图1 盲传至第5代的病毒在接种GSFs细胞72 h后出现的病变(10×100)A.接毒72h后出现病变的GSFs细胞;B.阴性对照组GSFs细胞
2.3 B2L基因和ORFV121基因的PCR扩增
琼脂糖凝胶电泳结果显示,在1097bp和889bp处均出现明亮条带,与预期相符(如图2、图3)。
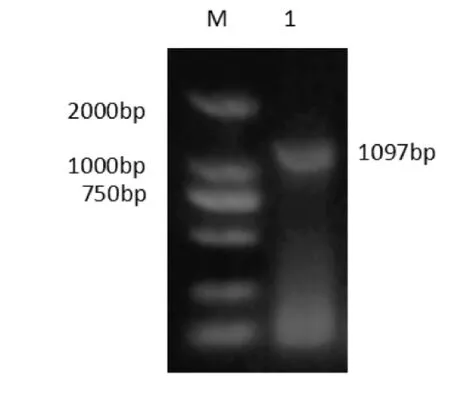
图2 B2L基因扩增 M.DL2000DNA Marker; 1.B2L基因目的条带
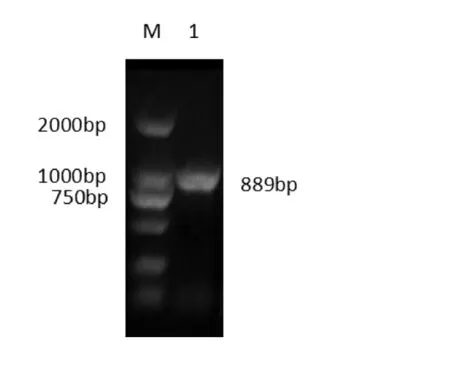
图3 ORFV121基因扩增M.DL2000 DNA Marker;1.ORFV121基因目的条带
2.4 B2L基因与ORFV121基因序列分析
将测序结果与其他不同毒株B2L和ORFV121基因序列进行比对,结果发现B2L基因和其他25株核苷酸和氨基酸同源性分析分别为94.7%~98.5%、95%~97%,其中与中国疫苗株的核苷酸同源性为97%,且核苷酸序列较为保守。ORFV121基因的核苷酸和氨基酸同源性分别为93.6%~99.1%、87.7%~98.0%,该核苷酸序列第74bp-78b区段发生片段缺失,与国外ORFV毒株B029(KF837136.1)、OA-IA82(AY386263.1)和我国毒株NA1/11(KF234407.1)相似(如图4)。采用MEGA6.06软件绘制进化树,结果显示该分离株B2L基因与其它毒株均不在同一分支,但和印度的两只分离株(登录号分别为KU672688.1、KT935590.1)的亲缘关系较近(如图5),基于ORFV121基因进化树显示,本研究获得的ORFV分离株与我国NA1/11分离株(KF234407.1)亲缘关系最近(如图6)。

图4 ORFV121基因与其它毒株部分核苷酸比对序列图
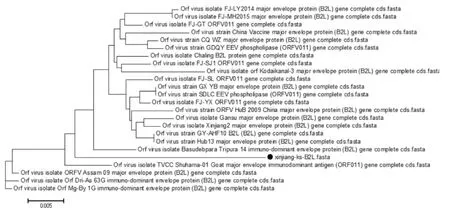
图5 基于B2L基因的遗传进化树分析
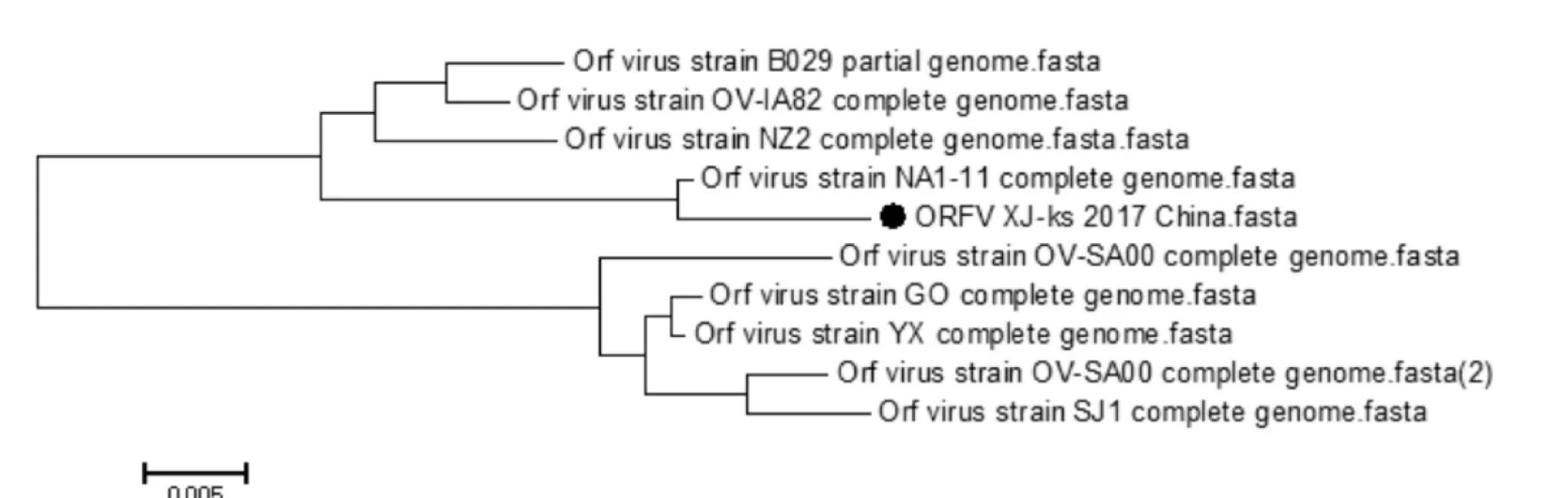
图6 基于ORFV121基因的遗传进化树分析
3 讨 论
根据新疆喀什等地区羊场羊只发病的临床症状,初步判断为羊口疮病毒感染,为确定病原,本研究通过分离疑似病毒接种于GSFs细胞,以细胞培养物产物为模板,扩增该分离株的B2L基因和ORFV121基因并进行序列分析,该病毒疑似物在GSFs细胞中盲传至第五代时出现明显的病变,PCR扩增结果显示均出现了预期大小的片段,这表明成功分离到一株ORFV,命名为ORFV/XJ-NJ/2017/China,证明了该分离株是羊口疮病毒感染所致。
羊口疮是一种重要的人畜共患病,且传播速度快,波及的范围广,对养羊业造成严重危害。近年来该病在全世界范围内发生频率较高,且被感染的宿主范围不断扩大[9],并且近年来有报道称一些羊场采用弱毒疫苗免疫羊只后不能起到有效的保护作用,推测ORFV流行株在进化过程中可能发生了不同程度的遗传变异。B2L基因位于羊口疮病毒第11个完整开放阅读框,序列高度保守,编码着病毒囊膜蛋白,承担着主要的免疫压力,是ORFV的保护性抗原基因。Oem等[10]在对韩国ORFV分离株进行了遗传进化分析时发现,该分离株B2L基因存在着一定的变异,并指出ORFV感染的宿主有从奶山羊向黑山羊过渡的趋势,因此推测B2L基因的变异可能会导致毒株的变异。ORFV121基因编码抑制细胞凋亡的蛋白,刘芳等[8]研究发现ORFV121基因在发生突变或者丢失时,抑制细胞凋亡的作用会减弱或者消失,宿主被羊口疮病毒感染后,机体可迅速识别或消灭病毒,而野毒感染的羊群则会长期带毒。B2L基因核苷酸序列分析表明,该ORFV分离株与其它毒株核苷酸和氨基酸同源性较高,分别为94.7%~98.5%、95%~97%,序列较为保守,与中国疫苗株的核苷酸同源性为97%,遗传进化树结果可得,该分离株与印度两支分离株 (登录号KU672688.1、KT935590.1)亲缘关系最近,基于ORFV121基因进化树显示,本研究获得的ORFV分离株与我国NA1/11分离株(KF234407.1)亲缘关系最近,与其它分离株核苷酸和氨基酸同源性分别为93.6%~99.1%、87.7%~98.0%。提示着该毒株在进化过程中产生了部分氨基酸的变异。
近年来,新疆的养羊业发展迅速,规模化的羊场数量快速增加,疫苗接种是预防和控制该病发生的有效手段,但很多羊场因为ORFV弱毒苗免疫后的不确定性及一定的安全问题,不选择疫苗免疫。由核苷酸序列比较可知该毒株B2L基因较为保守,和疫苗株同源性较高,可推测该病毒株变异不大,疫苗免疫依旧可以用于该地区的疫情预防与控制。羊口疮是新疆养羊业的主要疫病之一,疫苗免疫的同时也要从饲养、营养、消毒等方面进行综合防控。
[1]Jia H,Zhan L,Wang X,et al.Transcriptome analysis of sheep oral mucosa response to Orf virus infection[J].PloS one,2017,12(10):e0186681.
[2]Inoshima Y,Murakami K,Wu D,et al.Characterization of parapoxviruses circulating among wild Japanese serows(Capricornis crispus)[J].Microbiology and immunology,2002,46(8):583-587.
[3]Kumar N,Wadhwa A,Chaubey K K,et al.Isolation and phylogenetic analysis of an orf virus from sheep in Makhdoom,India[J].Virus Genes,2014,48(2):312-319.
[4]陈慧芹,王小平,罗树红,等.羊口疮病毒蛋白ORFV035的表达,纯化和多克隆抗体的制备[J].生物技术通报,2017,33(7):150-154.
[5]Büttner M,RZIHA H J.Parapoxviruses:from the lesion to the viral genome[J].Zoonoses and Public Health,2002,49(1):7-16.
[6]林裕胜,江锦秀,林甦,等.羊传染性脓疱病毒研究进展[J].动物医学进展,2016,37(2):91-96.
[7]Yu Y,Tan Q,Zhao W,et al.Characterization of an orf virus isolate from an outbreak in Heilongjiang province,China[J].Archives of Virology,2017,162(10):3143-3149.
[8]刘方,赵玄多,安贝,等.羊口疮病毒凤翔株ORFV121和vIL-10基因的生物信息学分析[J].动物医学进展,2014,35(7):52-58.
[9]Venkatesan G,Balamurugan V,Bora D P,et al.Sequence and phylogenetic analyses of an Indian isolate of orf virus from sheep[J].Vet Ital,2011,47(3):323-32.
[10]Zhao K,He W,Gao W,et al.Orf virus DNA vaccines expressing ORFV 011 and ORFV 059 chimeric protein enhances immunogenicity[J].Virology journal,2011,8(1):562.
