胰蛋白酶在两种载体上的固定化效果比较
2018-02-15何云富张邵博兰海鸥李明生
何云富,张邵博,程 浩,兰海鸥,李明生
(1.西北民族大学 生物工程与技术国家民委重点实验室,甘肃 兰州 730030;2.西北民族大学 甘肃省动物细胞工程技术研究中心,甘肃 兰州 730030;3.西北民族大学 生命科学与工程学院,甘肃 兰州 730030)
由于固定化酶具有可重复利用,使用周期长等优点,在研究应用中被广泛运用于食品,生物学,环境及工业生产中[1].基于胰蛋白酶特异性作用于蛋白质的精氨酸,赖氨酸的羟基所形成的肽键,常用于水解蛋白质[2].由于胰蛋白酶易发生自溶,使用一次后无法回收再利用,变性后无法去除而成为杂质,常造成生产成本过高[3].为提高酶的利用率,制作成固定化酶,用于发酵罐水解蛋白等生产时,可降低生产成本[4].
在固定化酶技术中,载体材料上的活性基团、微环境,载体的形状、大小、孔径、表面积等因素,可影响载体与酶的亲和力,固定化酶活力、稳定性、重复使用性、可回收性及机械强度等[5].固定化酶需要满足以下三个基本条件:①酶必须用简单易行的方法固定于载体上;②酶载体必须很容易和反应物产物分离;③载体必须能承受机械力[6].作为固定化酶的材料有介孔材料、纳米材料、磁性材料及天然高分子材料.介孔材料具有有序、可调节的孔道结构,相对于微孔材料具有较大的比表面积、较大的孔容、较窄的孔径分布、良好的热稳定性及化学稳定性等优点.对其进行改性后,其表面可获得配基,如-NH2、-SH、-CN、-Cl、-C6H5等有机官能团[7],以提供大量与酶的结合位点,增加酶的稳定性.纳米材料如多孔纳米金[8]、碳纳米管等[9-10]具有良好的化学稳定性、极高的机械强度、极大的韧性、良好的电导率、良好的生物相容性等优点.磁性材料,一般为有机材料包覆,涂覆或含金属离子的改性材料,如含四氧化三铁的磁性纳米材料[11].在纳米材料的优点基础上 ,还可根据不同磁场、磁性,对固定化酶进行分离回收,使用更简便[12].天然高分子材料具有来源广泛,生物相容性较好的优点.固定化酶主要分为物理固定和化学固定两类,方法有吸附法、结合法、交联法和包埋法,各方法均具有优缺点[13].
曾嘉等以壳聚糖制成微球固定化葡萄糖氧化酶,获得稳定且活力回收率较高的固定化酶,但存在固定化酶固载量不高的缺点[14].由乳化固化法制备的纤维素微球为圆球形结构,球径为(100±10)um,经与DEAE偶联改性,获得-NH2,偶联上的大量氨基可与戊二醛发生Schiff反应,再与酶固定化.片状载体由高分子材料聚丙烯合成的用于动物细胞贴壁生长、半悬浮培养的载体,其内部有网格结构,便于在交联剂处理后与胰蛋白酶发生交联[16].聚丙烯为亲水性材料,可提高与胰蛋白酶的吸附特性,可提高与水解底物的充分接触.徐坚等报道,强亲水性材料聚丙烯对脂肪酶的吸附性相比于其他膜材料要高[15].本实验选择的材料为片状载体和纤维素微球,以交联法用于固定化胰蛋白酶,用戊二醛作为交联剂[17].其优点是适用范围广,固定化程度强,固定化后的胰蛋白酶不易脱落,可重复回收使用[18].探讨影响固定化酶固载量和酶活比的主要因素:交联剂类型、交联剂浓度、固定化温度、交联时间、pH等,对两种载体固定化胰蛋白酶的影响,并对其进行工艺优化.
1 材料
1.1 材料及仪器
胰蛋白酶由明海生物有限公司提供,酶活比为25 U°/mg;酪蛋白为分析纯蛋白烟台市双双化工有限公司购买;纤维素微球为乳化固化法制得后经150目筛,得到粒径(50±10~100±10)um的微球(见图1).片状载体(见图2)由明海生物有限公司提供,其他试剂均为分析纯.
紫外可见分光光度计:型号Biomate 5上海奥析科学仪器有限公司生产,在A280处测量OD值;立式水平摇床:型号ZWY-1102C上海智成有限公司生产;磁力搅拌器:型号HJ-6B上海国华有限公司生产;便携式酸度计:型号MP120-BLE梅特勒-托利多仪器(上海)有限公司.

图1经偶联DEAE纤维素微球(200 × )图2片状载体(200 × )
2 方法
2.1 固定化酶制备
固定化酶的制备过程主要包括:载体预处理、交联、固定化以及固定化效果评价.评价指标为载体上的固定化含量以及活力回收率.
2.2 固定化酶制备单因素试验
交联法制备固定化酶工艺中影响固定化酶固载量和活力回收率的因素主要包括:交联剂浓度、交联时间、交联温度、固定化时间及酶的浓度.本文在前人的基础上,重点考察以上因素对固定化酶制备的影响.
交联剂浓度对酶固载量和酶活有较大影响,选择戊二醛(glutaraldehyde,GA)作为交联剂,是一种常用的同型双功能交联剂,两个醛基可分别与HRP和抗体蛋白的氨基形成Schiff碱(-N=C-),以五碳桥连接起来.戊二醛连接反应是最温和的交联反应之一.可在4~40 ℃范围,pH 6.0~8.0的缓冲液中进行.另外,GA缩合体使被结合的蛋白分子与分子之间的间隔延长,免于蛋白分子的三级结构发生改变[17].
2.2.1 交联剂浓度
准确配制交联剂浓度为1%、2%、3%、4%、 5%的戊二醛溶液,与片装载体和纤维素微球分别进行交联,恒定其他条件不变(交联10 h,交联温度10 ℃,固定化时间10 h,pH=8.0,胰蛋白酶浓度2%),测定酶固载量及活力回收率.
2.2.2 交联温度
在恒定其他试验条件(戊二醛浓度2%,交联10 h,pH =8.0,固定化时间10 h,胰蛋白酶浓度2%)的基础上,分别选取交联温度10 ℃,20 ℃,30 ℃,测定载体上的胰蛋白酶固载量并记录.
2.2.3 交联时间
在恒定其他试验条件(戊二醛浓度2%,交联时pH =8.0,交联温度为10 ℃,固定化时间10 h,胰蛋白酶浓度2%)的基础上,交联时间分别选取5 h、10 h、15 h、20 h测定载体上的胰蛋白酶固载量并记录.
2.2.4 胰蛋白酶浓度
在恒定其他试验条件(戊二醛浓度2%,交联温度10 ℃,交联时间10 h,交联温度10 ℃,固定化时间10 h,固定化pH为8.0)的基础上,胰蛋白酶浓度设置为1%、1.5%、2%、2.5%、3%,分别测定载体上的胰蛋白酶固载量并记录.
2.3 固定化酶制备的工艺优化
2.3.1 正交试验优化
在前期的单因素试验的基础上,采用L9(34)正交试验,选取交联温度(A),戊二醛浓度(B),交联时间(C),固定化pH(D)四个因素,不考虑因素间的交互作用,每个因素设计三个平行,试验方案见表1.
表1正交试验方案L9(34)

试验指标为固定化酶固载量和固定化酶的活力回收率.考虑到生产成本和经验条件,固定化酶的活力回收率比固定化酶固载量重要性大,活力回收率权数取3,酶固载量权数为1,综合平衡法得出较优方案.
经正交实验获得较优的两种载体的固定化胰蛋白酶制备工艺,以较佳工艺路线作为实验条件,进行验证实验.
2.4 载体预处理
纤维素微球偶联氨基(使用DEAE),经偶联的纤维素微球和片状载体在相同条件下进行处理.用纯水水洗后,以70%乙醇经30 min浸泡,弃乙醇;4%NaOH经磁力搅拌器常温搅拌30 min,去离子水水洗3遍;0.5 mol/L的硫酸铵溶液经磁力搅拌器常温搅拌30 min,去离子水水洗3遍;4%HCl经磁力搅拌器常温搅拌30 min,去离子水水洗3遍;4%NaOH经磁力搅拌器常温搅拌30 min,去离子水水洗,用酸度计测pH,水洗至载体pH与去离子水相同.
2.5 胰蛋白酶浓度与吸光度关系标准曲线及其方程
准确配制0.5%、1%、1.5%、2%胰蛋白酶溶液,在280 nm处测OD值制作标准曲线(2≤OD≤0.8),得出胰蛋白酶浓度与OD值之间的方程,y=ax+b(x为测定处的OD值,y为溶液中的胰蛋白酶浓度),R2≥0.95,则标准曲线方程可信.
标准曲线方程:y=7.5253x-0.053,R2=0.9832 >0.95.
试验溶液中胰蛋白酶含量由该方程计算得出.
2.6 固定化酶效果检测
2.6.1 贮藏稳定性
贮藏稳定性:称取5 g纤维素微球固定化胰蛋白酶经水洗,抽滤,加入至20 mL纯水中,放入磁转子,置于300 r/min,温度设定为50 ℃的磁力搅拌器上,每隔7 d测OD值(吸光值280 nm处),空白对照为纯水.经5次测量OD值,计算固定化酶固载量,测定酶活比.
2.6.2 操作稳定性
将两种固定化酶分别称取5份,每份2 g,在100 mL的2%酪蛋白溶液,45 ℃下连续反应 10次.每次反应时间为2 h.每次反应后分别测定酶活力,检测两种材料的载体固定化酶的操作稳定性.
2.6.3 酶固载量
以固定化不同时间点的载体上的胰蛋白酶浓度做为评价指标,以紫外分光光度计测量OD值,吸光值设置为280 nm.以胰蛋白酶标准曲线计算载体上固定的胰蛋白酶含量,以确定固定化率.
Z=(K-S)/5g,G%=Z/K.
Z:每克载体上含有的胰蛋白酶毫克数;K:固定化前加入的溶液中胰蛋白酶的含量;S:固定化结束时反应容器中胰蛋白酶量;G:固定在载体上的胰蛋白酶占加入的胰蛋白酶量的比例.
2.6.4 酶活力回收率
游离酶参照国标测定.蛋白酶在一定的温度与pH条件下水解底物,产生含有酚基的氨基酸(如:酪氨酸、色氨酸等),在碱性条件下,将福林试剂(Folin)还原,生成钼蓝与钨蓝,用分光度法测定,计算其酶活力.固定化酶活力回收率参考库汉生等固定化胰蛋白酶活力的测定方法探讨[19],使用固定化胰蛋白酶活力湿态直接测量法.酶活力回收率为固定化酶第5次水解酪蛋白时的酶活比比以第一次水解时的酶活比.
3 结果与分析
3.1 单因素试验结果
3.1.1 交联剂浓度
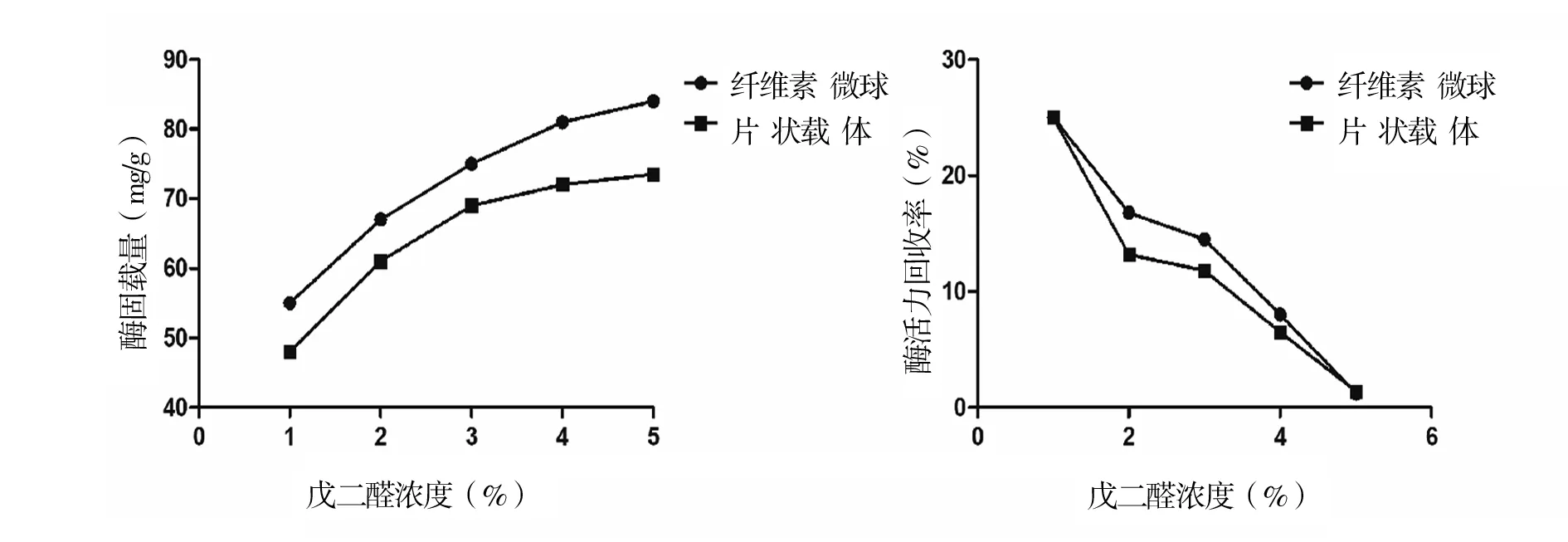
图3交联剂浓度与酶固载量图4交联剂浓度与酶活力回收率
由图3和图4试验结果可知,随戊二醛浓度升高,固定胰蛋白酶含量上升.但如果戊二醛浓度高就会影响胰蛋白酶活力回收率.在3%时固定化率较高,但胰蛋白酶活力回收率相应降低.随戊二醛浓度的升高,胰蛋白酶二级结构发生改变,导致胰蛋白酶失活.
3.1.2 交联温度
按试验方法进行交联温度选择,在10 ℃时胰蛋白酶在载体上的酶固载量为46 mg/g,但由于戊二醛分子间的交联,使得胰蛋白酶含量较低,20 ℃时提高了固定化酶上的胰蛋白酶含量,达到51 mg/g.当温度升高,胰蛋白酶固载量不再增加.
3.1.3 交联时间
由图5可以看出,随交联时间的增加,载体上的固定化胰蛋白酶含量增加,最适的交联时间为10小时,之后酶固载量增加无明显升高.原因可能与酶和载体的固定化位点达到饱和有关.
如图6所示,在胰蛋白酶含量为3%时,两种材料上的胰蛋白酶固载量接近最大值,选取3%作为最大固定化胰蛋白酶浓度.
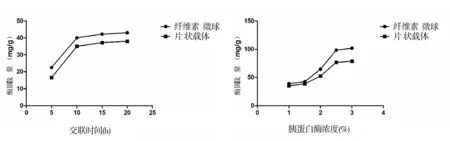
图5 交联时间对固定化酶固载量的影响 图6 不同浓度胰蛋白酶在两种载体上的固定化效果比较
3.1.4 胰蛋白酶浓度的选择
3.2 正交试验
经单因素试验确定两种材料固定化胰蛋白酶的因素水平,进行四因素三水平正交试验设计,为L9(34)(见表1),试验结果见表2及表4.
表2纤维素微球固定化胰蛋白酶正交试验结果
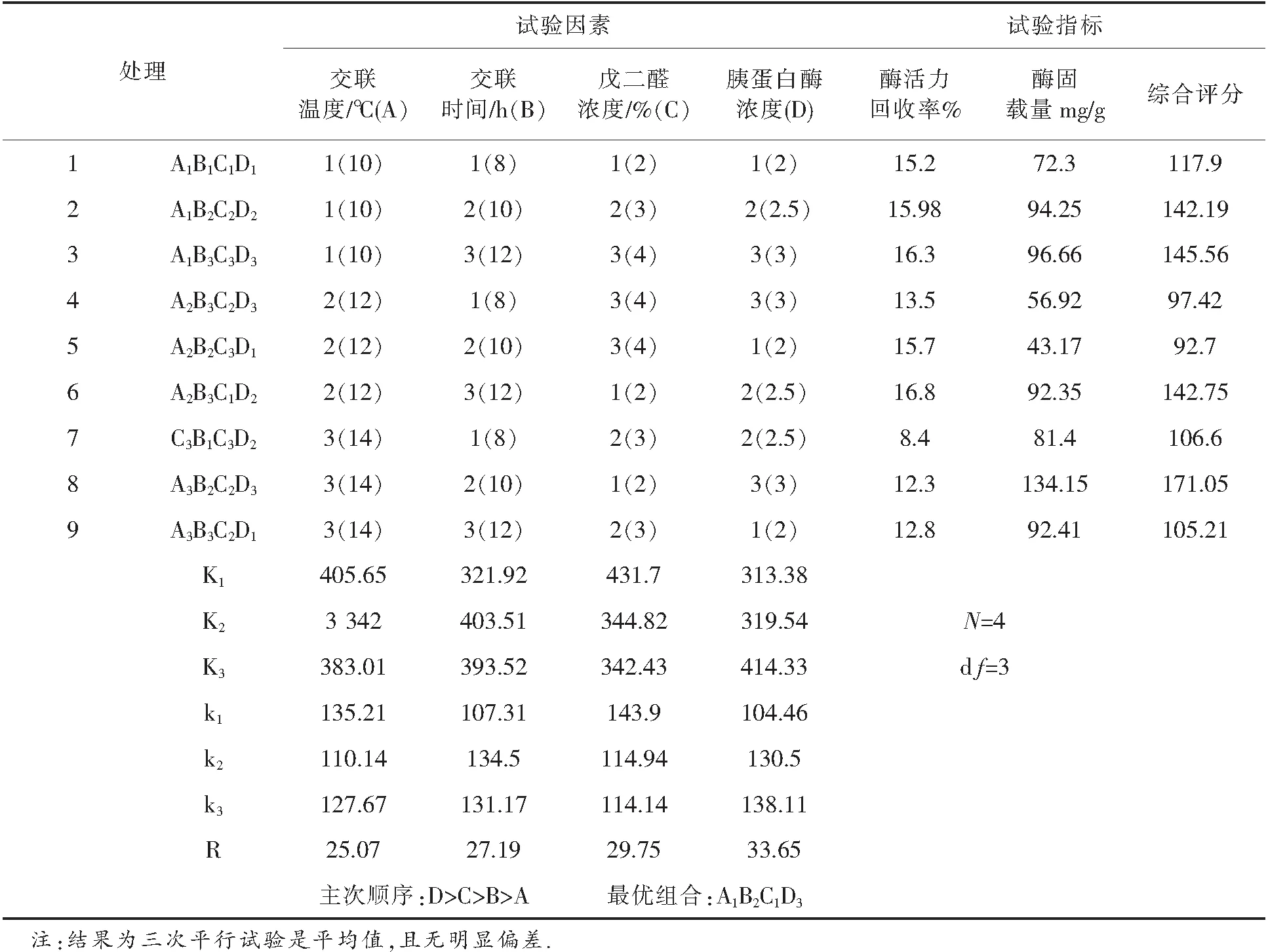
为比较四个因素对固定化胰蛋白酶制备工艺影响的大小,试验结果进行极差分析,结果表明:胰蛋白酶浓度>交联剂浓度>交联时间>交联温度.片状载体和DEAE偶联的纤维素微球的最优制备工艺为:3%的胰蛋白酶,交联时间10 h,交联温度10 ℃,2%戊二醛.在此条件下,交联制备的纤维素微球固定化胰蛋白酶,其固定化酶固载量和胰蛋白酶活力回收率达到较优.
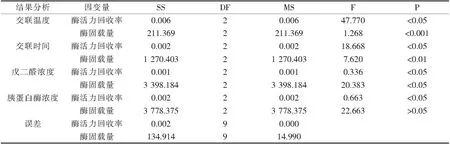
在纤维素微球固定化胰蛋白酶的试验中,经(表3)方差分析结果确定、交联时间、交联温度、交联剂浓度、胰蛋白酶浓度对酶固载量有影响.胰蛋白酶浓度对纤维素微球固定化胰蛋白酶的酶活力回收率无影响,其余3种因素对酶活力回收率均有影响.在片状载体固定化胰蛋白酶实验中,经(表5)方差分析结果确定,交联时间、交联温度、交联剂浓度、胰蛋白酶浓度对酶固载量有影响,胰蛋白酶浓度对片状载体固定化胰蛋白酶的酶活力回收率无影响,其余3种因素对酶活力回收率均有影响.
表3纤维素微球固定化胰蛋白酶方差分析表
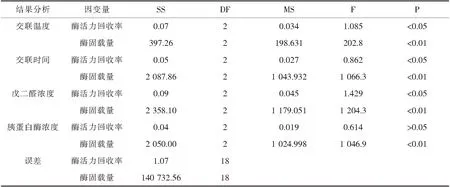
表4 纤维素微球固定化胰蛋白酶正交试验结果
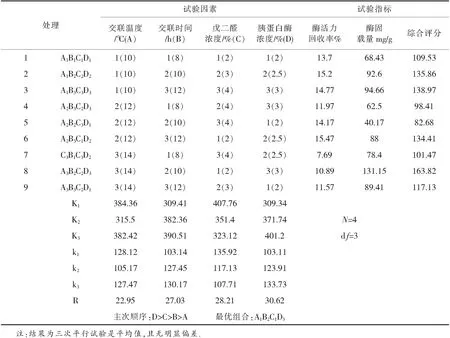
表5 纤维素微球固定化胰蛋白酶正交试验方差分析表
以较佳组合作为试验条件,以两种材料固定化胰蛋白酶,进行各组独立性重复实验(n=6).结果进行t检验,载体为DEAE偶联纤维素微球的固定化酶,其胰蛋白酶固载量为145 mg/g , 酶的活力回收率为17.3%.以片状载体固定化胰蛋白酶试验,其酶固载量为112.6 mg/g,酶的活力回收率为14%.结果进行t检验,结果表明,DEAE偶联纤维素微球的固定化酶的酶固载量显著高于片状载体固定化胰蛋白酶(P<0.05,n=6),活率回收率无显著性差异.纤维素微球作为载体酶固载量高的原因为:纤维素微球偶联DEAE获得氨基,与戊二醛发生Schiff反应产生更多的固定化位点有关,且氨基为亲水基团,可提高对胰蛋白酶的吸附能力.
3.3 稳定性
3.3.1 贮藏稳定性
较佳工艺路线制备的两种固定化胰蛋白酶,于4 ℃冷藏保存,每间隔7 d,测定OD值,计算酶固载量,并测定酶活比.结果表明,纤维素微球固定化胰蛋白酶在35 d后,酶固载量无明显下降,仍保持在98%以上,片状载体酶固载量保持在96%以上.纤维素微球固定化胰蛋白酶活力回收率降低且小于4%;片状载体酶活力回收率降低且小于6%.两种材料相比,纤维素微球作为载体固定化胰蛋白酶的储存稳定性较好.
3.3.2 操作稳定性
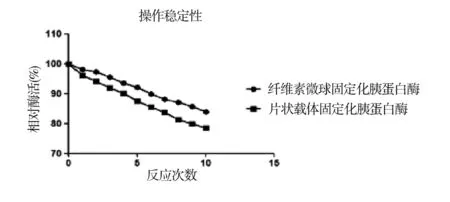
图7 两种载体固定化胰蛋白酶的操作稳定性
两种载体的固定化胰蛋白酶,连续10次反应后,测定的胰蛋白酶活结果如图7所示.纤维素微球固定化胰蛋白酶酶活基本保持稳定,活力损失小于14%,片状载体固定化胰蛋白酶的酶活降低比纤维素明显,活力损失小于22%.由此可见,两种材料的固定化胰蛋白酶都具有良好的操作稳定性,且经偶联DEAE的纤维素微球效果更佳.
4 讨论
本试验以不同载体作为固定化胰蛋白酶的材料,对两种材料固定化效果进行评价,结果表明:纤维素微球作为载体的固定化酶比片状载体效果更佳.两种材料的固定化酶种,经偶联DEAE的纤维素微球作为载体固定化胰蛋白酶,表现出酶固载量、酶活、贮存稳定性和操作稳定性都比亲水聚丙烯片状载体效果要好.本研究表明,选择亲水性生物材料更有利于固定化酶的性能,对亲水性材料进行改性,使得固定化材料获得更多与酶发生交联或偶联的位点,提高酶固载量和操作稳定性.基于本试验,我们发现,纤维素微球回收仍然有较大的困难,后期考虑加入磁粉(Fe3O4),制作带有磁性的纤维素微球作为固定化载体,可固定化某些价格高昂,难以提取的酶,以便于有效回收和重复利用.
本研究旨在对固定化胰蛋白酶材料进行探究,找到既能大量固定胰蛋白酶,又能保证酶活,既能简便回收以重复利用,又能很大程度上降低生产成本的生物材料,为今后的固定化酶材料研究提供理论依据.
