重组刚地弓形虫GRA10蛋白的表达纯化与鉴定
2018-02-08杨谌
杨谌
(长江大学动物科学学院,湖北 荆州 434025)
申邦
(农业微生物学国家重点实验室,湖北 武汉 430070;华中农业大学动物医学院,湖北 武汉 430070)
刚地弓形虫(Toxoplasmagondii)是一种呈世界性分布的专性寄生于温血动物的顶复门寄生原虫。1908年,Nicolle和Manceaux首次在刚地梳祉鼠的肝脾单核细胞中发现了弓形虫的无性生殖阶段——速殖子,根据此虫寄生的宿主名称和速殖子的形态,将其命名为“刚地弓形虫”。弓形虫专门寄生在有核细胞内,其中间宿主普遍而且无特异性,可以感染所有的哺乳动物,也包括人,引起人兽共患弓形虫病。据统计,全世界大约有25%~50%的人感染弓形虫,甚至在欧洲的一些地区,弓形虫的感染率达到80%[1]。因此,需要快速简便的检测方法用于该病的防控。
目前检测弓形虫病主要有病原学、免疫学和分子生物学诊断方法。病原学诊断方法主要有直接涂片或组织切片染色、动物接种分离弓形虫病原。免疫学方法主要有染色试验(Dye Test,TD)、间接血凝试验(Indirect Hemagglutination Test,IHA)、酶联免疫吸附试验(Enzyme Linked Immunosorbent Assay,ELISA)、间接荧光抗体试验(Indirect Fluorescent Antibody Test,IFA)、亲和素-生物素-酶联免疫吸附试验(Avidin Biotin Peroxidase Complex Enzyme Linked Immunosorbent Assay,ABC ELISA)和免疫胶体金技术(Immune Colloidal Gold,ICG)等。分子生物学诊断方法主要有聚合酶链式反应(Polymerase Chain Reaction,PCR)。总的来看,目前诊断弓形虫病的方法较多,这些传统的病原诊断方法虽然操作简单,但检出率比较低,容易漏诊。免疫学诊断方法目前主要的难题是如何区分新发感染和既往感染。PCR 技术以及在此基础上衍生出的各种新检测技术,大大提高了对弓形虫病检测的敏感性、特异性和准确性,但仍存在基层推广有一定局限性[2]。因此,急需一种既准确又简单的诊断弓形虫病的方法。
研究表明,弓形虫的多种蛋白均可刺激机体产生免疫反应。致密颗粒蛋白10(dense granule protein10,GRA10)是弓形虫致密颗粒分泌的一种蛋白,它表达量高,而且其在弓形虫缓殖子和速殖子时期均可表达。经预测,GRA10具有较好的免疫原性,所以认为GRA10是潜在的特异好的弓形虫病诊断标识。
本研究拟构建GRA10(AA 4-487)原核表达载体pE-SUMO-GRA10(AA 4-487),并对其进行诱导表达、纯化与鉴定,为将重组GRA10(AA 4-487)蛋白用于弓形虫病诊断试剂盒的开发奠定基础。
1 材料与方法
1.1 材料
DH5α克隆菌株、BL21(DE3)表达菌株、ME49型弓形虫虫株均由华中农业大学寄生虫实验室保存;PCR产物回收试剂盒、DNA凝胶回收试剂盒和小提质粒试剂盒均购自北京全式金公司;同源重组试剂盒购自南京诺唯赞公司;反转录试剂盒购自Thermo公司;His-Tag小鼠单克隆抗体购自美国Proteintech公司;Alexa488标记羊抗鼠IgG购自美国Licor公司;TRIzol购自美国Invitrogen公司;HRP标记山羊抗小鼠IgG(H+L)购自上海碧云天生物技术有限公司;其他试剂均为国产分析纯。
1.2 方法
1.2.1 引物的设计与合成
根据ToxoDB中弓形虫ME49虫株的GRA10(AA 4-487)基因设计引物,上游引物:5’-ACCGCGAACAGATTGGAGGTCTGTACTACCGGCTGAGCA-3’;下游引物:5’-TCGAATTCGGATCCTCTAGTTCACTTTCGCGAGGGTAGCATGG-3’。引物由上海生工生物工程有限公司合成。
1.2.2 GRA10(AA 4-487)基因的PCR扩增
提取弓形虫ME49株RNA然后制备弓形虫cDNA。弓形虫RNA的提取:将收集的虫体离心,弃上清,加入1mL Trizol重悬,并反复吹打混匀后将样品转入1.5mL无RNase的离心管中,剧烈震荡涡旋3min,使虫体充分裂解,室温放置10min;按200μL氯仿/mL Trizol加入氯仿,用力震荡15s,室温静置2~3min;4℃12000r/min离心15min;小心吸取上层水相置于新的1.5mL无RNase的离心管中,加入等体积的异丙醇,充分混匀后,置于室温沉淀10min;4℃12000r/min离心10min,弃去上清,RNA将以白色沉淀的形式沉于管底;加入1mL用DEPC水配成的75%乙醇,翻转离心管,洗涤沉淀;4℃7500r/min离心5min,尽量弃去上清,在超净台中风干;加入30μL无 RNase DEPC水,溶解RNA沉淀;用1%琼脂糖凝胶电泳鉴定所提取的总RNA质量并通过紫外分光光度计测定总RNA浓度和纯度。弓形虫cDNA的制备:将0.1~0.5ng总RNA和1μL Oligo(dT)18混合,再加入无核酸酶的高纯水补至12μL混合;在PCR仪中65℃反应5min,冰上冷却。取上述产物12μL,5×Reaction Buffer 4μL,RiboLockTMRNA 酶抑制剂1μL,10mmol/L dNTP Mix 2μL和RevertAidTMM-Mu LV逆转录酶1μL混合,总体积20μL;在PCR仪中42℃ 60min,70℃ 5min,产物-20℃储存。以最后产物为模板进行PCR扩增,模板1μL,5×KD plus buffer 10μL,上下游引物各1μL,2.5mmol/L dNTP 4μL,KD plus DNA聚合酶 1μL,灭菌水补至50μL。反应条件:95℃预变性3min;95℃变性30s;58℃退火30s;68℃延伸1min40s;共35个循环;68℃延伸5min。扩增产物经1.0%琼脂糖凝胶电泳鉴定。
1.2.3 GRA10(AA 4-487)基因扩增产物的回收
按照DNA琼脂糖凝胶回收试剂盒的说明进行操作。
1.2.4 同源重组构建质粒
按照诺唯赞多片段克隆试剂盒说明进行操作。
1.2.5 重组GRA10(AA 4-487)的表达鉴定
将含有pE-SUMO-GRA10(AA 4-487)质粒的BL21(DE3)表达菌接种到LB中,于37℃以180r/min震荡培养,当菌液光密度D600nm值到达0.5左右时,加入IPTG至终浓度为1mmol/L,于37℃以180r/min震荡诱导3h。收集菌液于4℃6000r/min离心12min,弃去上清,用20mL的His-binding buffer重悬,再用高压细胞破碎仪破碎。待菌液呈澄清半透明时取200μL在4℃以12000g离心10min,取上清40μL加入50μL 2×SDS上样缓冲液和10μL DTT充分混合;将上清去除后用200μL ddH2O重悬包涵体,取40μL 加入50μL 2×SDS上样缓冲液和10μL DTT充分混合;将上述2种样品沸水煮10min,冰上冷却5min然后进行SDS-PAGE凝胶电泳检测分析。
1.2.6 重组GRA10(AA 4-487)蛋白的纯化
将表达后的菌液4℃ 6000r/min离心12min,弃上清;以1/10原培养基体积的缓冲液A重悬沉淀,再用高压细胞破碎仪破碎3次;4℃12000r/min离心10min,弃上清;用PBS洗涤沉淀2~3次;往沉淀中加19.7mL缓冲液A、9.7μL 5mmol/L DTT和0.3mL 20%N-十二烷基肌氨酸钠,剧烈搅拌使其溶解,室温静置30min2h;4℃12000r/min离心20min,取上清;加入终浓度为0.2%的PEG4000,1.0mmol/L氧化性谷胱甘肽和0.2mmol/L还原性谷胱甘肽,室温静置30min~2h;将上述样品加入透析袋后用PBS透析3d,然后用蔗糖浓缩后-80℃保存。
1.2.7 重组GRA10(AA 4-487)蛋白的Western blot鉴定
将需要进行Western blot鉴定的凝胶转移到转移缓冲液中浸泡;取8张滤纸和一张硝酸纤维素膜(NC膜),将8张滤纸浸泡于转移缓冲液,将NC膜浸泡在甲醛溶液中30s后迅速用ddH2O洗5s再浸泡于转移缓冲液;用湿电转膜仪将目的蛋白从凝胶转到NC膜上。将NC膜放入小托盘中,加入封闭液(1%BSA或5%脱脂奶粉,溶于PBS),平放在平缓摇动的摇床平台上于室温震摇2h;用PBS洗涤5次,每次5min。NC膜浸泡于1︰2000稀释His-Tag的小鼠单克隆抗体的TBST溶液中,于室温平缓震摇2h;用TBST洗涤5次;浸泡于1︰10000稀释荧光羊抗鼠抗体的TBST溶液中,于室温平缓震摇2h,注意避光;用TBST洗涤5次后用仪器拍照。
NC膜浸泡于1︰500稀释感染弓形虫小鼠的阳性血清的TBST溶液中,于室温平缓震摇2h;用TBST洗涤5次;浸泡于1︰2000稀释HRP标记山羊抗小鼠IgG(H+L)的TBST溶液中,于室温平缓震摇2h;用TBST洗涤5次后加显色液用仪器拍照。
2 结果与分析
2.1 目的基因GRA10(AA 4-487)的扩增
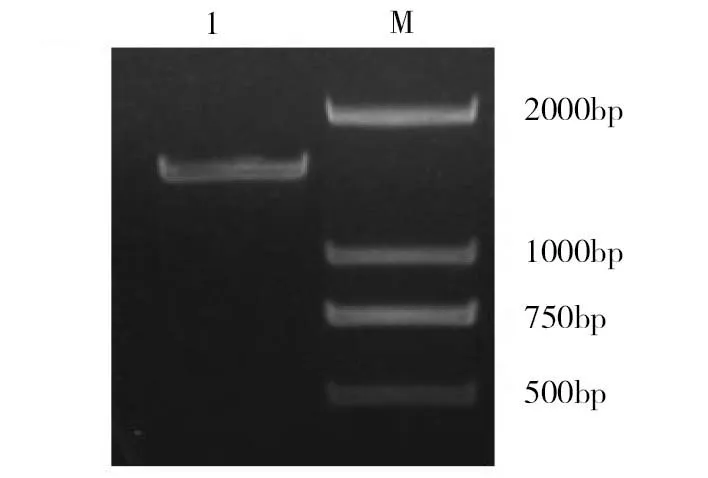
1.GRA10(AA 4-487);M.Marker图1 GRA10(AA 4-487)片段的PCR产物的琼脂糖凝胶电泳图
以弓形虫cDNA为模板扩增GRA10(AA 4-487)基因片段,经1%琼脂糖凝胶电泳鉴定扩增产物大小为1452bp(图1),与预期结果一致。
2.2 重组质粒pE-SUMO-GRA10(AA 4-487)与原载体pE-SUMO的对比鉴定
挑取阳性克隆,在含氨苄青霉素的LB过夜震摇培养后提取重组质粒,然后和原始质粒pE-SUMO经1%琼脂糖凝胶电泳对比,可见含有插入片段的阳性克隆较空载体大小增加(图2)。
2.3 重组质粒pE-SUMO-GRA10(AA 4-487)测序鉴定
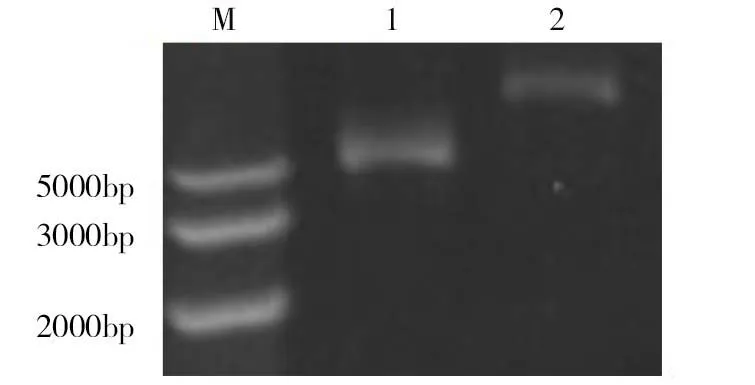
M.Marker;1.pE-SUMO;2.pE-SUMO-GRA(AA 4-487)图2 pE-SUMO与pE-SUMO-GRA(AA 4-487) 的琼脂糖凝胶电泳图
将潜在的阳性重组质粒送到上海生工生物工程技术服务有限公司测序,测序结果良好,彩图显示峰尖单一,送测的重组质粒基因序列与原始基因序列一致,pE-SUMO与GRA10(AA 4-487)接头部分正常(图3)。
2.4 融合蛋白的表达
将重组质粒的表达菌转化到E.coliBL21(DE3)后加入IPTG诱导,诱导完成后使用高压细胞破碎仪破碎,分别取上清和沉淀同时进行SDS-PAGE分析,结果见图4与图5。诱导产物主要以包涵体形式存在,分子质量约为64ku,与计算的理论分子量相符。
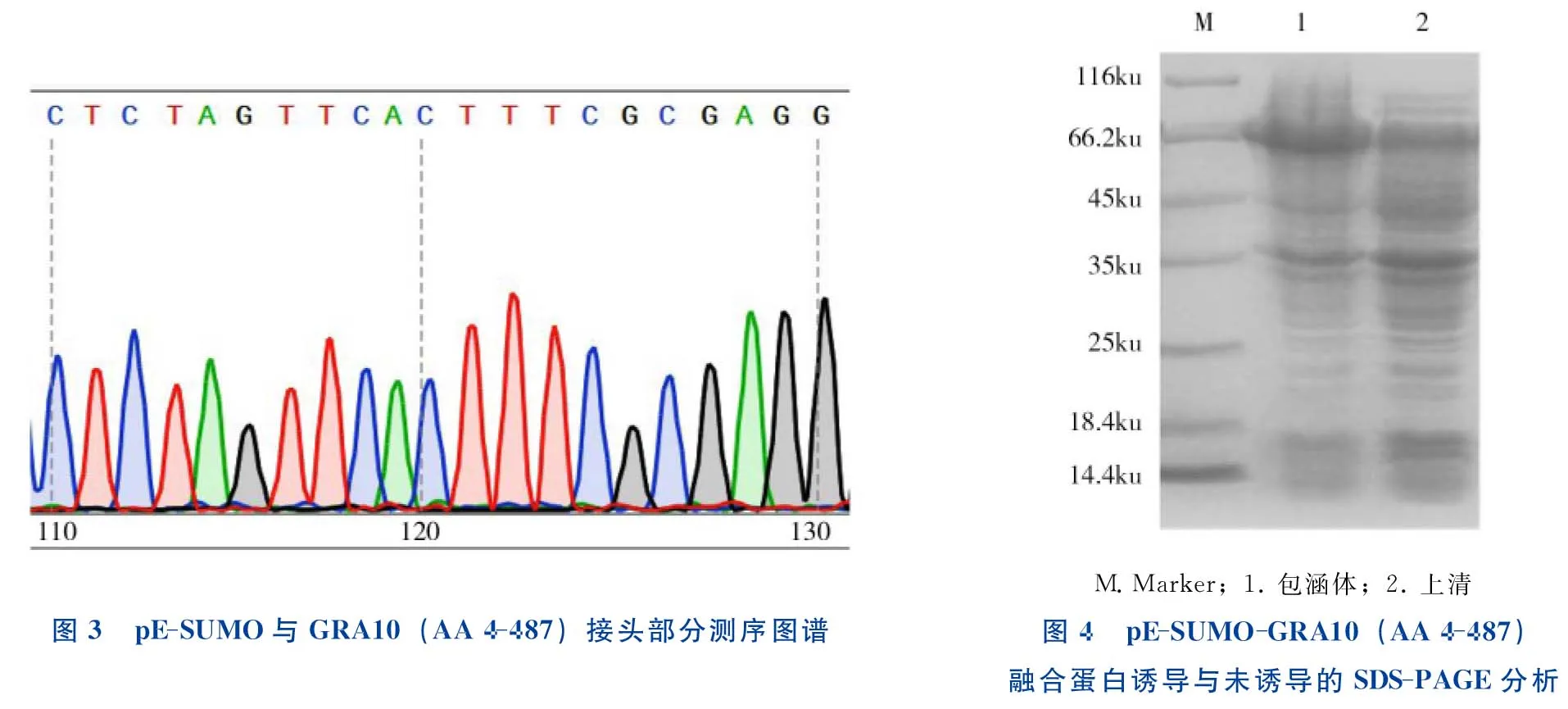
图3 pE⁃SUMO与GRA10(AA4⁃487)接头部分测序图谱M Marker;1 包涵体;2 上清图4 pE⁃SUMO⁃GRA10(AA4⁃487)融合蛋白诱导与未诱导的SDS⁃PAGE分析
2.5 融合蛋白pE-SUMO-GRA10(AA 4-487)的Western blot 鉴定
Western blot分析显示,融合蛋白pE-SUMO-GRA10(AA 4-487)能被His-Tag的小鼠单克隆抗体抗体识别(图6),说明目的蛋白能够正常表达并被识别。
Western blot分析显示,融合蛋白pE-SUMO-GRA10(AA 4-487)能被感染弓形虫小鼠阳性血清识别(图7),说明目的蛋白具有良好的免疫反应性,能被阳性血清中的抗体识别,能用于弓形虫病诊断试剂盒的开发奠定基础。

M Marker;1 包涵体;2 上清图5 pE⁃SUMO⁃GRA10(AA4⁃487)融合蛋白上清与包涵体的SDS⁃PAGE分析M 蛋白分子量标准;1重组质粒转化菌诱导3h菌液;2 重组质粒转化菌未诱导菌液;3 重组质粒转化菌诱导3h菌液高压破碎上清;4 重组质粒转化菌诱导3h菌液高压破碎沉淀图6 SUMO⁃GRA10(AA4⁃487)融合蛋白HIS标签的鉴定M 蛋白分子量标准;1 pE⁃SUMO⁃GRA10(AA4⁃487)融合蛋白;2 阴性对照图7 SUMO⁃GRA10(AA4⁃487)融合蛋白被感染弓形虫小鼠血清的识别情况
3 讨论
越来越多的研究证明弓形虫分泌细胞器分泌的致密颗粒蛋白和棒状体与调制宿主细胞内信号通路有关,导致寄生虫可以逃避宿主免疫[3~5]。弓形虫致密颗粒分泌的致密颗粒蛋白是一类重要的分泌代谢性抗原,在弓形虫病原体与宿主细胞的相互作用中起重要作用。研究证明,弓形虫致密颗粒分泌的致密颗粒蛋白即可用于弓形虫病的诊断,又对弓形虫的感染有一定的保护作用。
致密颗粒是一种弓形虫顶端复合体的细胞器,可分泌致密颗粒蛋白(dense granule proteins,GRA),其中GRA1(P24)、GRA2(P28)、GRA4(P40)、GRA6 和GRA7(P29)是5 种主要的GRA 蛋白。GRA1(P24)是慢性弓形虫病的标志性抗原分子,通过调节钙离子的浓度稳定纳虫空泡膜(parasitophorous vacuole membrane,PVM);GRA2(P28)是一个毒力相关抗原,在弓形虫入侵宿主后诱导纳虫空泡(parasitophorous vacuole,PV)表面网状结构的形成;GRA4(P40)、GRA6和GRA7(P29)在修饰调理PV的过程中起重要作用,参与PV网状结构形成,参与虫体在细胞内的存活和复制,研究发现这些分子的DNA 疫苗或重组抗原可诱导宿主产生一定的保护力,提示GRA1、GRA2、GRA4、GRA6和GRA7抗原是5个有希望的疫苗分子[6~10]。但它们产生的保护力通常较低,远远未达到人们所期望的水平,因此人们将对弓形虫的基因组学、蛋白质组学、代谢组学、转录组学以及表观遗传学进行深入研究,从而弄清弓形虫抗原的结构与功能的关系,选择更有效的候选基因或编码该基因的相关表位以及合适的表达载体,构建多价高效的复合基因疫苗或含有基因佐剂的混合基因疫苗或多表位疫苗;研究这些疫苗的转化效率、免疫原性、MHC 限制性以及能否长期在宿主体内表达[11]。
GRA10是在弓形虫高表达的保守基因。弓形虫致密颗粒蛋白在速殖子和缓殖子中大量分泌[12],在早期感染弓形虫宿主的血液中可以被发现[13],从而使致密颗粒蛋白成为有吸引力的候选疫苗。分析了弓形虫GRA10蛋白的细胞定位后发现它密集地集中在致密颗粒中,稀疏分布于弓形虫速殖子的胞浆和纳虫空泡内,但没有出现在纳虫空泡膜上[14]。这与膜的关联分析是一致的,显示了GRA10蛋白在弓形虫细胞溶解产物中而不是在膜上。纳虫空泡对弓形虫从宿主细胞中获得营养物质很重要[15],对消除弓形虫代谢废物也很重要[16,17]。
综上所述,因为弓形虫的宿主范围广泛,抗原成分复杂,导致研究进展缓慢。而致密颗粒蛋白是弓形虫的一种十分重要的蛋白,近年来的研究表明该蛋白对于弓形虫病的防治有着重要的意义。本研究利用弓形虫ME49虫株cDNA为模板扩增GRA10(AA 4-487)的编码片段,建立了重组质粒pE-SUMO-GRA10(AA 4-487),经过IPTG诱导后的表达产物能够被His-Tag的小鼠单克隆抗体抗体和感染弓形虫小鼠阳性血清识别,说明其具有免疫反应性,从而为弓形虫病诊断试剂盒的开发奠定基础。
如何有效防治弓形虫病已是现在人们必须面对的难题,但是弓形虫生活史非常复杂,所导致的机体免疫也多种多样,弓形虫病可由卵囊和包囊感染,而且其蛋白质有上千种,因此找寻到具有免疫反应性的蛋白十分重要,可以让人们进一步了解弓形虫病引起的机体免疫。本研究所构建的重组GRA10(AA 4-487)蛋白可为未来防治弓形虫病提供一定帮助,但还需要对弓形虫不同阶段、不同抗原进行更加透彻的了解,才能取得更好的疗效。
[1]于恩庶.中国弓形虫病[M].香港:亚洲医药出版社,2000.
[2]孙秀涛,谢银杰,张思东,等.免疫学与分子生物学技术在弓形虫病诊断中的研究进展[J].动物医学进展,2009,30(7):76~79.
[3]Melo M B,Jensen KD,Saeij J P.Toxoplasmagondiieffectors are master regulators of the inflammatory response[J].Trends Parasitol,2011,27:487~495.
[4] Lai B S,Mcleod R.Molecular target validation,antimicrobial delivery,and potential treatment ofToxoplasmagondiiinfections[J].Proc Natl Acad Sci USA,2012,109:14182~14187.
[5]Scorza T,Dsouza S,Laloup M,etal.A GRA1 DNA vaccine primes cytolytic CD8+ T cells to control acuteToxoplasmagondiiinfection[J].Infect Immun,2003,71:309~316.
[6]Golkar M,Shokrgozar M A,Rafati S,etal.Evaluation of protective effect of recombinant dense granule antigens GRA2 and GRA6 formulated in monophosphoryl lipid A(MPL)adjuvant against Toxoplasma chronic infection in mice[J].Vaccine,2007,25:4301~4311.
[7]林绮萍,吴少庭,翁亚彪,等.弓形虫GRA4 基因真核表达重组质粒DNA 免疫小鼠的研究[J].中国寄生虫病防治杂志,2005,18(3):180~183.
[8]Lin Q P,Wu S T,Weng Y B,etal.Study on immuno-response of recombinant plasmid pVAC containing GRA4 gene fromToxoplasmagondiiin mice[J].Chin J Parasit Dis Con,2005,18:180~183.
[9] Hiszczyńska-Sawicka E,Olędzka G,Holec-Gąsior L,etal.Evaluation of immune responses in sheep induced by DNA immunization with genes encoding GRA1,GRA4,GRA6 and GRA7 antigens ofToxoplasmagondii[J].Vet Parasitol,2011,177:281~289.
[10]Vercammen M,Scorza T,Huygen K,etal.DNA vaccination with gene encodingToxoplasmagondiiantigens,GRA1,GRA7 and ROP2 induces partially protective immunity against lethal challenge in mice[J].Infect Immun,2000,68:38~45.
[11]Zhang G,Huong V T,Battur B,etal.A Heterologous prime-boost vaccination regime using DNA and a vaccinia virus,both expressing GRA4,induced protective immunity againstToxoplasmagondiiinfection in mice[J].Parasitology,2007,134:1339~1346.
[12]Mercier C,Cesbron-Delauw M F,Ferguson D J P.Dense granules of the infectious stages ofToxoplasmagondii:their central role in the host-parasite relationship,inToxoplasma[A].Ajioka J A.Toxoplasma:molecular and cellular biology [C].Poole,UK:Horizon Bioscience Press,2007:78~100.
[13]Hughes H P,Van Knapen F.Characterization of a secretory antigen fromToxoplasmagondiiand its role in circulating antigen production[J].Int J Parasitol,1982,12:433~437.
[14]Witola W H,Bauman B,Mchugh M,etal.Silencing of GRA10 protein expression inhibitsToxoplasmagondii[J].Parasitology International,2014,63:651~658.
[15] Sinai A P,Joiner K A.Safe haven:the cell biology of non-fusogenic pathogen vacuoles[J].Annu Rev Microbiol,1997,51:415.
[16] Joiner K A.Vacuolar membranes surrounding intracellular pathogens:where do they come from and what do they do? [J].Infect Agents Dis,1993,2:215~219.
[17] Laliberte J,Carruthers V B.Host cell manipulation by the human pathogenToxoplasmagondii[J].Cell Mol Life Sci,2008,65:1900~1915.
[编辑] 余文斌
