同型产乙酸菌研究进展及其环境生物技术应用
2018-02-08杜诗云
谢 丽, 杜诗云, 卜 凡
(1. 同济大学 长江水环境教育部重点实验室, 上海 200092; 2. 同济大学 环境科学与工程学院, 上海 200092)
随着化石能源的枯竭,利用微生物合成乙酸替代部分化石能源成为许多国家可持续发展的战略目标之一.同型产乙酸菌(homoacetogen)是一类既能利用多种有机底物进行异养生长,又能利用CO2/H2或者CO自养生存的厌氧微生物类群[1].同型产乙酸菌适应不同生态环境,广泛分布在土壤、海底沉积物、厌氧污泥、污水、极地、动物瘤胃和人类肠道等不同生境中[2].此外,同型产乙酸菌还在地球碳循环中起着重要的作用,据统计,每年由同型乙酸菌合成的乙酸约2×1012kg[3].在泥炭地中,同型产乙酸菌合成的乙酸占其总产乙酸量的16%-63%[4].
随着对同型产乙酸作用理解的加深,利用同型产乙酸菌进行有机物定向发酵产酸,合成气发酵成为近年来的研究热点,其研究方向主要有机物厌氧发酵产酸、合成气厌氧发酵产酸、生物电化学系统中产酸、有机污染物代谢分解等.本文总结了一些研究较为广泛的同型产乙酸菌的类型,介绍了它们的生理生态特性,以及近年来利用同型产乙酸菌的环境生物技术研究进展.
1 同型产乙酸菌生理生态特性及其代谢途径
1.1 同型产乙酸菌生理生态特性
1936年,Wieringa从污泥中分离出第一株同型产乙酸菌株[5].至今,已有100多株同型产乙酸菌被发现[6].它们分布在不同的22个属,分别是Acetitomaculum,Acetoanaerobium,Acetobacterium,Acetohalobium,Acetonema,Bryantella,Butyribacterium,Caloramator,Clostridium,Eubacterium,Holophaga,Moorella,Natroniella,Natronincola,Oxobacter,Ruminococcus,Sporomusa,Syntrophococcus,Tindallia,Thermoacetogenium,Thermoanaerobacter和Treponema[7].不同菌属的同型产乙酸菌在形态、营养特性和生理生态特性上均有很大不同[2].
表1总结了环境生物技术领域常见的同型产乙酸菌及其生理生态特性.其中Acetobacteriumwoodii,Clostridiumljungdahlii和Moorellathermoacetica,是目前研究有关同型产乙酸菌代谢途径的典型菌种[8].大部分菌株为革兰氏阳性菌,分布在Acetobacterium、Clostridium,Moorella以及Sporomusa四个属.Acetobacterium中的所有菌均为产酸菌,第一株被发现的产乙酸菌Acetobacteriumwoodii呈革兰氏阳性且不产生孢子[8].20世纪80年代Clostridium菌属被广泛应用于合成气厌氧发酵.与Acetobacterium不同,Clostridium中除含有产乙酸菌外,也包含非产乙酸菌种[8].Clostridiumljungdahlii是一个典型的产乙酸菌种,也可以发酵合成乙醇[15].其命名也是为了感谢Lars G Ljungdahl教授对梭菌和产酸菌研究所做出的贡献.大部分的同型产乙酸菌为适温型(20°C~39°C),但是Moorella属却为嗜热菌群,其适应温度范围可达40℃~70℃.由于Moorellathermoacetica包含了进行乙酰辅酶A途径所需要的所有酶,因此数十年来被作为生物化学研究的典型产酸菌种[8].
从表中还可以看出,大部分同型产乙酸菌的适宜pH为5~8,但菌种Moorellathermoautotrophica却能在pH为4.5的条件下生存.大部分同型产乙酸菌的代谢产物为乙酸、乙醇,但某些菌种例如Butyribacteriummethylotrophicum、Clostridiumscatologenes、Eubacteriumlimosum也被发现在适宜条件下可以生成丁酸、丁醇等更长链的有机物.
1.2 同型产乙酸菌代谢途径
同型产乙酸菌可以利用CO2和H2自养生存(反应1),也能以葡萄糖为底物异养生存(反应2),但是都需要通过厌氧乙酰辅酶A途径,以CO2作为电子受体,产生相应的能量和生物量[9].
2CO2+4H2→CH3COOH+2H2O, ΔG0'=-95 kJ·mol-1
(1)
C6H12O6→3CH3COO-+3H+, ΔG0'=-310.9 kJ·mol-1
(2)
本文将以Clostridiumljungdahlii为例(图1),对这两个途径进行简要阐述.图1中,反应物的缩写词:Acetate-P为乙酸磷酸盐; CoA为辅酶A; CoFeSP为钴铁硫蛋白; THF为四氢叶酸; Fdxox为氧化的铁氧化还原蛋白; Fdxred为还原的铁氧化还原蛋白; Pyr为丙酮酸; Pep为磷酸烯醇式丙酮酸; 2PG为2 -磷酸甘油酸; 3PG为3-磷酸甘油酸; 1,3-DPG为1,3 -二磷酸甘油酸; DHAP为磷酸二羟丙酮; Gly-3P为甘油3磷酸; Fru-1,6P为1,6-二磷酸果糖; Fru-6P为6-磷酸果糖; Glc-6P为6-磷酸葡萄糖; Glc为葡萄糖; Fru-1P为1-磷酸果糖; Pyr为丙酮酸; Pep为磷酸烯醇式丙酮酸; Fru为果糖.酶的缩写词:ACK为乙酸激酶; PTA为磷酸转乙酰酶; MET为甲基转移酶; MTHFR为亚甲基四氢叶酸还原酶; MTHFD为亚甲基四氢叶酸脱氢酶; MTHFC为亚甲基四氢叶酸环化水解酶; FTHFS为甲酰四氢叶酸合成酶; FDH为甲酸脱氢酶; CODH/ ACS为一氧化碳脱氢酶/乙酰辅酶A合成酶; PFOR为丙酮酸铁氧还蛋白氧化还原酶; PYK为丙酮酸激酶; ENO为烯醇化酶; PGM为磷酸甘油酸变位酶; PGK为磷酸甘油酸激酶; GAPDH,甘油醛-3-磷酸脱氢酶; TPI为磷酸丙糖异构酶; FBA为果糖二磷酸醛缩酶; FRUK为果糖激酶; PFK为磷酸果糖激酶; PGI为磷酸葡萄糖异构酶; HEX为己糖激酶; FRUpts为果糖磷酸转移酶系统.化学计量显示代表单一甘油3磷酸的分子转化,因此只有显示了糖酵解生成量的一半.

图1 Clostridium ljungdahlii 自养与异养代谢途径机理[16]
图1左边部分为自养反应途径(还原乙酰辅酶A途径),右边部分为异养反应途径(糖酵解途径),中间部分为两反应生成的乙酰辅酶A及其部分末端代谢产物.图中还标记了反应途径中所涉及的如NADPH、铁氧化还原蛋白等辅因子的氧化还原反应,能量的生成与消耗及一些参与反应的酶.
自养反应途径由两个分支组成,甲基分支(Methyl branch)与羰基分支(Carbonyl branch),也称为东分支(eastern branch)和西分支(western branch)[17](见图1左半部分).这两个分支可分别以CO2或CO为底物,在一氧化碳脱氢酶(CODH)等酶的作用下生成甲基和羰基,合成乙酰辅酶A[18-19].生成的乙酰辅酶A则紧接着被转化成细胞物质或者生成乙酸、乙醇等产物.
在异养反应途径中,果糖(FRU)与葡萄糖(GLU)进入细胞后,首先进行磷酸化过程,逐步转化生成1-6 二磷酸果糖、丙酮酸,最后生成乙酰辅酶A和CO2,生成的CO2又可以进入自养途径进行进一步的降解.除果糖和葡萄糖外,甲酸、甲醇、乙醇、丙二醇、乙二醇、丁二醇、丙酮酸、己糖、戊糖、草酸、乙醛酸等同样可以作为同型产乙酸菌生长代谢的有机底物,但不同菌种的可利用底物可能会存在一定差异[8].
1.3 末端代谢产物

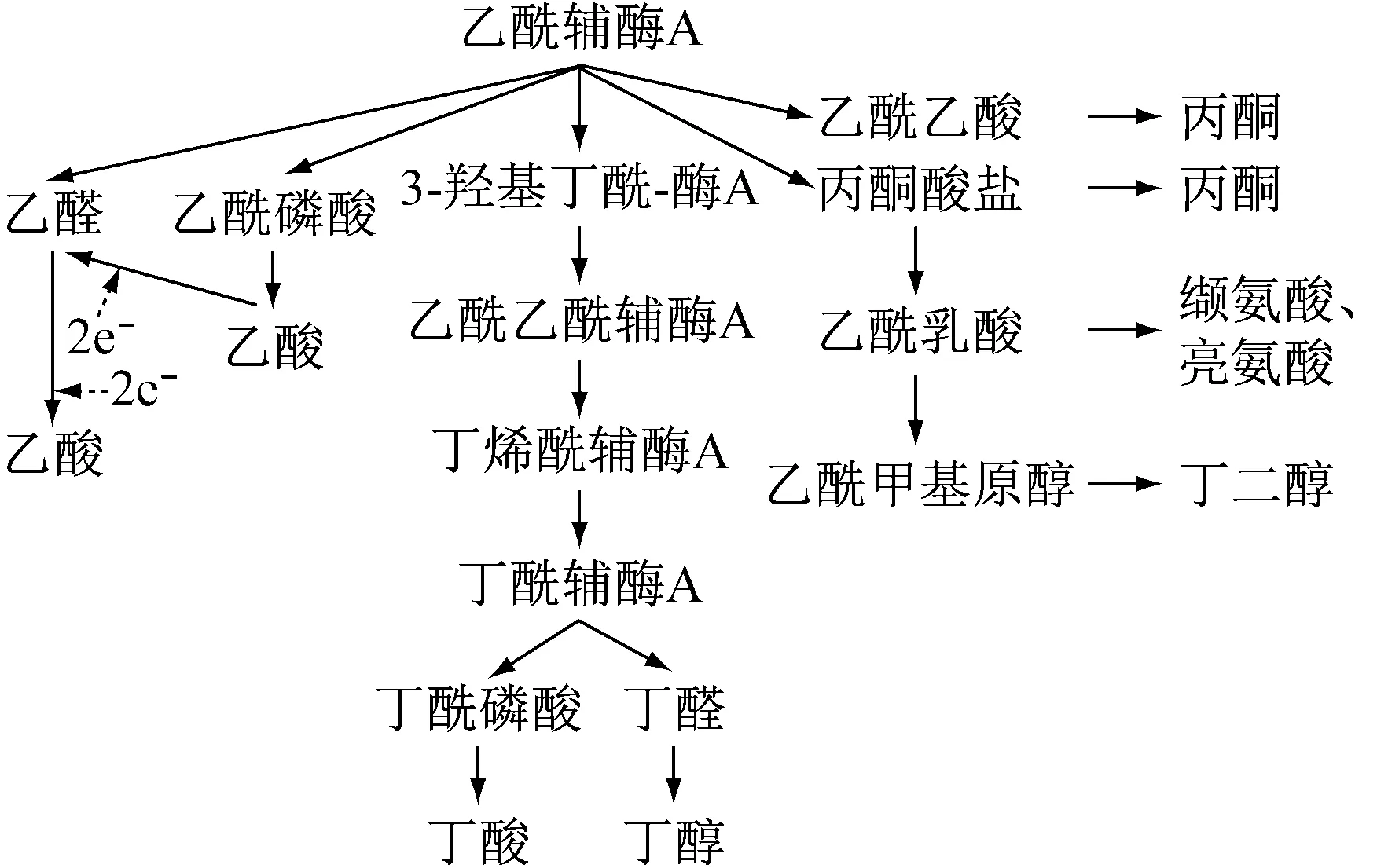
图2 乙酰辅酶A途径末端代谢产物[19-20]
2 同型产乙酸菌在环境生物技术中的应用
随着对同型产乙酸作用了解的深入,利用同型产乙酸菌对污染物进行降解和资源化利用成为近年来研究的热点.利用同型产乙酸菌进行有机质以及合成气的厌氧发酵产酸,主要是将同型产乙酸菌应用在有机废水与污泥或废气的处理当中,不仅可以提高系统中有机物转化效率和乙酸产率,还在废物减量化的同时实现了资源化.此外,还可将同型产乙酸菌应用在含有硝基的环烃类污染物的降解中,为同类型污染物的微生物降解途径提供了新思路.
2.1 同型产乙酸菌利用有机物厌氧发酵定向产酸
有机物厌氧消化主要可以分为水解酸化、产氢产乙酸和产甲烷三个阶段.在产酸过程中,同型产乙酸菌不仅可以通过降低系统中H2和CO2的分压来减轻其对产氢产乙酸菌的抑制,还可以提高系统中的总产酸量[21].
基于同型产乙酸菌的代谢特点以及在有机质厌氧消化过程中的作用,国内江南大学刘和教授课题组深入研究了其在污泥厌氧发酵产酸的促进作用.利用同型产乙酸菌的耗氢性能,构建产氢产酸/同型产乙酸两相耦合工艺,可将系统厌氧发酵产酸率提高29%-87%[21].此外,向有机废水厌氧发酵系统中接种富集同型产乙酸菌后的污泥可使其产酸率提高38%,若向此系统中额外充入CO2,其产酸率将进一步提高至原系统的1.77倍[22].为了更好地利用污
泥厌氧发酵产酸过程中的混合菌群,王晋等考察了该过程中微生物的种群生态及其互营关系,研究发现,在抑制甲烷生成的情况下,同型产乙酸过程对产氢产乙酸过程起促进作用,且二者互营将产生更多的乙酸;该研究还进一步探究了种泥浓度、底物浓度、pH等工艺条件对同型产乙酸作用的影响,并对强化同型产乙酸作用后的厌氧产酸发酵构建了动力学模型[7].为进一步明晰不同生境微生物利用合成气发酵的潜力,刘和教授课题组还对不同来源污泥(剩余污泥、牛粪、产甲烷污泥和河道底物样品)进行了同型产乙酸菌的富集以及培养,结果表明不同来源污泥的产酸情况以及微生物的组成都不尽相同,证明同型产乙酸菌的丰富度和数量两个因素都对复杂微生物群落转化H2/CO2产乙酸效率至关重要[23].此外,哈尔滨工业大学李建政教授课题组也致力于探究同型产乙酸菌在厌氧生物系统中的作用,对以H2/CO2为气体底物富集分离纯化得到的同型产乙酸菌开展了生理生态特性及代谢特性研究[24].
2.2 合成气(syngas)厌氧发酵
合成气是一种可以通过热解或气化石油、煤炭、生物质以及含有木质纤维素的有机废物等得到的以CO、CO2、H2为主的混合气体[25].合成气微生物发酵主要指利用微生物将合成气转化为可利用烃类的过程[26].目前研究发现的能以合成气为唯一碳源和能源的微生物均为厌氧微生物,以产乙酸菌居多[27].根据同型产乙酸菌可利用CO2和H2生成乙酸的这一代谢特性,已有部分科研工作者对其在有关于合成气资源化过程中的应用以及效率提升等方面进行了探究.
在有关微生物合成气厌氧发酵的研究中,梭菌属为常见菌属,如Clostridiumljungdahlii,Clostridiumautoethanogenum,Clostridiumragsdalei(P11)等.Younesi等表明,Clostridiumljungdahlii在其最适生长温度(37℃)下,气体总压力为1.4 atm时可达最优产乙酸量1.3 g·L-1,气体总压力为1.6 atm时可达最优产乙醇量0.6 g·L-1[24].为提高Clostridiumljungdahlii在合成气发酵中的产量,Kim等通过向基质中投加改性硅纳米颗粒,增加了气液传质效率,将系统中乙酸与乙醇产量分别提高了166.1%与29.1%[28].此外,Cotter等人发现在最优气体流速的情况下(10 mL·min-1)进行合成气厌氧发酵,Clostridiumljungdahlii与Clostridiumautoethanogenum的乙酸产量分别可达42 m mol·L-1与25 m mol·L-1,而乙醇的产量则分别为4 m mol·L-1及1.4 m mol·L-1[29].Abubackar等表明,当pH=4.75,以CO作为底物时,向培养基中添加钨,可以使Clostridiumautoethanogenum乙醇产量达到867 mg·L-1[30].Clostridiumragsdalei(P11)则是经常被Saxena等作为探究微量元素对同型产乙酸菌利用合成气发酵的研究对象,当培养基中的Zn2+由6.96 μ mol·L-1提高到34.8 μ mol·L-1时,其乙醇产量可由35 m mol·L-1提高到188 m mol·L-1[31].
虽然目前针对利用合成气厌氧发酵的研究菌种大多为纯菌,由于纯菌的培养条件较为严格,不适于大规模工业应用,近年来研究热点已逐步转向混菌.Liu等发现,相比于只利用AlkalibaculumbacchistrainCP15纯菌,主要由CP15(56%)与Clostridiumpropionicum(34%) 构成的混合菌群更有利于合成气的转化与醇类的生成,在连续发酵过程中,其乙醇、丙醇与丁醇的产量分别可达到8、6与1 g·L-1[32].Liu等在后续研究中还表明,在间歇实验中,此类混菌的醇类产量比AlkalibaculumCP15纯菌高出60%,且在向培养基中投加丙酸、丁酸、己酸时,酸的转化率比纯菌高出50%[33].此外,Zhang等利用中空纤维膜反应器进行了合成气(H2与CO2的体积之比为60∶40)混菌发酵,结果表明,当pH=6.0, 膜面积为0.11m2时,反应器中的氢气得以完全地利用,代谢产物如乙酸、丁酸、己酸和辛酸的最高浓度分别可达7.4、1.8、0.98和0.42 g·L-1,微生物分析结果进一步表明Clostridiumljungdahlii与Clostridiumkluyveri为反应的主要菌群,占混菌的67.1%[34].而当中空纤维膜的膜面积扩大至0.28 m2,pH控制在4.5~4.8之间时,混菌的最高产乙酸量可达12.5 g·L-1,同型产乙酸菌Clostridiumljungdahlii仍为优势菌种,所占比例达到65.9%[35].
2.3 同型产乙酸菌在生物电化学系统中的应用(微生物电合成,Microbial electrosynthesis)
部分同型产乙酸菌除了可以利用H2还原CO2,还可以依靠来自电极的电子将CO2转化为多碳有机酸,例如Sporomusaovata、Clostridiumljungdahlii、Clostridiumaceticum和Moorellathermoacetica[36-37].同型产乙酸菌在生物电合成方面的应用也逐步开始受到关注.
美国南卡医科大学的Marshall利用含有产甲烷菌和产乙酸菌的混菌进行了为期90 d的生物电合成,在以CO2为唯一碳源的情况下,回收乙酸的同时也回收了甲烷,其产率分别可达到4 m mol·L-1·d-1与7 m mol·L-1·d-1[38].之后,为了进一步探究生物电合成的商业化可行性,Marshall将培养时间延长至150 d,乙酸的产率最大可达到17.25 m mol·L-1·d-1,证明了其具有一定的生物持久性与产品生成的长久性,具有进一步扩大培养的可能[39].国内中科院成都生物研究所通过生物电合成富集了含有同型产乙酸菌的功能性混合菌群,研究表明,该菌群可以通过电极直接传递或利用电极电子转化的氢气两种方式获得电子,向系统通入纯CO2的同时产生了甲烷和乙酸[40].之后,该研究所还富集了可以通过生物电合成来还原CO2生成乙酸和丁酸的混合菌群,PCR-DGGE结果分析表明该混菌含有Acetobacteriumwoodii[41].为了进一步探究同型产乙酸菌在生物电合成产酸过程中的作用,2015年印度研究者Modestra等人利用H2和CO2将富集的同型产乙酸菌群与未抑制产甲烷菌的混菌分别作为生物电化学系统(BES)中的阴极,实验结果表明富集的同型产乙酸菌群的产酸效果更好,最大产酸量可达到3 500 mg·L-1,而对照组只有1 200 mg·L-1[42].
2.4 有机污染物代谢分解
除2.1~2.3节比较热门的研究方向外,同型产乙酸菌还曾被发现可以用于降解含有硝基的环烃类污染物,但其作用机理并不明确.2000年,Huang等发现同型产乙酸菌Clostridiumthermoaceticum的CODH可以使2,4,6-三硝基甲苯 (TNT)得以降解,且氰化物的添加可以通过抑制CODH的活性,抑制TNT的转化[43].Adrian等在2004年研究表明,同型产乙酸菌StrainHAAP-1在以H2和CO2(体积比80∶20)为气体底物的情况下,在14 d内可以降解29.0 μ mol·L-1的三亚甲基三硝胺 (RDX)并且产生14 m mol·L-1的乙酸[44].此外,Sherburne等则发现当不添加酵母膏、果糖以及铵盐的情况下,同型产乙酸菌Acetobacteriumpaludosum可以促进RDX的开环转化,且其降解速率达到最大[45].
3 结论与展望
同型产乙酸菌作为参与厌氧消化的主要微生物类群之一,在环境生物技术领域发挥着不可忽视的作用.
(1) 同型产乙酸菌所产生的乙酸或者更长链的酸或醇可以被用来作为化工原料或者燃料,随着能源消耗的增加,充分利用同型产乙酸菌的代谢特点对废弃有机质与气体的资源化有着重要的意义.
(2) 在微生物合成气发酵的过程中,由于合成气通常温度较高,若利用适温菌进行发酵还需要降温措施,但如果能利用Moorella这类嗜热菌属同型产乙酸菌,这一问题就能得到更好的解决,但菌属的筛选与反应条件的控制仍然需要进一步的研究[13].
(3) 除合成气以外,若能将同型产乙酸菌应用在转化其他物质分解生成的CO2等方面,将对减少温室气体的排放与减缓气候变暖有着重要意义.
(4) 目前对于同型产乙酸菌的研究已经开始由纯菌逐步向混菌转变,混菌发酵因其不需要严格的无菌培养、对环境适应能力更强,并且微生物之间存在共发酵的协同作用而更适用于工业应用[46].随着对同型产乙酸菌以及相关菌群的作用机制了解得更加深入,加强同型产乙酸菌在微生物发酵之中的应用,将为同型产乙酸菌投入污染治理与工业生产奠定良好的基础.
[1] RYAN P, FORBES C, COLLERAN E. Investigation of the diversity of homoacetogenic bacteria in mesophilic and thermophilic anaerobic sludges using the formyltetrahydrofolate synthetase gene[J]. Water Science & Technology, 2008, 57(5): 675.
[2] DRAKE H L, GÖΒNER A S, DANIEL S L. Old acetogens, new Light[J]. Annals of the New York Academy of Sciences, 2008, 1125(1): 100.
[3] 郭蔚,刘成,邹少兰,等. 同型乙酸菌研究进展及应用前景[J]. 应用与环境生物学报, 2006, 12(6): 874.
GUO Wei, LIU Cheng, Zou Shaolan,etal. Progress in research and application of homoacetogen[J]. Chinese Journal of Applied and Environmental Biology, 2006, 12(6): 874.
[4] YE R, JIN Q, Bohannan B,etal. Homoacetogenesis: A potentially underappreciated carbon pathway in peatlands[J]. Soil Biology and Biochemistry, 2014, 68(1): 385.
[5] WIERINGA. Over het verdwijnen van waterstof en koolzuur onder anaerobe voorwaarden[J]. Antonie Van Leeuwenhoek, 1936, 1-4(3): 263.
[6] SCHUCHMANN K, MÜLLER V. Autotrophy at the thermodynamic limit of life: a model for energy conservation in acetogenic bacteria[J]. Nature Reviews Microbiology, 2014, 12(12): 809.
[7] 王晋. 厌氧发酵产酸微生物种群生态及互营关系研究[D]. 无锡:江南大学, 2013.
WANG Jin. Research of microbial community ecology and the trophic link during acidogenic fermentation[D]. Wuxi:Jiang Nan University, 2013.
[8] SCHUCHMANN K, MÜLLER V. Autotrophy at the thermodynamic limit of life: a model for energy conservation in acetogenic bacteria[J]. Nature Reviews Microbiology, 2014, 12(12): 809.
[9] 尤立剑. 同型产乙酸菌的分离纯化及生理生态研究[D]. 哈尔滨:哈尔滨工业大学市政环境工程学院, 2013.
YOU Lijian. Isolation of homoacetogenic bacteria and research on their ecophysiology[D]. Harbin:Harbin Institute of Technology, 2013.
[10] DRAKE H L, GÖBNER A S, DANIEL S L. Old acetogens, new light[J]. Annals of the New York Academy of Sciences, 2008, 1125(1): 100.
[11] MUNASINGHE P C, KHANAL S K. Biomass-derived syngas fermentation into biofuels: opportunities and challenges[J]. Bioresource Technology, 2010, 101(13): 5013.
[12] KÖPKE M, MIHALCEA C, BROMLEY J C,etal. Fermentative production of ethanol from carbon monoxide [J]. Current Opinion in Biotechnology, 2011, 22(3): 320.
[13] MOHAMMADI M, NAJAFPOUR G D, YOUNESI H,etal. Bioconversion of synthesis gas to second generation biofuels: a review[J]. Renewable and Sustainable Energy Reviews, 2011, 15(9): 4255.
[14] DRZYZGA O, REVELLES O, DURANTE-RODRIGUEZ G,etal. New challenges for syngas fermentation: towards production of biopolymers[J]. Journal of Chemical Technology & Biotechnology, 2015, 90(10): 1735.
[15] TANNER R S, MILLER L M, YANG D.Clostridiumljungdahliisp. nov., an acetogenic species in clostridial rRNA homology group I[J]. International Journal of Systematic Bacteriology, 1993, 43(43): 232.
[16] LATIF H, ZEIDAN A A, NIELSEN A T,etal. Trash to treasure: production of biofuels and commodity chemicals via syngas fermenting microorganisms[J]. Current Opinion in Biotechnology, 2014, 27(6): 79.
[17] 徐惠娟,许敬亮,郭颖,等. 合成气厌氧发酵生产有机酸和醇的研究进展[J]. 中国生物工程杂志, 2010,30(3): 112.
XU Huijuan, XU Jingliang, GUO Ying,etal. Research Progress on Synthesis of organic acids and alcohols by syngas anaerobic fermentation[J]. China Biotechnology, 2010, 30 (3) : 112.
[18] ABUBACKAR H N, VEIGA M C, KENNES C. Biological conversion of carbon monoxide: rich syngas or waste gases to bioethanol [J]. Biofuels, Bioproducts and Biorefining, 2011, 1(5): 93.
[19] BENGELSDORF F R, STRAUB M, DURRE P. Bacterial synthesis gas (syngas) fermentation[J]. Environmental Technology, 2013, 34(13-16): 1639.
[20] HURST K M, LEWIS R S. Carbon monoxide partial pressure effects on the metabolic process of syngas fermentation[J]. Biochemical Engineering Journal, 2010, 48(2): 159.
[21] 聂艳秋. 废水产氢产酸/同型产乙酸耦合系统厌氧发酵产酸工艺及条件优化[D]. 无锡:江南大学, 2007.
NIE Yanqiu. Development of an acidogenesis and homoacetogenesis coupling system for wastewater anaerobic fermentation and its conditions optimization[D]. Wuxi:Jiang Nan University, 2007.
[22] 马琳. 厌氧消化反应器中同型产乙酸菌产乙酸机制研究[D]. 无锡:江南大学, 2012.
MA Lin. Mechanism of acetate production by homoacetogens in anaerobic digester[D]. Wuxi:Jiang Nan University, 2012.
[23] 田淼,张丽娟,符波,等. 不同生境微生物转化H2/CO2产乙酸及其在合成气发酵中应用[J].微生物学通报,2017,44(7):1563.
TIAN Miao,ZHANG Lijuan,FU Bo,etal. Acetate production from H2/CO2by mixed cultures from diverse ecosystems and their application for syngas fermentation[J]. Microbiology China,2017,44(7):1563.
[24] 李建政,尤立剑,刘崇,等. 同型产乙酸菌株CA3及其发酵葡萄糖产乙酸条件优化[J]. 科技导报, 2013(31): 20.
LI Jianzheng, YOU Lijian, LIU Chong,etal. HomoacetogenicStrainCA3 and Its Optimization Condition for Acetate Yield from Glucose by Fermentation[J]. Science & Technology Review, 2013(31): 20.
[25] YOUNESI H, NAJAFPOUR G, MOHAMED A R. Ethanol and acetate production from synthesis gas via fermentation processes using anaerobic bacterium,Clostridiumljungdahlii[J]. Biochemical Engineering Journal, 2005, 27(2): 110.
[26] DANIELL J, KÖPKE M, SIMPSON S. Commercial biomass syngas fermentation[J]. Energies, 2012, 5(12): 5372.
[27] DRZYZGA O, REVELLES O, DURANTE-RODRIGUEZ G,etal. New challenges for syngas fermentation: towards production of biopolymers[J]. Journal of Chemical Technology & Biotechnology, 2015, 90(10): 1735.
[28] KIM Y, PARK S E, LEE H,etal. Enhancement of bioethanol production in syngas fermentation withClostridiumljungdahliiusing nanoparticles[J]. Bioresource Technology, 2014, 159(5): 446.
[29] COTTER J L, CHINN M S, GRUNDEN A M. Influence of process parameters on growth ofClostridiumljungdahliiandClostridiumautoethanogenumon synthesis gas[J]. Enzyme and Microbial Technology,2009,44(5):281.
[30] ABUBACKAR H N, VEIGA M C, KENNES C. Carbon monoxide fermentation to ethanol byClostridiumautoethanogenumin a bioreactor with no accumulation of acetic acid[J]. Bioresource Technology, 2015, 186: 122.
[31] SAXENA J, TANNER R S. Effect of trace metals on ethanol production from synthesis gas by the ethanologenic acetogen,Clostridiumragsdalei[J]. Journal of Industrial Microbiology & Biotechnology, 2011, 38(4): 513.
[32] LIU K, ATIYEH H K, STEVENSON B S,etal. Continuous syngas fermentation for the production of ethanol, n-propanol and n-butanol[J]. Bioresource Technology, 2014, 151(1): 69.
[33] LIU K, ATIYEH H K, STEVENSON B S,etal. Mixed culture syngas fermentation and conversion of carboxylic acids into alcohols[J]. Bioresource Technology, 2014, 152(1): 337.
[34] ZHANG F, DING J, ZHANG Y,etal. Fatty acids production from hydrogen and carbon dioxide by mixed culture in the membrane biofilm reactor[J]. Water Research, 2013, 47(16): 6122.
[35] ZHANG F, DING J, SHEN N,etal. In situ hydrogen utilization for high fraction acetate production in mixed culture hollow-fiber membrane biofilm reactor[J]. Applied Microbiology and Biotechnology, 2013, 97(23): 10233.
[36] NEVIN K P, WOODARD T L, FRANKS A E,etal. Microbial electrosynthesis: feeding microbes electricity to convert carbon dioxide and water to multicarbon extracellular organic compounds[J]. Mbio. 2010, 2(1): 542.
[37] NEVIN K P, HENSLEY S A, FRANKS A E,etal. Electrosynthesis of organic compounds from carbon dioxide Is catalyzed by a diversity of acetogenic microorganisms[J]. Applied and Environmental Microbiology, 2011, 77(9): 2882.
[38] MARSHALL C W, ROSS D E, FICHOT E B,etal. Electrosynthesis of commodity chemicals by an autotrophic microbial community[J]. Applied and Environmental Microbiology, 2012, 78(23): 8412.
[39] MARSHALL C W, ROSS D E, FICHOT E B,etal. Long-term operation of microbial electrosynthesis systems improves acetate production by autotrophic microbiomes[J]. Environmental Science & Technology, 2013, 47(11): 6023.
[40] 蒋永,苏敏,张尧. 生物电化学系统还原二氧化碳同时合成甲烷和乙酸[J]. 应用与环境生物学报. 2013, 5: 833.
JIANG Yong, SU Min, ZHANG Yao. Simultaneous production of methane and acetate from carbon dioxide with bioelectrochemical systems[J]. Chinese Journal of Applied and Environmental Biology, 2013, 19(5): 833.
[41] 张尧,张闻杰,蒋永,等. 生物电化学系统固定二氧化碳同时产生乙酸和丁酸[J]. 应用与环境生物学报, 2014(2): 174.
ZHANG Yao, ZHANG Wenjie, JIANG Yong,etal. Simultaneous microbial electrosynthesis of acetate and butyrate from carbondioxide in bioelectrochemical systems [J]. Chinese Journal of Applied and Environmental Biology, 2014(2): 174.
[42] Modestra J A, Navaneeth B, Mohan S V. Bio-electrocatalytic reduction of CO2: Enrichment of homoacetogens and pH optimization towards enhancement of carboxylic acids biosynthesis[J]. Journal of CO2Utilization, 2015, 10: 78.
[43] HUANG S, LINDAHL P A, WANG C,etal. 2,4,6-Trinitrotoluene Reduction by Carbon Monoxide Dehydrogenase fromClostridiumthermoaceticum[J]. Applied And Environmental Microbiology, 2000,66(4):1474.
[44] ADRIAN N R, ARNETT C M. Anaerobic Biodegradation of Hexahydro-1,3,5-trinitro-1,3,5-triazine (RDX) by Acetobacterium malicumStrainHAAP-1 Isolated from a Methanogenic mixed culture[J]. Current Microbiology, 2004,48(5):332.
[45] SHERBURNE L A, SHROUT J D, ALVAREZ P J J. Hexahydro-1,3,5-trinitro-1,3,5-triazine (RDX) degradation by Acetobacterium paludosum[J]. Biodegradation, 2005,16(6):539.
[46] DRZYZGA O, REVELLES O, DURANTE-RODRIGUEZ G,etal. New challenges for syngas fermentation: towards production of biopolymers[J]. Journal of Chemical Technology & Biotechnology, 2015, 90(10): 1735.
