11种金花茶组植物叶片活性成分含量对比
2018-01-30黄晓露梁晓静韦晓娟李开祥马锦林
王 坤,黄晓露,梁晓静,韦晓娟,李开祥,马锦林
(广西林业科学研究院 广西特色经济林培育与利用重点实验室,广西 南宁 530002)
金花茶Camellia nitidissima属山茶科Theaceae山茶属Camellia金花茶组C. sect. Chrysantha植物[1],是世界珍稀植物[2],其花色金黄,莹润夺目,在山茶科植物中独树一色,具有极高的观赏性以及极大的市场开发潜力[3]。自20世纪60年代初在广西南宁首次被发现以来,轰动了世界园艺界和植物界,在国际上负有盛名,与银杉、桫椤、珙桐等“植物活化石”齐名,属《濒危野生动植物种国际贸易公约》附录Ⅱ中的植物种,被誉为“植物界大熊猫”[1],被国内外广大园艺、育种工作者当作培育黄色山茶系新品种的宝贵原始材料[4-5]。
金花茶植物中含有黄酮类[6]、多糖[7]、茶多酚[8]等多种活性成分,同时还含有丰富的天然微量元素,除了适宜制茶,还是一种传统中草药。近年来有关其活性研究表明,金花茶具有抗肿瘤[9]、抗氧化[10-11]、降血脂[12]、降血糖[13]等多种功效。近几十年来,广大园艺、育种和营养品及食品开发工作者针对这一珍稀物种在引种、资源收集与保存、生理研究[14]、优良单株选育[15]、繁育[16]、综合栽培技术以及加工利用方面[17]开展了大量的研究工作。特别是近年来,我国金花茶原产区对金花茶的花、叶的开发利用已初具规模[18],产品畅销,市场开发利用十分活跃,带动了大面积的规模化、集约化的基地种植。
金花茶主产于中国,主要分布于我国南部的广西,其次是越南,我国的贵州和云南及缅甸、泰国、马来西亚和日本等有少量分布或零星栽培[19]。根据目前资料统计,越南目前总共发现有22个金花茶物种,与我国金花茶主产区的广西接壤的越南北部地区,是越南金花茶主要分布中心。目前的文献均是对金花茶中的单一成分进行研究[20-21],未综合评价金花茶的药用价值,为此,笔者选取具有显著药用价值的主要活性成分总黄酮、总多糖、皂苷、茶多酚[22]为考察指标,对广西本地金花茶与越南引进金花茶的叶片进行分析,对比研究其在药用价值方面的差异性,旨在为选取开发利用价值高的金花茶优良品种提供参考。
1 材料与方法
1.1 仪器设备与试剂
UV-2550型紫外-可见分光光度计(日本岛津公司)、TP3200电子天平(上海精密科学仪器有限公司)、SK3310LHC超声波提取器(上海科导超声仪器有限公司)、L530低速离心机(湖南湘仪实验室仪器开发有限公司)、FW100高速万能粉碎机(天津泰斯特仪器公司)。
芦丁标准品:120 ℃下干燥至恒质量;葡萄糖:使用前于105 ℃恒温烘干至恒质量;人参皂甙:120 ℃下干燥至恒质量;没食子酸标准品(GA,相对分子质量188.14);标准品均采购于南宁冠鑫科技有限公司;乙腈、甲醇为色谱纯试剂;其他试剂均为分析纯。
1.2 试验材料
11种金花茶组植物栽培在广西壮族自治区林业科学研究院金花茶种植资源库,扦插苗,2~3年生。越南金花茶(塔姆岛金花茶C.tamdaoensis、箱田金花茶C. hakodae、罗斯曼金花茶C. rosmanii、多毛金花茶C. hirsute、黄抱茎金花茶C. murauchii、厚叶金花茶C. crassiphylla、箱宁金花茶C. phanii)于2015年7月引自越南三岛国家自然保护区。2016年6月28日,采集11种金花茶植物2年生老叶,经洗净烘干,用植物粉碎机粉碎成约50目,密封保存于-4 ℃冰箱中,备用。
1.3 试验方法
1.3.1 总黄酮含量测定
1.3.1.1 样品提取及测定
精密称取1 g粉碎后的金花茶叶至100 mL烧瓶中,加入50 mL的70%乙醇溶液,冷浸30 min后,在70 ℃下浸提2.0 h,放冷至室温,过滤,滤渣用70%乙醇溶液洗涤,合并滤液,然后将滤液移至100 mL容量瓶中定容,摇匀,作供试品溶液,待用。精密吸取供试品溶液0、1.0 mL,置于25 mL容量瓶中,分别加50%乙醇至10 mL,先加5%NaNO2溶液1 mL,静置6 min后加10% Al(NO3)3溶液1 mL,6 min后加4% NaOH溶液10 mL,再加50%乙醇后静置15 min,以加入0 mL供试品溶液为空白液,测定波长为510 nm。
1.3.1.2 线性关系考察
精密配制0.2 mg/mL芦丁标准品溶液,待用。分别取上述标准品溶液0.0、1.0、2.0、4.0、6.0、8.0 mL置于25 mL容量瓶中,参照1.3.1.1的方法配制一定浓度的标准品溶液,测定波长为510 nm,以芦丁含量(mg/mL)为纵坐标,吸光度为横坐标作标准曲线。得回归方程如下,在0.2~1.6 mg/mL之间有良好的线性关系。
A=0.3488C-0.002 7(R2=0.999 8)。
1.3.2 总多糖含量测定
1.3.2.1 样品提取及测定
称取样品0.1 g于离心管中,加入20 mL无水乙醇,充分混匀后超声提取1 h,提取温度为80 ℃,然后4 000 r/min离心10 min,弃去上清液,不溶物用10 mL乙醇溶液洗涤、离心。用水将上述不溶物转移至圆底烧瓶中,加入50 mL水,沸水浴回流提取2 h。冷却至室温,过滤,将上清液转移至100 mL容量瓶中,残渣洗涤2~3次,洗涤液转移至容量瓶,加水定容。吸取1.00 mL样品溶液于20 mL具塞试管中,测定吸光度,同时做空白实验。
1.3.2.2 线性关系考察
配制100 mg/L标准葡萄糖溶液:称取0.100 0 g葡萄糖于100 mL烧杯中,加水溶解,定容至1 000 mL,4 ℃冰箱中避光贮存。分别吸取0、0.2、0.4、0.6、0.8、1.0 mL标准液至试管中,蒸馏水补至1.0 mL。向试液中加入1.0 mL5%苯酚溶液,快速加入5 mL硫酸,静置10 min。充分混匀后将试管放置于30 ℃水浴中反应20 min,在490 nm处测吸光度,以质量浓度C为横坐标,吸光度A纵坐标,绘制标准曲线。得回归方程如下,在9.89~89.01 µg/mL之间有良好的线性关系。
A=0.0106C+0.073 6(R2=0.999 7)。
1.3.3 总皂苷含量测定
1.3.3.1 样品提取及测定
金花茶总皂苷含量测定采用香草醛-冰醋酸-高氯酸法[23]。精确称量5 g金花茶叶粉末,以1∶1的比例加入蒸馏水,于80 ℃下25 kHz浸提2 h,反复提取2次,合并提取液,过滤浓缩得金花茶提取液100 mL,然后慢慢加入3倍体积的无水乙醇,边加边搅拌,溶液中不断生成絮状沉淀,于4 ℃冰箱中静置24 h,离心分离,取上清液进行旋转蒸发至乙醇挥发完全,加入等体积的无水乙醚进行萃取,反复3次后取下层溶液浓缩得到待测液10 mL。精确吸取待测液1.0 mL,用甲醇溶液定容至100 mL备用。
1.3.3.2 线性关系考察
精确配制质量浓度为0.2284mg/mL的人参皂甙Rg1标准品溶液,置于-4 ℃冰箱中备用;准确配制5%香草醛-冰醋酸溶液,现配现用。准确吸取人参皂甙Rg1标准溶液0.1 mL,挥干甲醇后加入0.35 mL新配制的5%香草醛-冰醋酸溶液,1 min后,再加入1.0 mL高氯酸,于80 ℃的水浴中加热,25 min后取出,用冰水浴冷却10 min,冷却后加入5.0 mL冰醋酸,摇匀,静置15 min后于540 nm处测定吸光值,同时作空白对照。得回归方程如下,在24.4~122.0 µg/mL之间有良好的线性关系。
A=0.0066C+0.011 6(R2=0.999 0)。
1.3.4 茶多酚含量测定
1.3.4.1 样品提取及测定[24]
称取0.200 0 g均匀磨碎的试样,加入70 ℃的70%的甲醇溶液5 mL,在70 ℃水浴中浸提30 min,冷却后离心,取上清液,重复提取1次,合并上清液定容至10 mL,摇匀,过0.45 µm膜,然后用移液管移取2 mL至10 mL容量瓶中,用稳定溶液(分别将25 mL EDTA溶液、25 mL抗坏血酸溶液、50 mL乙腈加入500 mL容量瓶中,用水定容至刻度,摇匀)定容至刻度,摇匀,过0.45 µm膜,待测。
1.3.4.2 线性关系考察
配制没食子酸标准储备溶液(1 000 µg/mL):称取0.110±0.001 g没食子酸,于100 mL容量瓶中溶解并定容至刻度,摇匀(现配)。用移液管分别移取1.0、2.0、3.0、4.0、5.0 mL的没食子酸标准储备溶液于100 mL容量瓶中,分别用水定容至刻度,摇匀,质量浓度分别为10、20、30、40、50 µg/mL。用移液管分别移取上述标准溶液和水各1.0 mL于刻度试管内,在每个试管内分别加入5.0 mL的福林酚试剂,摇匀。反应3~8 min,加入4.0 mL7.5%Na2CO3溶液,加水定容至刻度,摇匀。室温下放置60 min。在765 nm波长条件下用分光光度计测定吸光度。以质量浓度C为横坐标,吸光度A为纵坐标,绘制标准曲线。得回归方程如下,在9.89~89.01 µg/mL之间有良好的线性关系。
A=0.0107C+0.033 7(R2=0.999 9)。
2 结果与分析
2.1 样品含量
取11种不同品种的金花茶组植物,分别测定其叶片的总黄酮、总多糖、总皂苷及茶多酚含量,结果见表1。
2.2 方差分析
使用SPSS19.0统计软件分析数据,不同金花茶组植物的主要活性成分含量的方差分析结果见表2。由表2中P值可见,这11种金花茶品种在4种主要活性成分含量方面差异均极显著,尤其是茶多酚的含量,差异最为显著(P值为1.41×10-13),其次为总黄酮、皂苷、总多糖的含量,P值分别为2.62×10-12、1.79×10-10、1.11×10-7。
2.3 聚类分析
使用SPSS19.0统计软件,以金花茶叶片中4种有效活性成分含量为参数组合,对11种金花茶组植物进行聚类分析,结果见图1。
结果显示,树状图结果与金花茶品种有明显的对应关系。当距离系数为10时,总体可以分为3大类,第1类有塔姆岛金花茶、罗斯曼金花茶、凹脉金花茶、箱宁金花茶、箱田金花茶;第2类有多毛金花茶、黄抱茎金花茶、厚叶金花茶;第3类有显脉金花茶、小花金花茶、普通金花茶。
第2类为药用价值最高的金花茶品种,生理活性成分含量最高,而且这3种金花茶均属于越南金花茶;而第3类为药用价值最低的金花茶品种,生理活性成分含量最低,且均属于广西本地金花茶。第1类为药用价值稍低的金花茶品种,其中包含4种越南金花茶和1种广西本地金花茶。所以,
比起广西本地金花茶,越南金花茶叶片药用价值较高,具有较好的开发利用价值。
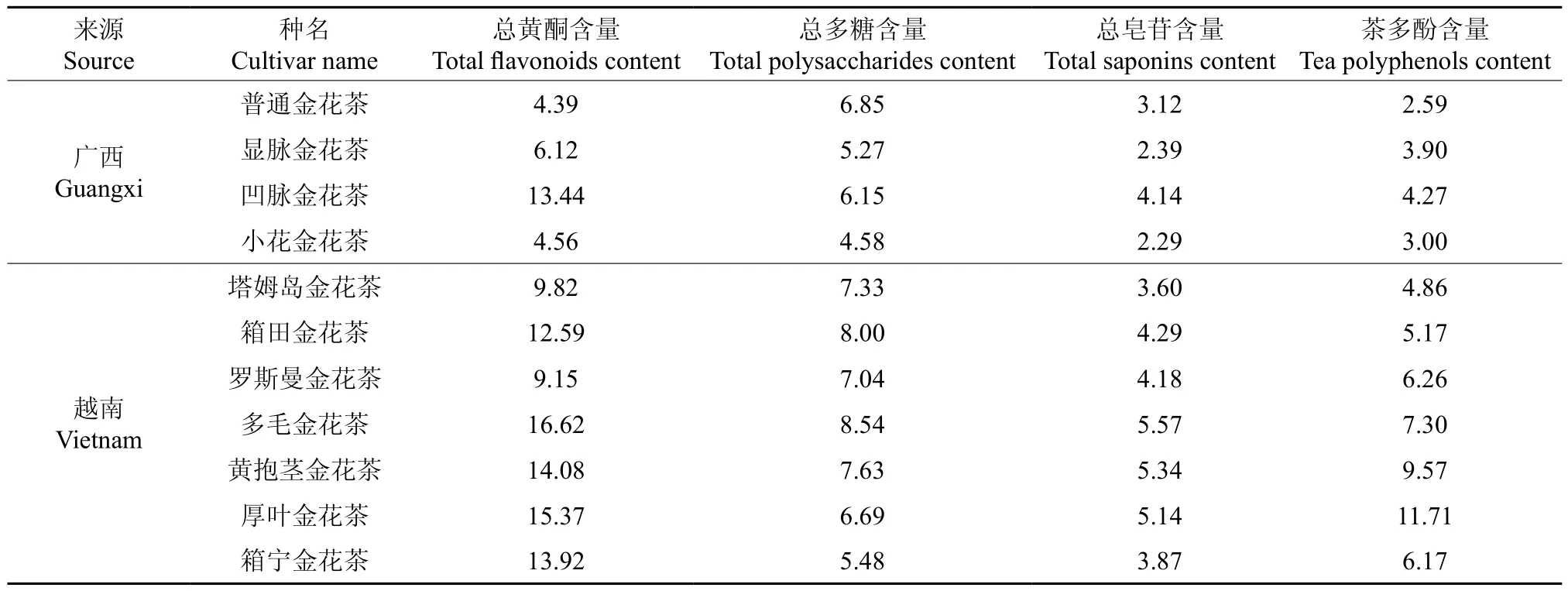
表1 11种金花茶组植物叶片中总黄酮、总多糖、总皂苷及茶多酚含量(n=3)Table1 Contents of total flavonoids, total polysaccharides, total saponins and tea polyphenols in leaves of11cultivars of C. sect. Chrysantha (n=3) %

表2 11种金花茶组植物叶片主要活性成分的方差分析Table2 Variance analysis of main active ingredient contents in leaves of11cultivar of C. sect. Chrysantha

图1 11种金花茶组植物的聚类分析Fig.1 Cluster analysis on11cultivars of C. sect. Chrysantha
3 结论与讨论
随着人们对营养健康的不断追求,天然植物营养成分与生物活性物质不断地被研究与开发[25],金花茶的营养保健及药用价值越来越受到人们的重视,开发具有保健及药用价值的产品已成趋势。
通过对11种金花茶组植物叶片主要活性成分含量进行分析,可知越南引种金花茶与广西本地金花茶在药用价值方面存在显著差异。越南金花茶中的多毛金花茶、厚叶金花茶、黄抱茎金花茶,药用价值较高,其叶片中4种主要活性成分总黄酮、总多糖、皂苷、茶多酚总含量达到38.03%、38.91%、36.62%,具有较好的栽培与利用价值。而广西本地金花茶中的普通金花茶、显脉金花茶和小花金花茶的叶片中,这4种主要活性成分总含量分别为16.95%、17.68%、14.43%,含量较低。黄兴贤等[26]对14种广西本地金花茶叶片的总黄酮含量进行了研究,其中普通金花茶和显脉金花茶叶片的总黄酮含量分别为3.079%和6.188%,与本研究结果相近,而凹脉金花茶叶片的总黄酮含量(2.037%)低于在本次研究中测得的13.44%。覃小玲等[27]用红外光谱方法对3种广西本地金花茶进行了对比分析,结果也表明,普通金花茶的黄酮、皂苷、多糖含量是最低的,这与本研究结果一致。
鉴于收集金花茶花朵的局限性,文中仅对越南金花茶和广西本地金花茶的叶片进行了研究,下一步将对其花的药用价值及优良品种的引进和选育进行研究。
[1] 梁盛业.金花茶[M].北京:中国林业出版社,1993:1-5.
[2] 傅立国.中国植物红皮书——稀有濒危植物:第1册[M].北京:科学出版社,1992.
[3] 黄燮才.金花茶开发利用概况及前景预测[J].中国中医药信息杂志,1994,1(6):10-11.
[4] Lv J, Chen R, Zhang M, et al. Plant regeneration via somatic embryogenesis and shoot organogenesis om immature cotyledons of Camellia nitidissima Chi[J]. Journal of plant physiology, 2013,170(13):1202-1211.
[5] 张乃燕,江泽鹏,陈林强,等.金花茶嫁接繁殖砧木亲和力试验[J].经济林研究,2007,25(3):55-58.
[6] 黄永林,文永新,刘金磊,等.5种金花茶中总黄酮含量的测定[J].中国中医药科技,2009,16(1):38-39.
[7] 许子竞,廖敏富,陈海燕,等.金花茶叶多糖超声波辅助提取工艺优化和含量测定[J].食品科学,2010,31(4):53-58.
[8] 李仁菊.广西金花茶中多酚的提取和抗氧化性能研究[D].南宁:广西大学,2007.
[9] Dai L, Li J L, Liang X Q, et al. Flowers of Camellia nitidissima cause growth inhibition, cell-cycle dysregulation and apoptosis in a human esophageal squamous cell carcinoma cell line[J].Molecular medicine reports, 2016, 14(2):1117-1122.
[10] Wang W X, Liu H Y, Wang Z N, et al. Phytochemicals from Camellia nitidissima Chi inhibited the formation of advanced glycation end-products by scavenging methylglyoxal[J]. Food Chemistry, 2016, 205:204-211.
[11] Song L X, Wang X S, Zheng X Q, et al. Polyphenolic antioxidant prof i les of yellow camellia[J]. Food Chemistry,2011,129:351-357.
[12] 宁恩创,秦小明,杨 宏,等.金花茶叶水提物的降脂功能试验研究[J].广西大学学报(自然科学版),2004,29(4):350-352.
[13] 夏 星,黄嘉骏,王志萍,等.金花茶叶的降血糖作用及急性毒性研究[J].时珍国医国药,2013,24(5):3-4.
[14] Yang Q H, Wei X, Zeng X L, et al. Seed biology and germination ecophsiology of Cammellia nitidissima[J]. Forest Ecology and Management, 2008, 255(1):113-118.
[15] 程金水,陈俊愉,赵世伟,等.金花茶杂交育种研究[J].北京林业大学学报,1994,16(4):55-59.
[16] 韦晓娟,梁晓静,李开祥,等.基质配比和换施肥量对塔姆岛金花茶容器苗质量的影响[J].中南林业科技大学学报,2017,37(2): 19 -23.
[17] 刘 云,蒲成伟,司佳颖,等.响应面法优化云南金花茶饮料工艺的研究[J].食品研究与开发,2017,38(4):65-70.
[18] 王元凤.金花茶叶营养成分分析及饮料加工工艺的研究[D].长沙:湖南农业大学,2001.
[19] Fu L K, Jin J M. China plant red data book-rare and endanger red plants: volume1[M].Beijing: Science Press, 1992.
[20] 牛广俊,朱 思,陈清英,等.金花茶不同部位多糖的测定及体外抗氧化活性[J].中国实验方剂学杂志,2014,20(20):168-172.
[21] 苏 琳,莫建光,韦英亮,等.金花茶叶皂苷类成分研究[J].中草药,2012,43(5):877-879.
[22] 牛广俊,陈清英,朱 思,等.用层次分析法多指标评价优选金花茶超声提取工艺[J].经济林研究,2015,33(1):119-122.
[23] 唐昭领,莫建光,黄 艳.响应面优化香草醛-冰醋酸-高氯酸法测定金花茶叶中总皂甙含量[J].广东农业科学,2014,41(13): 99-103.
[24] GB/T 8313-2008,茶叶中茶多酚和儿茶素类含量的检测方法[S].北京:中国标准出版社,2008.
[25] 朱 彬,钟海雁,曹清明,等.油茶活性成分研究进展与展望[J].经济林研究,2010,28(3):140-145.
[26] 黄兴贤,邹 蓉,胡兴华,等.十四种金花茶组植物叶总黄酮含量比较[J].广西植物,2011,31(2):281-284.
[27] 覃小玲,史艳财,韦 霄,等.FTIR比较分析与鉴定3种金花茶叶片中的化学成分[J].光谱实验室,2012,29(3):1303-1307.
