青麦仁种皮膳食纤维的提取及其抗氧化活性研究
2018-01-27张康逸温青玉王继红高玲玲康志敏
张康逸,温青玉,王继红,高玲玲,康志敏
(河南省农业科学院 农副产品加工研究所,河南 郑州 450008)
近年来,随着人民生活水平的提高和营养相关疾病的高发,消费者逐渐开始注重营养平衡和合理膳食[1]。青麦仁是乳熟后期、蜡熟期的小麦籽粒,色泽碧绿、口感独特,富含蛋白质、叶绿素、膳食纤维等营养成分,具有帮助人体消化、降低血糖的功能[2]。青麦仁种皮是小麦生长过程中未完全木质化的颖果表皮,富含丰富的膳食纤维,具有较好的市场开发前景。
膳食纤维(dietary fiber,DF)指不被人体所消化吸收的多糖类及木质素的总称[3],是继蛋白质、脂肪、碳水化合物、维生素、矿物质、水之后的第七大营养素[4]。根据溶解性的不同,可分为水溶性膳食纤维(soluble dietary fiber,SDF)和不溶性膳食纤维(insoluble dietary fiber,IDF)。SDF可调节人体糖脂代谢,降低胆固醇含量,对预防高血压、心梗、糖尿病等都具有较好的功效。IDF有吸收体内水分的功能以及防止便秘的良好功效[5]。
近年来,膳食纤维抗氧化活性研究逐渐成为热点。欧仕益等[6]研究发现,SDF和IDF都有清除自由基的作用,起主要作用的是膳食纤维中的多酚类物质[7]。因此,本试验通过酶-碱法、双酶法、超声辅助酶法、微波辅助酶法提取青麦仁种皮SDF和IDF,并研究其抗氧化活性,旨在为青麦仁深加工和生产利用提供参考。
1 材料和方法
1.1 试验材料
青麦仁(百农201);α-淀粉酶(3 700 U/g),北京奥博星生物技术有限责任公司;碱性蛋白酶(2×105U/g),北京索莱宝科技有限公司;芦丁标准品,苏州天可贸易有限公司;DPPH,梯希爱化成工业发展有限公司;NaOH、Al(NO3)3、K3[Fe(CN)6]、FeCl3、H2O2、C2HCl3O2、FeSO4等均为分析纯。
1.2 试验仪器
JW-1044R低速冷冻离心机,由安徽嘉文仪器装备有限公司生产;SY-5000旋转蒸发仪,由上海亚荣生化仪器厂生产;DF-101S集热式恒温加热磁力搅拌器,由河南省予华仪器有限公司生产;A590型紫外可见分光光度计,由翱翔仪器(上海)有限公司生产;XH-300UL电脑微波超声波紫外光组合催化合成仪,由北京祥鹄科技发展有限公司生产。
1.3 试验方法
1.3.1 青麦仁种皮的制备 采用李鹏飞等[8]的方法,将青麦仁种皮在烧杯中浸泡15 min,反复地冲洗,直至清洗液乳白色消失为止,倒掉清洗液,冲净,放进烘箱中低温烘干。冷却至室温,保存备用。
1.3.2 青麦仁膳食纤维的提取
1.3.2.1 酶-碱法 采用邓璀等[9]的方法,用锥形瓶称取25 g青麦仁种皮,放入锅中,然后加入10倍体积蒸馏水,蒸煮10 min,除去种皮中植酸;将温度降至65 ℃,调节pH 值6.5,加入质量分数为0.3%的α-淀粉酶,用电磁搅拌器持续搅拌,酶解30 min;在100 ℃灭酶10 min;将温度降至65 ℃,添加质量分数为5%的NaOH,碱解90 min;转速3 000 r/min,离心20 min;将上清液与沉淀分开,沉淀水洗,烘干,得到IDF;上清液冷却后加入一定体积的95%乙醇,沉淀12 h;使用旋转蒸发仪进行浓缩,除去乙醇;转速3 000 r/min,离心20 min,得到SDF;60 ℃,2 h,烘干至恒质量。
1.3.2.2 双酶法 参考Zhu等[10]和胡晓平等[11]的方法,并进行了部分修改。酶解温度65 ℃,调节pH值6.5,加入0.3%的α-淀粉酶,酶解15 min;再加入2%的NaOH溶液,调节pH值8.0,加入0.4%的碱性蛋白酶,碱解15 min。
1.3.2.3 超声辅助酶法 参考赵丽等[12]的方法,并进行了部分修改。酶解温度65 ℃,调节pH值6.5,加入0.3%的α-淀粉酶,超声功率300 W,酶解15 min;再加入2%的NaOH溶液,调节pH值8.0,加入0.4%的碱性蛋白酶,超声功率300 W,碱解15 min。
教师在初中阶段语文学科的教学中,要想合理利用微课这一现代化的教学工具,达到预期的教学效果,应对教学的课件进行精心的设计,既符合教材所设置的教学内容,又符合学生的实际认知水平,教师应仔细选取微课的音频视频,使得在课堂中能够灵活地使用微课。例如,教师在讲解《黄河颂》这一节课时,由于学生的生活阅历有限,有的没有见过黄河,很难想象出黄河的雄伟,从而不能与作者产生情感的共鸣,难以理解教材的内容。面对这一现象,教师可以充分利用微课这一现代化的教学工具,向学生播放相关的视频以及音频,使学生通过观看视频直观看到黄河的波澜壮阔,理解作者所表达的思想,从而激发初中学生对文本的兴趣,自主地学习[1]。
1.3.2.4 微波辅助酶法 参考赵丽等[12]的方法,并进行了部分修改。酶解温度65 ℃,调节pH值6.5,加入0.3%的α-淀粉酶,微波功率300 W,酶解15 min;再加入2%的NaOH溶液,调节pH值8.0,加入0.4%的碱性蛋白酶,微波功率300 W,碱解15 min。
1.3.3 抗氧化活性成分的提取 参考周小理等[13]的研究方法,并进行了部分修改。取青麦仁种皮的膳食纤维2 g,加入70%的乙醇溶液,料液比为 1∶50 (g/mL),在70 ℃恒温水浴锅中浸提 6 h,以3 000 r/min 的转速,离心15 min,取上清液保存待用。
1.3.4 抗氧化活性成分的测定
1.3.4.1 总黄酮含量的测定 采用Al(NO3)3法进行测定[12]。准确称量芦丁并用乙醇配制0.2 mg/mL的芦丁标准液,分别取0、1.00、2.00、3.00、4.00、5.00 mL的芦丁标准液,用70%的乙醇定容至10 mL,依次加入1.0 mL NaNO2溶液(50 g/L)、1.0 mL Al(NO3)3溶液(100 g/L)、4.0 mL NaOH溶液(200 g/L),每次滴加都要混合均匀,并静置一段时间,再用70%的乙醇定容至25 mL,摇匀,室温下放置25 min,在510 nm波长处测定吸光度。通过所测吸光度和质量浓度关系绘制标准曲线,得到回归方程,样品液用同样的方法测定吸光度,并通过吸光度大小计算其总黄酮的含量(mg/mL)。芦丁标准曲线回归方程如下:
Y=7.635 71X-0.002 38
式中:Y—样品吸光度;X—样品总黄酮的含量(mg/mL)。
1.3.4.2 DPPH清除率的测定 参考周小理等[13]的方法。准确称取DPPH,用无水乙醇配制成1.0×10-3mol/L的溶液,冷藏备用,使用时将其稀释10倍。移取1.0 mL 1.0×10-4mol/L DPPH-乙醇溶液与3.0 mL稀释4倍的待测样品液混匀,常温下放置30 min后,在波长571 nm处测得吸光度,按下式计算清除率[14]:
式中:A1—样品组;A2—样品对照组(将DPPH-乙醇溶液换成50%的乙醇溶液);A0—模型对照组(将样品液换成蒸馏水)。
1.3.4.3 还原能力的测定 参考侯丽娟等[15]的方法。取2.0 mL的样品溶液,依次加入pH值6.6的磷酸缓冲液(浓度0.2 mol/L),质量分数为1%的K3[Fe(CN)6] 溶液各2.5 mL,混合均匀,在50 ℃下保持20 min,加入质量分数为10%的C2HCl3O22.5 mL,混合均匀,以3 000 r/min的速度离心15 min,移取上清液5.0 mL,加入0.5 mL 0.1% FeCl3溶液和4.0 mL 蒸馏水,混合均匀,在常温下静置10 min后,倒入比色皿中,在波长700 nm处测吸光度。吸光度大小表示样品还原能力大小,吸光度越大,还原能力越大。
1.3.4.4 羟自由基清除能力的测定 采用Fenton反应体系模型[16],按顺序依次移取2.0 mL水杨酸乙醇溶液(6 mmol/L)、2.0 mL FeSO4(6 mmol/L)、1.0 mL样品溶液(稀释10倍)、0.1 mL H2O2溶液(6 mmol/L)于试管中,混匀,在37 ℃水浴中保温30 min,用510 nm波长测吸光度,计算羟自由基清除率,羟自由基清除率与抗氧化能力呈正相关,做3组平行试验降低试验误差。
按照下式计算清除率:
式中:A1—样品组;A2—样品对照组(H2O2换成蒸馏水);A0—模型对照组(样品液换成70%的乙醇溶液)。
1.3.5 数据分析 所得数据均为3次试验的平均值,试验数据采用Excel 2007进行统计处理,用SPSS 20软件进行差异显著性分析(P<0.05),用Origin 8.0软件进行绘图。
2 结果与分析
2.1 不同提取方法对青麦仁种皮膳食纤维提取率的影响
由表1可知,经酶-碱法提取青麦仁种皮SDF提取率最高,达到了30.44%,双酶法、超声辅助酶法、微波辅助酶法等其他3种方法的SDF提取率均较低;微波辅助酶法的IDF提取率最高,达到了65.69%,而酶-碱法的青麦仁种皮IDF提取率低于其他3种方法,仅达到28.24%。通过对比分析,酶-碱法提取青麦仁种皮中SDF为最优方法,微波辅助酶法提取IDF最优。

表1 不同提取方法对青麦仁种皮膳食纤维提取率的影响 %
2.2 不同提取方法对青麦仁种皮膳食纤维总黄酮含量的影响
黄酮类化合物是指2个具有酚羟基的苯环(A-环与B-环)通过中央三碳原子相互连结而成的一系列化合物,化合物结构中常连接有酚羟基、甲氧基、甲基、异戊烯基等官能团。由于其羟基取代的高反应性和其吞噬自由基的能力,这些化合物具有抗氧化活性的潜力。一般来说,总黄酮含量越高,样品成分抗氧化性越强,可作为初步判定膳食纤维抗氧化特性的指标。鲜食青麦仁种皮的膳食纤维中总黄酮含量见图1。

同一物质不同字母表示差异性显著(P<0.05),图2—图4同图1 不同提取方法的膳食纤维总黄酮含量
由图1可知,超声辅助酶法提取的SDF总黄酮含量最高,为1.486 mg/g,双酶法提取IDF所得总黄酮含量最高,为2.467 mg/g,酶-碱法制备的IDF和SDF中的总黄酮含量相对较低;用同类提取方法提取的膳食纤维,IDF中总黄酮含量高于SDF中的总黄酮含量。
2.3 不同提取方法对青麦仁种皮膳食纤维DPPH自由基清除能力的影响
DPPH法广泛用于定量测定生物试样、酚类物质及膳食纤维的抗氧化能力[17]。青麦仁种皮膳食纤维的DPPH自由基的清除能力对比见图2。
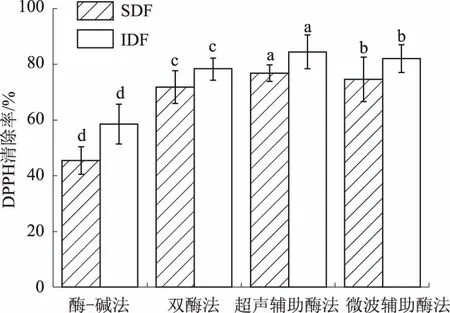
图2 不同提取方法的膳食纤维DPPH自由基清除能力
由图2可知,利用超声辅助酶法提取SDF和IDF,其DPPH自由基清除率均达到最高,分别为76.85%和84.28%;微波辅助酶法次之,分别为74.57%和82.00%;酶-碱法提取膳食纤维的DPPH自由基清除率最低;不同提取方法得到的同种膳食纤维,其DPPH清除率之间存在显著性差异(P<0.05)。
2.4 不同提取方法对青麦仁种皮膳食纤维还原能力的影响
还原能力的测定是以样品是否为良好的电子供体为指标,还原能力大的样品是良好的电子供体,其供应的电子不仅能使Fe3+还原成Fe2+,同时能与自由基反应,可使自由基的连锁反应中断,使其变成性质稳定的物质[18]。鲜食青麦仁种皮膳食纤维的还原能力见图3。
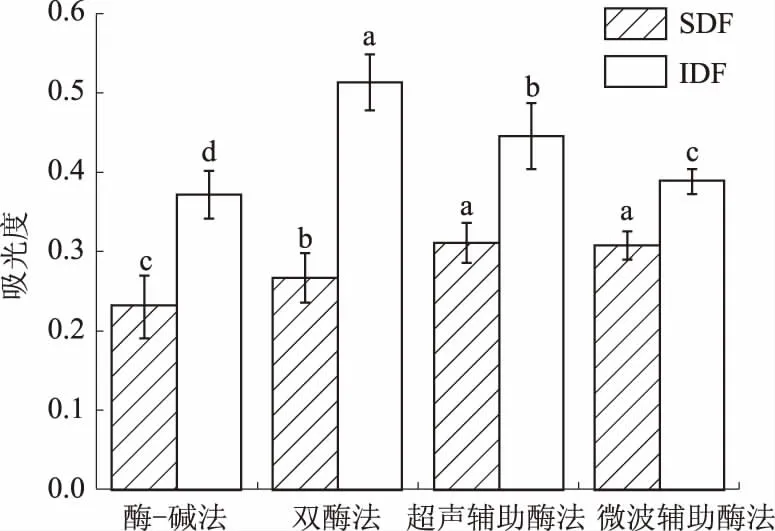
图3 不同提取方法的膳食纤维还原能力
由图3可知,超声辅助酶法提取的SDF还原能力最高,吸光度达到了0.312,微波辅助酶法次之,吸光度达到了0.309,两者无显著性差异(P>0.05),酶-碱法、双酶法提取的SDF还原能力较低。对于IDF,双酶法提取的IDF还原能力最高,吸光度达到了0.514;其次是超声辅助酶法提取的IDF,吸光度达到了0.446;酶-碱法提取的IDF还原能力最低。
2.5 不同提取方法对青麦仁种皮膳食纤维羟自由基清除能力的影响
羟基自由基是一种性质活泼的自由基,具有很强的攻击性,是危害性最大的活性氧。它可以和绝大多数活细胞中的生物大分子发生各种类型的反应,特别是嘧啶和嘌呤,反应速率极高,可直接损坏生物膜,导致一系列疾病的产生和辐射性损伤,可将青麦仁种皮膳食纤维的羟自由基清除率作为判断其抗氧化性的依据[19]。鲜食青麦仁种皮膳食纤维的羟自由基清除能力见图4。
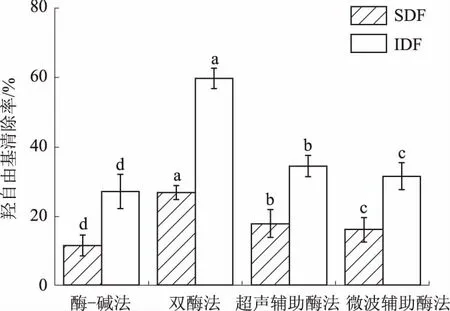
图4 不同提取方法的膳食纤维羟自由基清除能力
由图4可知,双酶法提取的SDF和IDF,其羟自由基清除率均达到最高,分别为26.95%和59.80%;超声辅助酶法次之,分别达到了17.96%和34.67%;不同提取方法得到的同种膳食纤维羟自由基清除率之间均存在显著差异性。与酶-碱法相比,双酶法、超声辅助酶法、微波辅助酶法等3种提取方法得到的膳食纤维羟自由基清除率均相对较高。
3 结论与讨论
青麦仁种皮中膳食纤维存在形式不是游离态,主要以络合物形态存在,与蛋白质、果胶等物质结合形成复合物。SDF和IDF的提取是通过破坏其络合物结合力,释放出游离态膳食纤维,进行提取纯化,得到纯度比较高的产品。本研究选择各种辅助蛋白酶酶解进行了高抗氧化性膳食纤维的制备,主要是因为蛋白酶能够水解蛋白质形成游离肽,释放游离膳食纤维,酶解的辅助方法能够加速SDF和IDF的释放。辅助方式的不同得到结果也不一致,碱性溶液有最适酶活,溶液的酶解率比较高,得到更多的水溶性膳食纤维;但碱性辅助容易破坏黄酮的结构,最终得到的青麦仁种皮SDF和IDF的抗氧化性比较弱,本试验结果证实,酶、超声、微波辅助酶解法得到的SDF较少,IDF较多,这些方法对黄酮结构的破坏比较小,其抗氧化性比较好。
本研究利用酶-碱法、双酶法、超声辅助酶法、微波辅助酶法4种提取方法制备了青麦仁种皮SDF和IDF;通过测定DPPH自由基清除能力、还原能力、羟自由基清除能力,对SDF和IDF进行评价分析,确定了超声辅助酶法制备高抗氧化性SDF和双酶法制备高抗氧化性IDF的2种最优提取方法。试验结果说明,青麦仁种皮是很好的制备高抗氧化性膳食纤维原料。在下一步的研究中拟重点优化高抗氧化性SDF的超声辅助酶法及高抗氧化性IDF的双酶法提取工艺,为其产业化开发利用提供大量基础数据和理论支撑。
[1] 张康逸,屈凌波.鲜食全谷物加工技术研究进展[J].粮食加工,2015,40(6):1-11.
[2] 刘杰.青麦仁加工让小麦轻松增值[J].科学种养,2014,46(2):58-59.
[3] 吴晖,侯萍,李晓凤,等.不同原料中膳食纤维的提取及其特性研究进展[J].现代食品科技,2008,24(1):91-95.
[4] 吴素萍.微波辅助酶法制备麦麸膳食纤维工艺条件的研究[J].粮油加工,2008(11):99-102.
[5] 黄桂英.膳食纤维与人体健康[J].中国食物与营养,2003(2):48-49.
[6] 欧仕益,李炎.麦麸膳食纤维清除羟自由基的研究[J].营养学报,1999,21(2):192-195.
[7] 张玉倩,赵乃峰,王成忠,等.膳食纤维功能特性与改性的研究[J].粮食加工,2010,35(5):57-59.
[8] 李鹏飞,陆红佳,任志远.不同方法提取麦麸膳食纤维的比较研究[J].现代农业科学,2009,16(6):7-9.
[9] 邓璀,李志建,李海峰,等.酶-化学法提取石磨小麦麸皮不溶性膳食纤维工艺研究[J].河南工业大学学报(自然科学版),2015,36(2):13-16.
[10] Zhu F M,Du B,Li R F,etal.Effect of micronization technology on physicochemical and antioxidant properties of dietary fiber from buckwheat hulls [J].Biocatalysis and Agricultural Biotechnology,2014,3(3):30-34.
[11] 胡晓平,王成忠.双酶法提取小麦麸皮膳食纤维及应用研究[J].粮食加工,2012,37(4):20-23.
[12] 赵丽,宋一茉,朱丹实,等.不同提取方法对鲜食大豆荚膳食纤维抗氧化特性的影响[J].食品工业科技,2015,36(20):155-158.
[13] 周小理,钱韻芳,周一鸣,等.不同处理工艺对苦荞麸皮膳食纤维体外抗氧化活性的影响[J].食品科学,2011,32(8):1-4.
[14] 石秀梅,雷激,梁爱华,等.3种来源膳食纤维抗氧化特性比较[J].食品科技,2013,38(1):71-75.
[15] 侯丽娟,牟建楼,何思鲁,等.不同提取方式对苹果渣中膳食纤维品质的影响研究[J].食品科技,2016,52(6):255-259.
[16] Smirnoff N,Cumbes Q J.Hydroxyl radical scavenging activity of compatible solutes [J].Phytochemistry,1989,28(24):1057-1060.
[17] 徐康,杜金华.干燥方法对黄秋葵抗氧化能力的影响[J].食品与发酵工业,2016,42(5):120-125.
[18] 邵娟娟,马晓军.豌豆皮膳食纤维吸附性质和抗氧化性质的研究[J].食品工业科技,2011,11(8):157-163.
[19] 张志旭,陈岳文,刘东波.苦瓜膳食纤维的抗氧化活性研究[J].现代食品科技,2012,47(8):933-935.
