玉米ZmGLDH基因的克隆与表达分析
2018-01-27朱素琴尹文娟许浣文
朱素琴,马 红,田 洋,尹文娟,许浣文,周 毅,杨 平
(1.南通大学 生命科学学院,江苏 南通 226019; 2.南通大学/农业部南方平原玉米科学观测实验站,江苏 南通 226019)
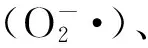
L-半乳糖途径是植物合成AsA的主要途径[4],其过程简示如下:D-葡萄糖→D-甘露糖-1-P→GDP-D-甘露糖→GDP-L-半乳糖→L-半乳糖-1-P→L-半乳糖→ L-半乳糖酸-1,4-内酯→ L-抗坏血酸。此途径中的一个关键酶是L-半乳糖酸-1,4-内酯脱氢酶(L-galactono-1,4-lactone dehydrogenase,GLDH),该酶催化L-半乳糖酸-1,4-内酯产生AsA。GLDH在植物体中以单体形态存在,对L-半乳糖酸-1,4-内酯有很高的特异性,定位于线粒体内膜[5]。在转反义GLDH基因的烟草中,AsA含量很低。GLDH基因的表达受光诱导,并调节植物体中的AsA含量[6]。
玉米(ZeamaysL.)是全球种植面积最大的粮食作物之一,中国是世界上第二大玉米生产国。玉米在生长发育过程中,不可避免地会遭遇干旱、高盐、低温等极端生长环境,这些非生物胁迫因素严重影响了玉米的生长发育,导致减产,甚至颗粒无收。玉米GLDH是玉米AsA合成途径中的关键酶,影响玉米AsA含量,进而影响玉米细胞的氧化还原状态,最终影响玉米的抗逆能力。玉米基因组中有1个GLDH基因(LOC 100381436),有关ZmGLDH基因在玉米生长发育,特别是在干旱、高盐逆境中的作用尚未见报道,鉴于此,根据MaizeGDB(http://www.maizesequence.org) 提供的序列设计引物,克隆得到玉米ZmGLDH基因,同时研究了盐胁迫对ZmGLDH基因表达的影响,分析了盐胁迫处理后玉米叶片中AsA含量的变化,为进一步研究该基因在玉米生长发育和抗逆反应中的作用奠定基础。
1 材料和方法
1.1 材料
以大面积种植的郑单958为试验材料。将种子暴晒1 d后,选取健壮饱满的种子,用多菌灵浸泡1 h,去离子水充分漂洗后浸泡20 h,再将玉米种子均匀排列在垫有2层滤纸的培养皿中,每皿100粒种子,于黑暗条件下30 ℃催芽,待胚根长至2~3 cm时,挑选长势良好的发芽种子置于霍格兰营养液中进行溶液培养。培养温度为30 ℃/25 ℃(昼/夜),相对湿度为65%~70%,光子通量密度(photon flux density,PFD)为600 μmol/(m2·s),培养玉米幼苗至三叶期。
将三叶期的玉米置于含有200 mmol/L NaCl的霍格兰培养液中进行处理,分别于处理后0(对照,CK)、0.5、1、2、3、4 h取材,进行AsA含量测定和ZmGLDH基因表达分析。
1.2 菌株、载体及生化试剂
大肠杆菌菌株为DH5α,由南通大学生命科学学院实验室保存。RNA提取试剂盒购自QIAGEN公司,限制性内切酶、卡那霉素(Kanamycin)购自TaKaRa公司,KOD-Plus-Ver.2、pTA2 载体、ReverTra Ace qPCR RT Kit购自TOYOBO公司,DNA凝胶回收试剂盒、质粒快速提取试剂盒购自北京鼎国昌盛生物技术有限公司,Trans DNA Marker Ⅳ、Trans Blue Plus protein Marker购自全式金生物技术公司。PCR引物合成、DNA测序由生工生物工程(上海)股份有限公司完成。克隆ZmGLDH基因所用引物序列为F:5′-TGCCGTCGCCGTCCATC-3′;R:5′-CCAGGGTAGGGTCCCAGAATC-3′。
1.3 ZmGLDH基因的克隆
根据玉米ZmGLDH基因序列(LOC 100381436)设计引物,以郑单958为试验材料,采用RT-PCR技术扩增ZmGLDH基因。PCR产物连接 pTA2 载体,转化大肠杆菌感受态细胞DH5α,涂布于含氨苄青霉素(Amp)的LB平板,37 ℃培养14~16 h,进行菌落PCR筛选。挑取阳性菌落于含Amp的LB培养基中,37 ℃、200 r/min振荡培养14 h,提取质粒,进行酶切鉴定,阳性菌液送生工生物工程(上海)股份有限公司测序。
1.4 实时荧光定量PCR分析
采用TOYOBO公司的SYBR Green RT-PCR One Step Kit及ABI 7500 Real time PCR仪进行实时荧光定量PCR分析。每个样品进行3次重复检测,Zmβ-actin作为内参基因。ZmGLDH基因荧光定量PCR引物序列为:5′-GTCCATTCGGGAGCAGCAGGT-3′/5′-CCAAGTCCACAGCGAGCAAGATA-3′,Zmβ-actin内参基因的引物序列为:5′-GGGACCTGACTGACTACCTC-3′/5′-TCATACTCCTGCTTGCTGAT-3′。按相对定量法计算目的基因相对表达量Rel.Exp=2-△△Ct,其中,△△Ct=(待测样品目的基因的Ct-待测样品内参基因的Ct)-(对照样品目的基因的Ct-对照样品内参基因的Ct)[7]。
1.5 AsA提取与含量测定
AsA的提取与含量测定按照张志良等[8]方法。AsA可以把铁离子还原成亚铁离子,亚铁离子与红菲咯啉(4,7-二苯基-1,10-菲咯啉,BP)反应,形成红色螯合物,在534 nm波长下有最大吸收峰,用比色法测定。
2 结果与分析
2.1 ZmGLDH基因的克隆
2.1.1 玉米总RNA的提取 采用QIAGEN公司的RNeasy Plant Mini试剂盒提取玉米叶片总RNA,琼脂糖凝胶电泳检测所提取的RNA。从图1可以看到清晰的2条带,分别是28S、18S的电泳条带,28S条带的亮度约为18S条带的2倍,说明提取的RNA比较完整。同时,用分光光度计测定了所提RNA的浓度和纯度,6个样本RNA的OD260/OD280值均在1.9~2.0,表明所提RNA质量符合克隆和荧光定量PCR的试验要求。
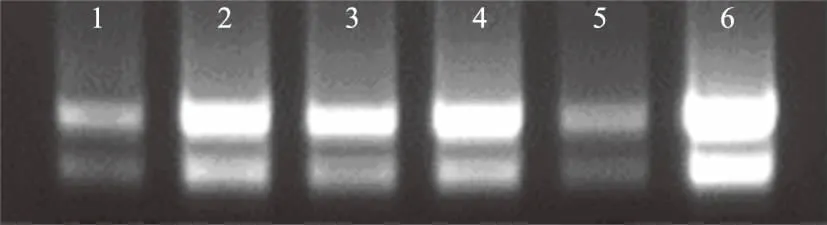
泳道1、2、3、4、5、6分别表示三叶期玉米在经过200 mmol/L NaCl处理0、0.5、1、2、3、4 h后所提取到的叶片RNA图1 玉米叶片RNA的琼脂糖凝胶电泳结果
2.1.2ZmGLDH基因的克隆与GLDH分子结构分析 根据ZmGLDH基因序列(LOC 100381436)设计引物,采用RT-PCR技术扩增ZmGLDH基因cDNA片段,克隆全长ZmGLDH基因,重组质粒pTA2-ZmGLDH的酶切鉴定结果见图2。阳性菌落送生工生物工程(上海)股份有限公司测序,测序结果比对分析显示,所测序列与MaizeGDB提供的序列一致。经GSDS在线软件分析,ZmGLDH基因有6个外显子、5个内含子,其全长cDNA序列包含一个1 761 bp的开放阅读框(open reading frame,ORF),编码586个氨基酸。
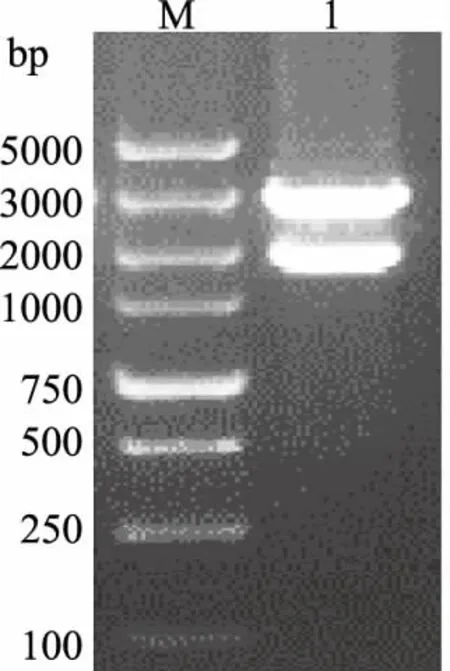
M.分子质量标记Trans 5k plus;1.EcoRⅠ酶切重组质粒pTA2-ZmGLDH图2 重组质粒pTA2-ZmGLDH的酶切鉴定结果
蛋白质氨基酸序列比对结果(图3)显示,玉米ZmGLDH(NP_001167748.1)与水稻OsGLDH(XP_015616655.1、XP_015619621.1)、高粱GLDH(XP_021317136.1)、谷子GLDH(XP_004977506.1)、拟南芥GLDH(NP_190376.1)的相似性分别为86%、86%、94%、94%、74%。根据UniProtKB/Swiss-Prot提供的分析结果,玉米ZmGLDH基因产物含586个氨基酸残基,第1—39位氨基酸肽段是转运肽,第40—81位氨基酸肽段是被去除的肽段,GLDH酶蛋白含有505个氨基酸残基(82—586位)。
TMpred-Prediction of Transmembrane Regions and Orientation预测ZmGLDH酶蛋白有3个跨膜肽段(图4):第132—154位氨基酸(23个氨基酸)为第1个跨膜肽段,第245—267位氨基酸(23个氨基酸)为第2个跨膜肽段,第472—496位氨基酸(25个氨基酸)为第3个跨膜肽段。ZmGLDH酶蛋白的N-末端位于线粒体内膜内侧、C-末端位于内膜外侧。第1个和第3个跨膜肽段由线粒体内膜内侧朝向线粒体内膜外侧,第2个跨膜肽段由线粒体内膜外侧朝向线粒体内膜内侧。Conserved domain search预测ZmGLDH酶蛋白分子中第104—239位氨基酸(136个氨基酸)的肽段是结合FAD的结构域(图4中双线表示)。结构域中有28个氨基酸(第104—131位氨基酸)位于内膜内侧,23个氨基酸(第1个肽段,第132—154位氨基酸)横跨内膜,85个氨基酸(第155—239位氨基酸)位于内膜的外侧,因此,ZmGLDH酶蛋白结合FAD结构域主要位于内膜的外侧[9-10],所以ZmGLDH酶蛋白是位于线粒体内膜外侧的膜结合酶。GLDH催化底物L-半乳糖酸-1,4-内酯脱氢生成AsA,同时,将高铁细胞色素C(Ferricytochrome C,氧化型)还原为亚铁细胞色素C(Ferrocytochrome C,还原型)。细胞色素C是呼吸链中介于复合体Ⅲ和复合体Ⅳ间且位于内膜外侧的重要电子传递体[11]。因此,AsA的从头合成途径与呼吸链的电子传递密切相关。

NP_001167748.1、XP_021317136.1、XP_004977506.1、NP_190376.1分别为玉米、高粱、谷子、拟南芥GLDH氨基酸序列登录号,XP_015616655.1、XP_015619621.1为水稻GLDH氨基酸序列登录号;氨基端灰色底纹大写字母:转运肽;带方框的字母:被去除的肽段;灰色底纹小写字母:跨膜肽段(跨膜方向和相关肽段由Tmpred-Prediction of Transmembrane Regions and Orientation预测);有下划线的字母:结合FAD的结构域

图4 ZmGLDH与线粒体内膜的结合
2.2 盐胁迫下ZmGLDH基因的实时荧光定量PCR分析
2.2.1 荧光定量PCR扩增曲线和熔解曲线 分别提取对照及200 mmol/L NaCl处理0.5、1、2、3、4 h的玉米叶片总RNA,逆转录合成cDNA,进行实时荧光定量PCR检测。图5中2组曲线分别是几个样品中ZmGLDH基因和内参Zmβ-actin基因的荧光定量PCR扩增曲线。从图5可以看出,ZmGLDH基因和内参Zmβ-actin基因的扩增曲线基线稳定,拐点清楚,各扩增曲线平行性好,曲线指数期斜率比较大。图6是ZmGLDH基因和内参Zmβ-actin基因的熔解曲线。对PCR产物加热,随着温度的升高,双链逐渐解开,导致荧光信号强度逐渐下降,到达某一温度时,会导致大量的PCR产物解链,荧光信号值急剧下降。不同PCR产物其Tm值不同,因此,使其荧光信号发生迅速下降的温度也不同,据此可对PCR产物的特异性进行鉴定。用PCR产物熔解过程中荧光信号值的负一次导数对温度作图,得到单一熔解峰,说明扩增的特异性较好。
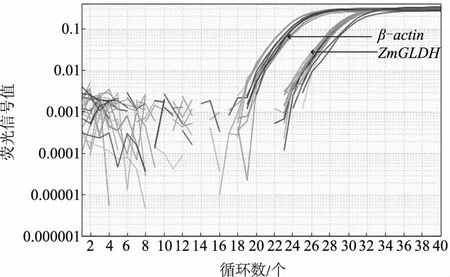
图5 ZmGLDH基因及内参基因Zmβ-actin的扩增曲线
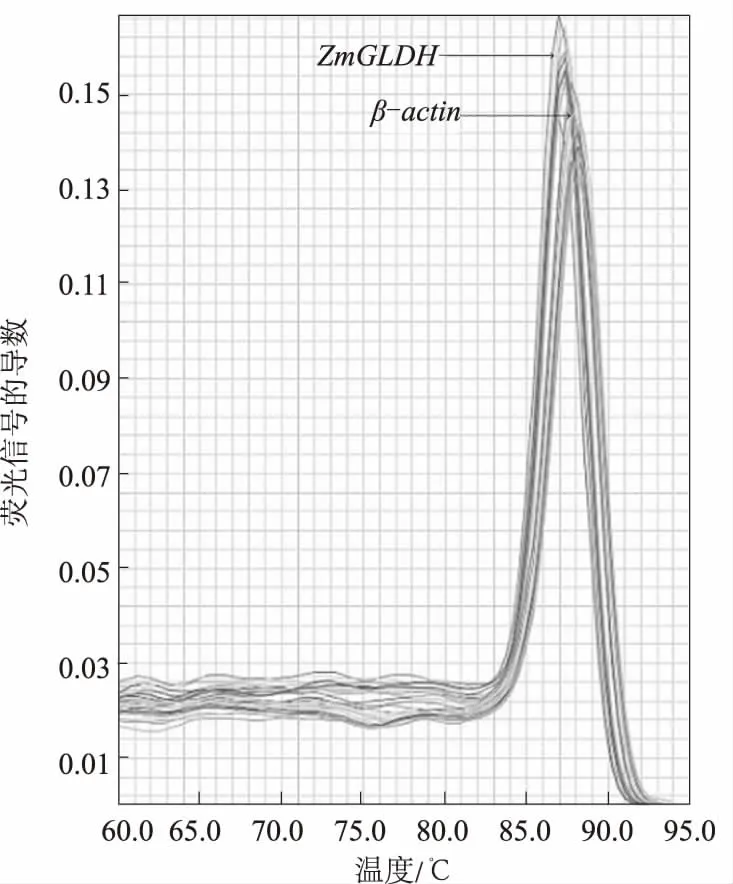
图6 ZmGLDH基因及内参基因Zmβ-actin的熔解曲线
2.2.2 盐胁迫对ZmGLDH基因表达的影响 根据ZmGLDH基因序列(LOC 100381436),利用NCBI-Primer软件设计扩增引物。采用荧光染料法在ABI 7500实时荧光定量PCR仪上进行RT-qPCR检测,Zmβ-actin看家基因作为内参标化玉米cDNA的量。从图7可以看出,经过高盐胁迫处理后,ZmGLDH基因的表达量上调。盐胁迫处理0.5 h,ZmGLDH基因的表达量略有增加,为对照的1.07倍;盐胁迫处理1 h,ZmGLDH基因的表达量继续增加,但上升幅度较小,为正常条件下的1.20倍;盐胁迫处理2 h,ZmGLDH基因表达量明显增加,为正常条件下的2.31倍,达到最高表达水平;盐胁迫处理3 h,ZmGLDH基因表达量略有下降,但仍高于对照组,为正常条件下的2.20倍;盐处理4 h,ZmGLDH基因表达量继续下降,为正常条件下的1.46倍。
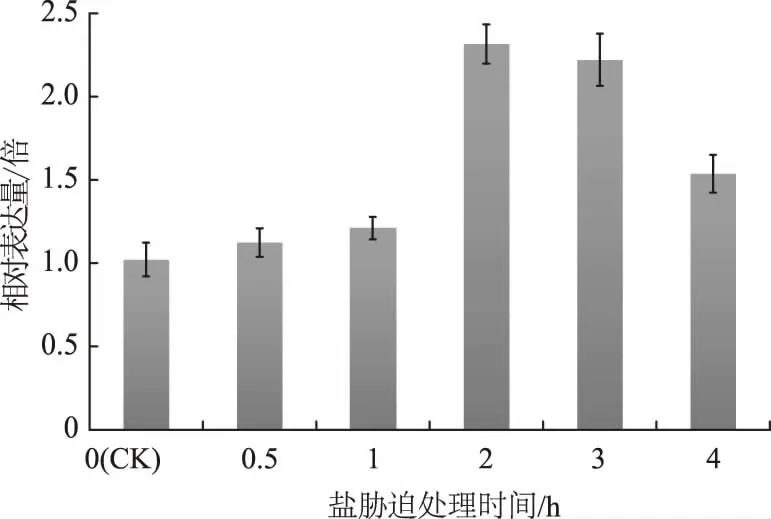
图7 盐胁迫下玉米叶片中ZmGLDH基因的表达量变化
2.3 盐胁迫对玉米叶片中AsA含量的影响
2.3.1 AsA标准曲线的绘制 以不同质量浓度AsA的OD534值对其相应浓度作图,得到标准曲线(图8)。曲线回归方程为y=0.251 7x+0.104 7,y表示AsA溶液在534 nm处的吸光度值,x表示溶液中AsA的质量浓度(mg/L)。如图8所示,AsA标准曲线的相关性很好,R2=0.993 9。
2.3.2 盐胁迫下玉米叶片中AsA含量的变化 如图9所示,盐胁迫处理后,玉米叶片中AsA含量发生变化。在盐胁迫处理1 h内,玉米叶片中AsA的含量变化不明显,随着盐处理时间的延长,玉米叶片中AsA含量增加。在正常条件下,玉米叶内AsA含量为0.762 8 mg/g;盐处理2 h,玉米叶内AsA含量为1.481 7 mg/g,是对照的1.94倍;盐处理 3 h,玉米叶内AsA含量为1.781 7 mg/g,是对照的2.33倍;随着盐处理时间进一步延长,玉米叶中AsA含量降低,盐处理 4 h,玉米叶内AsA含量为0.765 7 mg/g,与对照基本相同。
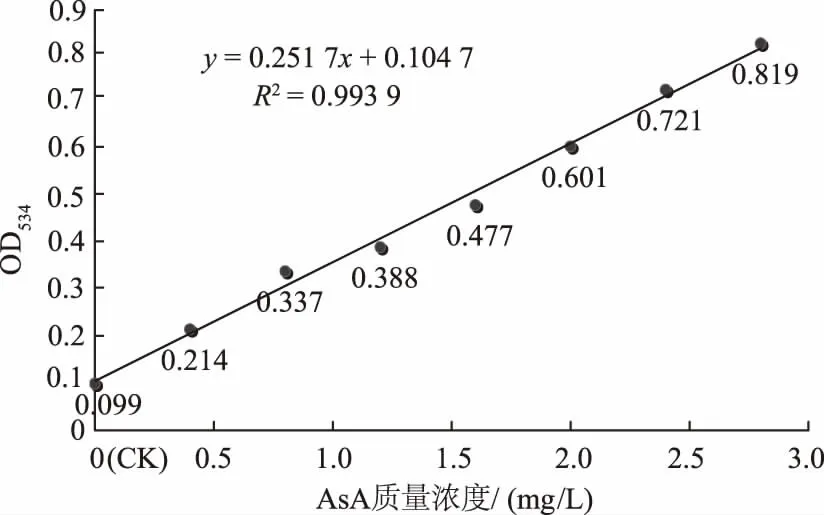
图8 AsA的标准曲线

图9 盐胁迫下玉米叶片中AsA含量的变化
2.4 玉米叶片中AsA含量与ZmGLDH基因表达量的相关性分析
比较图7与图9可以看出,盐胁迫处理后玉米叶片中AsA含量的变化趋势与玉米叶内ZmGLDH基因的表达量变化趋势基本一致,即在盐处理初期ZmGLDH基因的表达量和AsA含量的变化均不明显;盐胁迫处理2 h,ZmGLDH基因表达量达到最大,玉米叶内AsA含量也明显增加;盐胁迫处理3 h,ZmGLDH基因表达量仍然很高,其叶内AsA含量也达到最大。进一步对ZmGLDH基因表达量与玉米叶内AsA含量进行回归分析(图10),结果显示,ZmGLDH基因表达量与玉米叶内AsA含量呈正相关关系,R2=0.822 8,说明盐胁迫下玉米叶片细胞内ZmGLDH基因的表达水平是影响叶内AsA含量的主要因素。
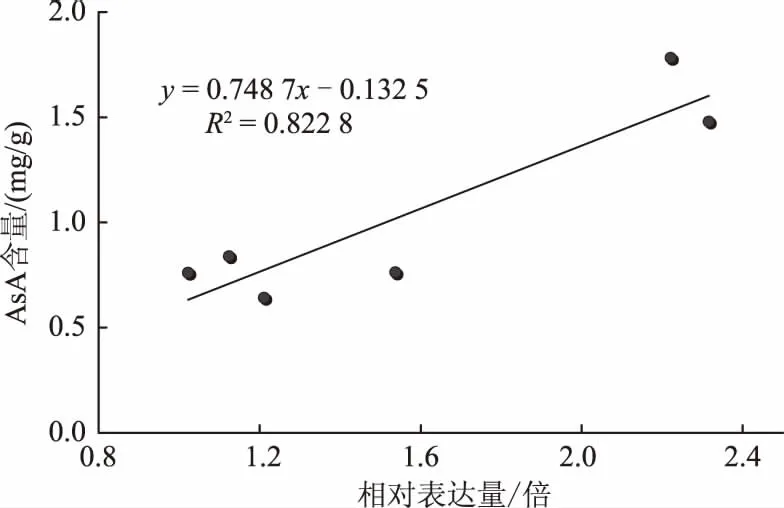
图10 盐胁迫下玉米ZmGLDH基因表达量与叶内AsA含量的回归分析
3 结论与讨论
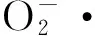
L-半乳糖途径被公认为是高等植物中合成AsA的主要途径,该途径的最后一步由GLDH催化L-半乳糖酸-1,4-内酯转变成L-抗坏血酸,是AsA合成的关键步骤。GLDH定位于线粒体内膜上,需要氧化态的细胞色素C(Cytochrome C,CytC)作为电子受体,CytC被还原,再把电子传递给复合体Ⅳ[11]。因此,AsA的从头合成与呼吸链电子传递状况有关。很多研究表明,GLDH基因的表达水平与植物体内的AsA含量密切相关[16-19]。本研究以玉米为材料,克隆了玉米GLDH基因,研究了ZmGLDH基因在盐胁迫条件下的表达特性,测定了盐胁迫下玉米叶片中AsA含量的变化,结果表明,ZmGLDH基因在盐胁迫条件下表达量的变化趋势与玉米叶片中AsA含量的变化趋势基本一致。GLDH在植物AsA的生物合成途径中所起的关键作用越来越受到研究者的重视,有关GLDH的生物化学特性、酶学特征、分子生物学特性、功能等方面的研究,也受到了业界的高度关注,并取得了一定的进展[20-21]。相信随着研究的不断深入,人们可以通过调控GLDH基因表达,实现对植物AsA生物合成的调控,为提高植物AsA含量并提高植物的抗逆能力提供一条有效途径。
[1] Smirnoff N.The function and metabolism of ascorbic acid in plants[J].Annals of Botany,1996,78(6):661-669.
[2] Davey M W,Montagu M V,Inzé D,etal.Plant L-ascorbic acid:Chemistry,function,metabolism,bioavailability and effects of processing[J].Journal of the Science of Food & Agriculture,2000,80(7):825-860.
[3] Foyer C H,Lelandais M.A comparison of the relative rates of transport of ascorbate and glucose across the thylakoid,chloroplast and plasmalemma membranes of pea leaf mesophyll cells[J].Journal of Plant Physiology,1996,148(3/4):391-398.
[4] Wheeler G L,Jonesm A,Smirnoff N.The biosynthetic pathway of vitamin C in higher plants[J].Nature,1998,393:365-369.
[6] Tamaoki M,Mukai F,Asai N,etal.Light-controlled expression of a gene encoding L-galactono-γ-lactone dehydrogenase which affects ascorbate pool size inArabidopsisthaliana[J].Plant Science,2003,164(6):1111-1117.
[7] Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△Ctmethod[J].Methods,2001,25(4):402-408.
[8] 张志良,瞿伟菁,李小方.植物生理学实验指导[M].北京:高等教育出版社,2009:21-23.
[9] Hofmann K,Stoffel W.TMbase—A database of membrane spanning protein segments[J].Biol Chem Hoppe-Seyler,1993,347(47):166.
[10] Imai T,Karita S,Shiratori G,etal.L-galactono-γ-lactone dehydrogenase from sweet potato:Purification and cDNA sequence analysis[J].Plant and Cell Physiol,1998,39(12):1350-1358.
[11] Bartoli C G,Pastori G M,Foyer C H.Ascorbate biosynthesis in mitochondria is linked to the electron transport chain between complexes Ⅲ and Ⅳ[J].Plant Physiology,2000,123(1):335-343.
[12] Smirnoff N.Ascorbate,tocopherol and carotenoids:metabolism,pathway engineering and functions[M]// Smirnoff N.Antioxidants and reactive oxygen species in plants.Oxford,UK:Blackwell Publishing Ltd.,2005:53-86.
[13] Athar H R,Khan A,Ashraf M.Exogenously applied ascorbic acid alleviates salt-induced oxidative stress in wheat[J].Environmental and Experimental Botany,2008,63(1/3):224-231.
[14] Smirnoff N.Ascorbic acid:Metabolism and functions of a multifaceted molecule[J].Current Opinion in Plant Biology,2000,3(3):229-235.
[15] Noctor G,Foyer C H.Ascorbate and glutathione:Keeping active oxygen under control[J].Annual Review of Plant Physiology and Plant Molecular Biology,1998,49:249-279.
[16] Tokunaga T,Miyahara K,Tabata K,etal.Generation and properties of ascorbic acid-overproducing transgenic tobacco cells expressing sense RNA for L-galactono-1,4-lactone dehydrogenase[J].Planta,2005,220(6):854-863.
[17] Alhagdow M,Mounet F,Gilbert L,etal.Silencing of the mitochondrial ascorbate synthesizing enzyme L-galactono-1,4-lactone dehydrogenase affects plant and fruit development in tomato[J].Plant Physiology,2007,145:1408-1422.
[18] Rodríguez-Ruiz M,Mateos R M,Codesido V,etal.Characterization of the galactono-1,4-lactone dehydrogenase from pepper fruits and its modulation in the ascorbate biosynthesis.Role of nitric oxide[J].Redox Biology,2017,12:171-181.
[19] Liu W,An H M,Yang M.Overexpression ofRosaroxburghiiL-galactono-1,4-lactone dehydrogenase in tobacco plant enhances ascorbate accumulation and abiotic stress tolerance[J].Acta Physiologiae Plantarum,2013,35(5):1617-1624.
[20] Leferink N G H,Jose M D F,van den Berg W A M,etal.Functional assignment of Glu386 and Arg388 in the active site of L-galactono-γ-lactone dehydrogenase[J].Febs Letters,2009,583(19):3199-3203.
[21] Schimmeyer J,Bock R,Meyer E H.L-galactono-1,4-lactone dehydrogenase is an assembly factor of the membrane arm of mitochondrial complex Ⅰ inArabidopsis[J].Plant Molecular Biology,2016,90(1/2):117-126.
