壳寡糖对PEG胁迫下小麦叶片AsA-GSH循环的影响
2018-01-27赵肖琼梁泰帅赵润柱
赵肖琼,梁泰帅,赵润柱
(1.太原工业学院 环境与安全工程系,山西 太原 030008; 2.山西医科大学 药学院,山西 太原 030001)
小麦(TriticumaestivumL.)是我国重要的粮食作物,是社会经济发展的基础,在确保国家粮食安全和水资源高效利用方面具有举足轻重的地位[1-3]。干旱是限制小麦高产稳产的主要环境因素之一。一般认为,干旱引起的渗透胁迫破坏了植物细胞内活性氧(reactive oxygen species,ROS)产生与清除之间的动态平衡,导致细胞内ROS过度累积,加剧膜脂过氧化损伤以及过氧化产物丙二醛(MDA)含量增多,抑制植物的正常生长发育[4]。抗坏血酸(AsA)-谷胱甘肽(GSH)循环是植物体内重要的ROS清除系统,并可调控体内的氧化还原势使信号转导系统朝着利于植物生长的方向进行[5]。因此,研究小麦体内AsA-GSH循环对干旱胁迫的生理响应具有重要意义。
壳寡糖(chitooligosaccharide,COS),又称寡聚氨基葡糖、壳低聚糖、甲壳低聚糖、甲壳胺寡糖等,是壳聚糖降解后的低分子质量产物,具有原料来源广、生产成本低、水溶性好、利于吸收等特点,在植物生长调节以及对非生物逆境胁迫的应答过程中发挥重要作用[6]。在植物生长调节方面,低浓度壳寡糖浸种能明显促进小麦[7]、黑麦草[8]和番茄[9]等植物的种子萌发和幼苗生长;显著提高黄瓜功能叶片的叶绿素含量、净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)和胞间CO2浓度(Ci),降低气孔限制值(Ls)[10];通过诱导脱落酸(ABA)和一氧化氮(NO)的产生调控烟草气孔开度[11]。在非生物胁迫应答方面,壳寡糖能提高干旱胁迫下油菜[12]和玉米[6]叶片超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性以及光系统 Ⅱ 活性;通过促进小麦幼苗脯氨酸、还原糖等次生代谢物的累积,增强其对低温寒害的抵抗能力[13];此外,壳寡糖还可缓解盐碱[14]和重金属镉[15]对植物的毒害作用。但迄今关于壳寡糖对干旱胁迫下小麦叶片AsA-GSH循环的影响知之甚少。因此,采用聚乙二醇(PEG-6000)处理模拟干旱胁迫,探讨了喷施壳寡糖溶液对不同抗旱性小麦叶片ROS累积、膜脂过氧化水平、AsA-GSH循环关键酶活性和中间代谢物含量的影响,旨在揭示壳寡糖提升小麦抗旱性的生理机制。
1 材料和方法
1.1 试验材料
供试小麦品种为普冰143(耐旱型)和郑引1号(干旱敏感型),种子由西北农林科技大学农学院提供。供试壳寡糖脱乙酰度≥85%,聚合度2~10,购于山东济南海得贝海洋生物工程有限公司。
1.2 试验设计
挑选健康饱满的小麦种子,经0.1% HgCl2浸泡消毒、蒸馏水洗净后,放入25 ℃的人工气候箱中催芽2 d。选择发芽均匀一致的种子移栽到盛自来水的塑料盆(19 cm×10 cm×6 cm)中,每盆100粒。当植株胚根长至20 mm时,水培液更换为1/2的Hoagland’s营养液,之后每3 d更换一次营养液。培养至两叶一心期,进行如下处理:1)CK,叶面喷施蒸馏水;2)COS,叶面喷施100 mg/L的壳寡糖溶液;3)PEG,营养液中添加20% PEG模拟干旱胁迫,叶面喷施蒸馏水;4)PEG+COS,营养液中添加20% PEG,叶面喷施100 mg/L的壳寡糖溶液。每处理重复3次,每天9:00叶面喷施蒸馏水和壳寡糖溶液,以叶片正反面均湿润且无液体滴下为宜。幼苗生长期间人工气候箱设置为:昼/夜温度25 ℃/20 ℃、光/暗周期14 h/10 h、光强180 μmol/(m2·s)。处理3 d后采收小麦叶片,用于各项生理指标的测定。
1.3 测定项目和方法
1.4 数据分析与处理
采用Microsoft Excel 2010、SPSS 17.0和Origin 9.0软件分别进行数据处理、差异显著性检验(P<0.05)以及绘图。
2 结果与分析
2.1 壳寡糖对PEG胁迫下小麦叶片和MDA含量的影响

不同处理不同小写字母表示差异达5%显著水平,下同图1 壳寡糖对PEG胁迫下小麦叶片和MDA含量的影响
2.2 壳寡糖对PEG胁迫下小麦叶片APX、DHAR、MDHAR、GR活性的影响
由图2可知,PEG胁迫下,2种小麦幼苗叶片中APX、DHAR、MDHAR、GR活性较CK均显著提高,普冰143分别增加了44.90%、37.18%、37.37%、17.68%,郑引1号分别增加了46.45%、20.58%、31.39%、10.96%,且普冰143叶片中4种关键酶的活性均显著高于郑引1号。与单一PEG胁迫相比,叶面喷施100 mg/L的壳寡糖溶液可进一步增强PEG胁迫下2种小麦叶片中的APX、DHAR、MDHAR、GR活性,普冰143分别增加了25.36%、14.75%、9.15%、13.35%,郑引1号分别增加了26.02%、14.49%、21.21%、15.02%。而与CK相比,喷施壳寡糖溶液明显增强了郑引1号叶片中的DHAR活性。

图2 壳寡糖对PEG胁迫下小麦叶片APX、DHAR、MDHAR和GR活性的影响
2.3 壳寡糖对PEG胁迫下小麦叶片AsA和DHA含量及AsA/DHA比值的影响
由表1可以看出,PEG胁迫下,2种小麦幼苗叶片中AsA含量和AsA/DHA比值较CK均显著增加,普冰143分别增加了38.64%和70.42%,郑引1号分别增加了35.42%和54.50%,且普冰143叶片中AsA含量和AsA/DHA比值均高于郑引1号;普冰143和郑引1号叶片中DHA含量较CK分别降低了19.23%和13.25%,但差异均不显著。与单一PEG胁迫处理相比,叶面喷施100 mg/L的壳寡糖溶液可明显增加PEG胁迫下2种小麦幼苗叶片中的AsA含量和AsA/DHA比值,普冰143分别增加了14.40%和58.45%,郑引1号分别增加了23.92%和59.43%;而普冰143叶片中DHA含量显著降低了28.32%,郑引1号叶片中DHA含量变化不明显。而与CK相比,叶面单一喷施壳寡糖溶液对2种小麦叶片中AsA、DHA含量和AsA/DHA比值的影响差异均不显著。
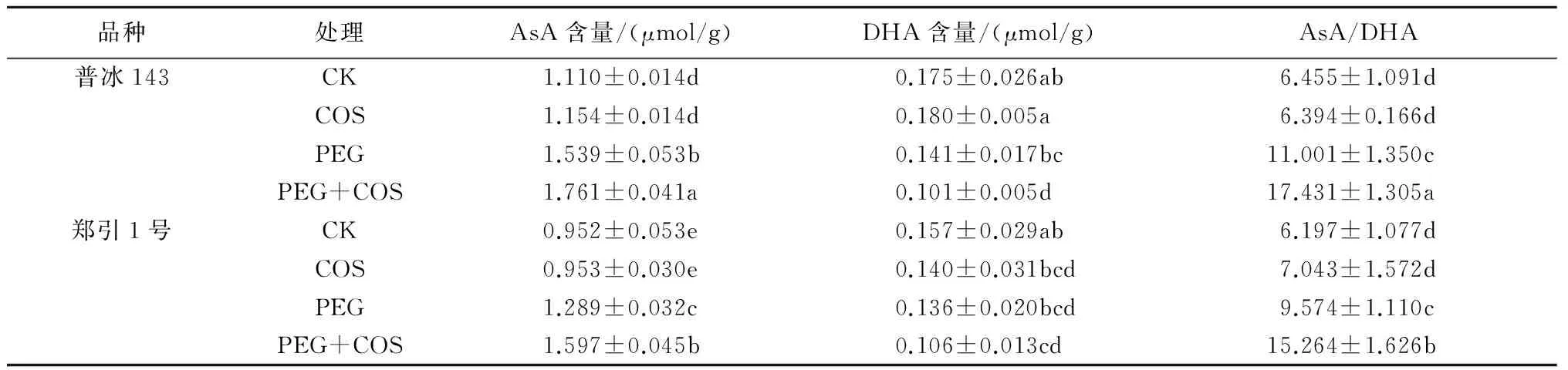
表1 壳寡糖对PEG胁迫下小麦叶片AsA和DHA含量及AsA/DHA比值的影响
注:同列中不同小写字母表示差异达5%显著水平,下同。
2.4 壳寡糖对PEG胁迫下小麦叶片GSH和GSSG含量及GSH/GSSG比值的影响
由表2可知,与CK相比,PEG胁迫下2种小麦幼苗叶片中GSH含量和GSH/GSSG比值显著增加,普冰143分别增加了58.60%和128.91%,郑引1号分别增加了47.41%和107.07%,且普冰143叶片中GSH含量和GSH/GSSG比值均显著高于郑引1号;而普冰143和郑引1号叶片中GSSG含量分别显著降低了30.49%和28.29%。与单一PEG胁迫相比,叶面喷施100 mg/L的壳寡糖溶液可进一步显著增加PEG胁迫下2种小麦幼苗叶片中的GSH含量和GSH/GSSG比值(普冰143叶片的GSH/GSSG比值除外),郑引1号分别增加了33.51%和20.15%,普冰143分别增加了21.74%、8.02%;而对GSSG含量的影响差异不显著。与CK相比,叶面单一喷施壳寡糖溶液对2种小麦幼苗叶片中GSH、GSSG含量和GSH/GSSG比值的影响差异均不明显。
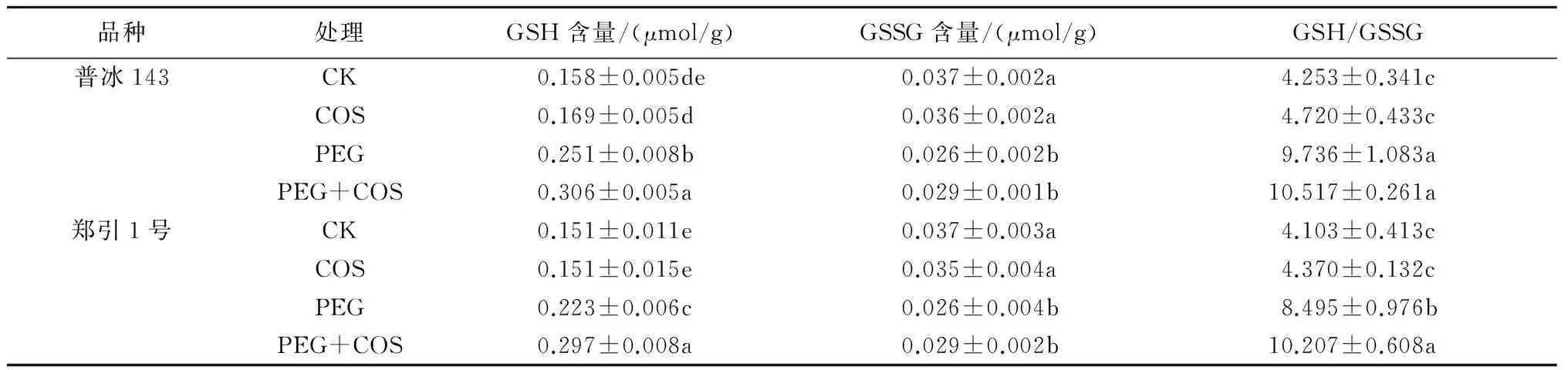
表2 壳寡糖对PEG胁迫下小麦叶片GSH和GSSG含量及GSH/GSSG比值的影响
3 结论与讨论


综上所述,20%PEG胁迫下,叶面喷施100 mg/L的壳寡糖溶液能够上调2种小麦叶片的AsA-GSH循环效率,保持较高且相对协调平衡的APX、DHAR、MDHAR和GR活性,增强AsA和GSH循环再生能力,维持细胞内较强的氧化还原状态(AsA/DHA和GSH/GSSG比值),从而及时清除细胞内过量累积的ROS,降低膜脂过氧化程度,提升小麦对干旱胁迫的抵抗能力。
[1] 丁会纳,马冬云,秦海霞,等.外源H2S对干旱胁迫下小麦旗叶生理特性及籽粒产量的影响[J].河南农业科学,2016,45(7):13-17.
[2] 贾少磊,吕金印,刘昌欣,等.PEG胁迫对抗旱性不同的小麦幼苗光合关键酶活性的影响[J].麦类作物学报,2014,34(7):976-982.
[3] 朱云集,田文仲,谢迎新,等.硫素对冬小麦旗叶抗坏血酸-谷胱甘肽循环系统的影响[J].西北植物学报,2010,30(11):2191-2196.
[4] 王有为,常云霞,罗陈萍,等.外源亚精胺对渍涝胁迫下芝麻幼苗根系生理特性的影响[J].河南农业科学,2016,45(12):29-33.
[5] 孙惠莉,吕金印,贾少磊.硫对镉胁迫下小白菜叶片AsA-GSH循环和植物络合素含量的影响[J].农业环境科学学报,2013,32(7):1294-1301.
[6] 孙君艳,董丽平,王付娟.干旱胁迫下壳寡糖对玉米叶片叶绿素含量、含水量及保护酶活性的影响[J].河南农业科学,2014,43(9):38-40,45.
[7] 张运红,赵小明,尹恒,等.寡糖浸种对小麦种子萌发及幼苗生长的影响[J].河南农业科学,2014,43(6):16-21.
[8] 扈学文,许秋瑾,金相灿,等.不同分子量壳寡糖对黑麦草种子萌发和幼苗抗病酶活性影响的研究[J].中国农学通报,2007,23(2):221-225.
[9] 顾丽嫱.壳寡糖对番茄种子萌发的影响[J].西南农业学报,2014,27(3):1233-1236.
[10] 郭卫华,赵小明,杜昱光.壳寡糖对黄瓜种子萌发和幼苗生长及光合特性的影响[J].中国农学通报,2009,25(3):164-169.
[11] 李艳,李洪艳,王青,等.壳寡糖、一氧化氮和植物激素在烟草气孔运动中的作用及其相互关系[J].植物生理学通讯,2010,46(6):575-578.
[12] 李艳,曾秀娥,李洪艳,等.壳寡糖对干旱胁迫下油菜叶片生理指标的影响[J].生态学杂志,2012,31(12):3080-3085.
[13] 王梦雨,王文霞,赵小明,等.壳寡糖对低温胁迫下小麦幼苗的保护作用及相关代谢产物的影响[J].麦类作物学报,2016,36(5):653-658.
[14] 刘强,王庆成,王占武,等.外源壳寡糖对苍耳盐害的缓解作用[J].东北林业大学学报,2014,42(6):73-76.
[15] 马莲菊,张阳,卜宁,等.壳寡糖缓解小麦镉毒害的某些生理特性研究[J].环境科学与技术,2010,33(6):31-34.
[16] 高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2006.
[17] de Pinto M C,Tommasi F,de Gara L.Enzymes of ascorbate biosynthesis and ascorbate-glutathione cycle in cultured cells of tobacco Bright Yellow 2[J].Plant Physiology and Biochemistry,2000,38:541-550.
[18] Ma F W,Cheng L L.The sun-exposed peel of apple fruit has higher xanthophyll cycledependent thermal dissipation and antioxidants of the ascorbate-glutathione pathway than the shaded peel[J].Plant Science,2003,165(4):1038-1048.
[19] Zhang J X,Kirkham M B.Antioxidant responses to drought in sunflower and sorghum seedlings[J].New Phytol,1996,132:361-373.
[20] 蔡庆生.植物生理学实验[M].北京:中国农业大学出版社,2013.
[21] 魏国平,朱月林,刘正鲁,等.硝酸钙胁迫对营养液栽培嫁接茄子叶片抗坏血酸-谷胱甘肽循环的影响[J].植物生态学报,2008,32(5):1023-1030.
[22] 刘建新,王鑫,李博萍.外源一氧化氮供体SNP对NaCl胁迫下黑麦草幼苗叶片抗坏血酸-谷胱甘肽循环的影响[J].草业学报,2010,19(2):82-88.
[23] 齐君,吕金印,李鹰翔,等.Cr3+胁迫对青菜中植物络合素含量及AsA-GSH代谢关键酶活性的影响[J].农业环境科学学报,2012,31(7):1303-1309.
[24] 李永生,方永丰,李玥,等.外源硫化氢对PEG模拟干旱胁迫下玉米种子萌发及幼苗生长的影响[J].核农学报,2016,30(4):813-821.
[25] 江洪强,刑兴华,周琴,等.外源α-萘乙酸对花期长期干旱大豆叶片抗氧化系统的影响[J].应用生态学报,2015,26(6):1718-1726.
[26] 马玉华,马锋旺,马小卫,等.干旱胁迫对苹果叶片抗坏血酸含量及其代谢相关酶活性的影响[J].西北农林科技大学学报,2008,36(3):150-154.
[27] 何小双,蒋晓琪,彭丹丹,等.H2S对干旱胁迫下白三叶幼苗抗氧化防御能力的影响[J].西北植物学报,2017,37(1):88-96.
[28] 高吉霞,龚春梅,刘西平.水分胁迫对刺槐叶和根谷胱甘肽抗氧化系统的影响[J].西北植物学报,2010,30(7):1409-1414.
